Le traitement du cancer du poumon non à petites cellules a connu des progrès extrêmement importants en peu de temps. Il peut être difficile de garder une trace de toutes ces innovations rapides, mais cela en vaut la peine. En effet, les patients peuvent d’ores et déjà tirer d’énormes avantages des nouvelles approches de traitement.
Classiquement, il existait des directives claires pour le traitement du cancer du poumon non à petites cellules en fonction du stade TNM. Celles-ci sont actuellement de plus en plus remises en question par le développement de nouvelles thérapies ciblées comme les inhibiteurs de tyrosine kinase de troisième génération ou les immunothérapies. Un exemple est la nouvelle recommandation de traitement d’entretien par un inhibiteur de checkpoints pendant un an après une radiochimiothérapie en cas d’expression de PD-L1 au stade III [1].
Nouveautés dans le traitement néoadjuvant
Il n’y a pas que pour le traitement d’entretien au stade III que de nouvelles approches thérapeutiques existent, de nouvelles options passionnantes sont également dans le pipeline dans le domaine du traitement néoadjuvant. Ainsi, on a récemment découvert qu’après seulement deux administrations néoadjuvantes d’un inhibiteur de PD-L1, de nombreux patients présentaient une proportion importante de cellules tumorales mortes dans la pièce de résection, et ce bien qu’une réponse ne soit pas nécessairement détectable radiologiquement [2]. Comme le risque de récidive augmente nettement avec la proportion de cellules tumorales vivantes dans les tissus enlevés [3], cette découverte est d’une grande pertinence pour le traitement et montre qu’un blocage du point de contrôle pourrait également représenter au moins une alternative valable à la chimiothérapie dans le traitement néoadjuvant. Différents médicaments sont actuellement testés dans ce domaine d’application, avec des résultats prometteurs jusqu’à présent. Même au stade IIIA, des effets positifs d’une immunothérapie périopératoire en plus de la chimiothérapie néoadjuvante ont été démontrés [4].
Diagnostic moléculaire
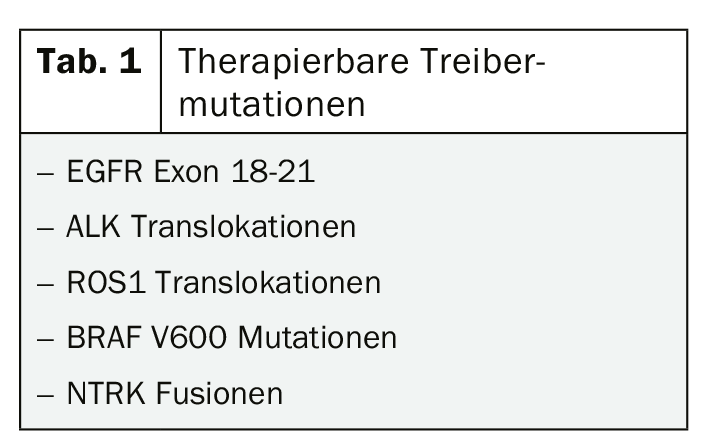
Si l’on considère le bénéfice potentiel d’un traitement par inhibiteur de tyrosine kinase ou d’une immunothérapie, même à un stade précoce de la tumeur, les directives en vigueur en matière de diagnostic moléculaire semblent plutôt réservées. L’analyse de l’expression de PD-L1 est recommandée pour les stades III et IV, le test des mutations courantes pour lesquelles il existe des thérapies ciblées approuvées n’étant recommandé que pour le stade IV. (Tab. 1). Ce concept doit certainement être remis en question à la lumière des données actuelles, où, par exemple, l’utilisation d’inhibiteurs de tyrosine kinase comme l’osimertinib en tant que traitement adjuvant pour les tumeurs mutées EGFR de stade inférieur suscite des espoirs fondés [5, 6].
Même si les nouvelles options de traitement, en particulier pour les NSCLC mutés, suscitent une certaine euphorie et que les tests moléculaires seront probablement développés dans un avenir proche, il faut garder à l’esprit que 80% des NSCLC ne présentent pas de mutation pilote pouvant être traitée. Cependant, pour les patients chez qui une mutation vulnérable a été détectée, la thérapie ciblée constitue le meilleur choix, du moins au stade IV. En conséquence, les choses ont beaucoup évolué dans ce domaine ces derniers mois, avec de nouvelles autorisations de mise sur le marché pour les inhibiteurs ALK, le brigatinib et le lorlatinib, entre autres.
Que faire s’il n’y a pas de mutation du pilote ?
Dans le cas plus fréquent où aucune mutation pilote n’est détectée dans un NSCLC de stade IV, il existe malheureusement moins de possibilités thérapeutiques. Cependant, les immunothérapies sont également de plus en plus utilisées pour ces tumeurs. Lorsque l’expression de PD-L1 est supérieure à 50%, les inhibiteurs de checkpoints ont été utilisés en premier lieu jusqu’à présent, et ils sont clairement supérieurs à la chimiothérapie dans ce groupe de patients. Indépendamment de l’expression de PD-L1, il a également été démontré que la combinaison d’une immunothérapie et d’une chimiothérapie était plus efficace que la chimiothérapie seule [7].
Depuis peu, des concepts supplémentaires apparaissent pour le traitement des NSCLC avancés sans mutation de pilote traitable, comme par exemple la combinaison de deux immunothérapies indépendamment du niveau d’expression de PD-L1 [8]. Cette approche semble clairement supérieure à la chimiothérapie seule, mais n’a pas encore été comparée à la combinaison immunothérapie-chimiothérapie. Les données actuelles indiquent que l’expression de PD-L1 n’est pas une condition obligatoire pour la réponse à l’immunothérapie, en particulier à l’immunothérapie intensifiée avec différentes classes d’agents.
Outre d’autres combinaisons thérapeutiques, de nouvelles cibles ont récemment été identifiées. Il s’agit notamment de TIGIT (T cell immunoreceptor with immunoglobulin and ITIM domain), qui est souvent exprimé en même temps que PD-L1. Une étude combinant un inhibiteur correspondant et un blocage de PD-L1 a fourni des premiers résultats prometteurs [9].
Le bon couvercle pour la bonne casserole
Une sélection correcte et aussi efficace que possible des patients pour la multitude de thérapies disponibles reste un point crucial. Des thérapies de plus en plus spécifiques et des groupes cibles plus petits contribuent à l’importance des marqueurs prédictifs et des diagnostics génétiques moléculaires fiables. Même si le pipeline bouillonne, il manque encore des données à plus long terme sur de nombreuses nouvelles substances et combinaisons. De nouvelles questions, de nouveaux obstacles, mais aussi de nombreuses autres possibilités apparaissent ainsi à tous les coins de rue. En bref, il n’y a qu’une chose à faire : persévérer !
Source : Forum für medizinische Fortbildung (FOMF), Refresher, Immunonkologika und gezielte Therapien – Présentation sur le thème “Non-kleinzelliges Lungenkarzinom” (cancer du poumon non à petites cellules), Livestream 20.06.2020, PD Dr. Niels Reinmuth, médecin-chef en oncologie à la clinique Asklepios
à Munich-Gauting (D).
Littérature :
- Antonia SJ, Villegas A, Daniel D, et al : Durvalumab after chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. New England Journal of Medicine. 2017;377(20) : 1919-1929.
- Forde PM, Chaft JE, Smith KN, et al : Neoadjuvant PD-1 Blockade in Resectable Lung Cancer. N Engl J Med. 2018;378(21) : 1976-1986.
- Hellmann MD, Chaft JE, William WN, Jr, et al : Réponse pathologique après chimiothérapie néoadjuvante dans les cancers du poumon non à petites cellules résécables : proposition d’utilisation de la réponse pathologique majeure comme critère de substitution. Lancet Oncol. 2014;15(1) : e42-50.
- Rothschild S, Zippelius A, Savic S, et al. : SAKK 16/14 : Anti-PD-L1 antibody durvalumab (MEDI4736) in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small cell lung cancer (NSCLC)-A multicenter single-arm phase II trial. Journal of Clinical Oncology. 2016;34(15_suppl): TPS8573-TPS.
- Zhong WZ, Wang Q, Mao WM, et al : Gefitinib versus vinorelbine plus cisplatine en tant que traitement adjuvant pour le NSCLC EGFR mutant de stade II-IIIA (N1-N2) (ADJUVANT/CTONG1104) : une étude de phase 3 randomisée, en ouvert. Lancet Oncol. 2018;19(1) : 139-148.
- Wu YL, Herbst RS, Mann H, et al. : ADAURA : Phase III, étude randomisée en double aveugle de l’osimertinib contre placebo dans les NSCLC précoces EGFR mutés positifs après résection chirurgicale complète. Clin Lung Cancer. 2018;19(4) : e533-e536.
- Jotte RM, editor IMpower131 : Primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC2018 ; ASCO Annual Meeting : American Society of Clinical Oncology.
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al : Nivolumab plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer. New England Journal of Medicine. 2019;381(21) : 2020-2031.
- Rodriguez-Abreu D, Johnson ML, Hussein MA, et al. : Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE). Journal of Clinical Oncology. 2020;38(15_suppl) : 9503.
InFo ONKOLOGIE & HÄMATOLOGIE 2020 ; 8(4) : 30-31 (publié le 20.9.20, ahead of print)
InFo PNEUMOLOGIE & ALLERGOLOGIE 2020, 2(3) : 34-35