Même à l’ère des inhibiteurs du VEGF et des points de contrôle, le pronostic du carcinome avancé des cellules rénales reste mauvais. L’utilisation de thérapies ciblées et d’approches immunothérapeutiques est difficile en raison du manque de cibles claires et de la faible immunogénicité. Néanmoins, il existe quelques nouveaux concepts de traitement qui pourraient façonner la gestion de cette maladie dans les années à venir et susciter un discret espoir pour l’avenir.
Actuellement, les inhibiteurs de checkpoint et de VEGF (Vascular Endothelial Growth Factor) sont au premier plan dans le traitement du carcinome métastatique des cellules rénales. Ainsi, les associations anti-VEGF/immunothérapie comme axitinib/pembrolizumab ou l’association d’immunothérapie nivolumab/ipilimumab sont généralement utilisées en première ligne. Certes, le pronostic s’est amélioré grâce à l’utilisation de ces substances, mais il reste une marge de progression. Avec le développement de nouvelles approches thérapeutiques telles que le blocage du facteur 2α inductible par l’hypoxie (HIF-2α), des étapes importantes sont en cours et pourraient contribuer à une prise en charge plus efficace dans un avenir proche. Outre l’inhibition de HIF-2α, l’accent est mis sur l’utilisation de l’interleukine-2 modifiée (IL-2) et de conjugués anticorps-médicament ainsi que sur des concepts thérapeutiques qui interviennent dans le métabolisme des cellules malignes.
Un regard en arrière
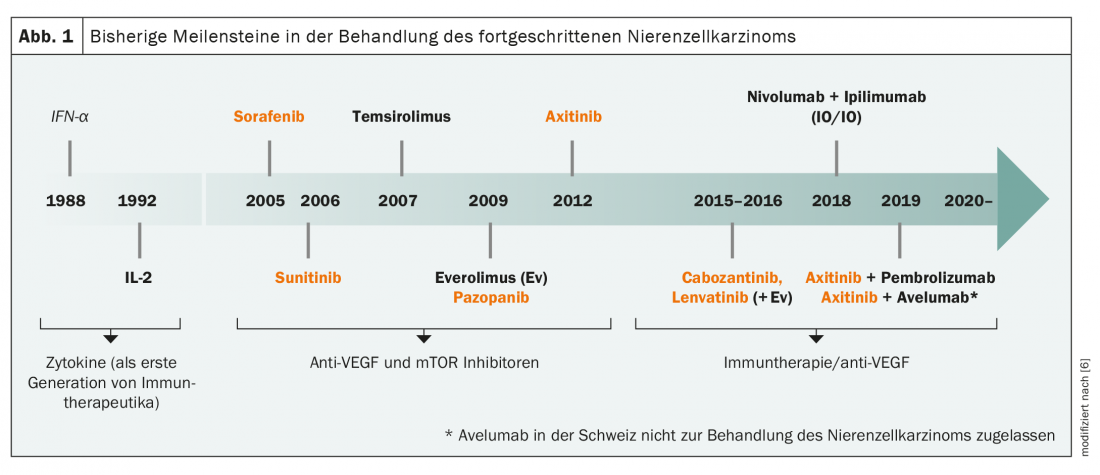
L’histoire de l’immunothérapie du carcinome rénal remonte aux années 1980, lorsque des cytokines telles que l’interféron-α et l’interleukine-2 ont été utilisées comme première forme d’immunothérapie (Fig. 1). Ensuite, les nouvelles options thérapeutiques sont restées longtemps silencieuses jusqu’à ce que le sorafenib, premier inhibiteur du VEGF, soit mis sur le marché en 2005. Le sunitinib, l’axitinib et le pazopanib ont été rapidement suivis par d’autres représentants de cette classe de médicaments, complétés par des inhibiteurs de mTOR comme l’évérolimus. Dans les années 2010, les inhibiteurs de points de contrôle pembrolizumab, nivolumab et ipilimumab ont marqué le début de la deuxième ère de l’immunothérapie dans le traitement du carcinome avancé des cellules rénales, si bien qu’aujourd’hui, un grand nombre de substances actives sont autorisées dans différentes combinaisons pour ce traitement. Néanmoins, la faible immunogénicité de la plupart des tumeurs et le manque de cibles claires rendent difficile l’utilisation de différents concepts d’immunothérapie et de thérapies ciblées. Il existe peu de cas dans lesquels une instabilité des microsatellites ou une augmentation du fardeau tumoral (Tumor Mutational Burden , TMB) – tous deux des marqueurs prédictifs pour les approches immunothérapeutiques – peuvent être détectés. Il n’y a pas non plus de mutations driver connues qui pourraient être des cibles thérapeutiques. Néanmoins, plusieurs essais cliniques de thérapies ciblées sont actuellement en cours, notamment sur les conjugués anticorps-médicament et le proto-oncogène MET.
Les thérapies ciblées : Conjugués anticorps-médicament et proto-oncogène MET
Le proto-oncogène MET pourrait à l’avenir gagner en importance, notamment dans le traitement du carcinome papillaire des cellules rénales, une maladie rare. Cependant, la monothérapie par le savolitinib et le crizotinib n’a pas été convaincante dans les études menées jusqu’à présent. Actuellement, les préparations sont testées dans le cadre de traitements combinés.
En ce qui concerne les conjugués anticorps-médicament, les développements actuels incitent également à la prudence. Ces médicaments sont constitués de trois composants : Un anticorps très spécifique des antigènes associés aux tumeurs, un agent de liaison qui est stable dans la circulation sanguine mais qui libère la substance active dans la cellule cible, et la substance active elle-même. Trois études récentes portant sur de tels conjugués anticorps-médicament ont dû être interrompues faute d’efficacité. En revanche, deux préparations qui font encore l’objet d’études cliniques sont le BA-3021 et le DS-6000a. Ce dernier médicament a pour principe actif le deruxtecan, qui est déjà utilisé avec succès dans le cancer du sein.
Inhibition de HIF-2α prometteuse
Les données relatives au blocage du facteur 2α inductible par l’hypoxie (HIF-2α) sont plus encourageantes et déjà un peu plus matures. Ce dernier s’accumule chez les personnes présentant une mutation du gène suppresseur de tumeur von Hippel-Lindau, ce qui représente 90% des patients atteints de carcinome rénal à cellules claires. La surproduction de HIF-2α crée un signal trompeur qui signale une pénurie d’oxygène, ce qui entraîne une augmentation de l’apport sanguin et une croissance plus rapide de la tumeur.
Le mécanisme pathogénique déclenché par HIF-2α peut être interrompu par le belzutifan, un inhibiteur sélectif de petites molécules. Celui-ci fait actuellement l’objet d’études cliniques assidues (tableau 1). Que ce soit en monothérapie ou dans le cadre de traitements combinés, cette substance s’est révélée prometteuse jusqu’à présent. Par exemple, dans une étude de phase I/II portant sur 55 participants, une réduction de la taille de la tumeur a été observée dans 64% des cas et le taux de réponse objective a été de 25%. Il faut tenir compte du fait qu’il s’agissait d’une population d’étude fortement prétraitée, la médiane des patients ayant déjà suivi trois lignes de traitement. La durée de réponse a dépassé six mois chez 71% des participants et 19 des 55 patients ont poursuivi le traitement après un an [1].
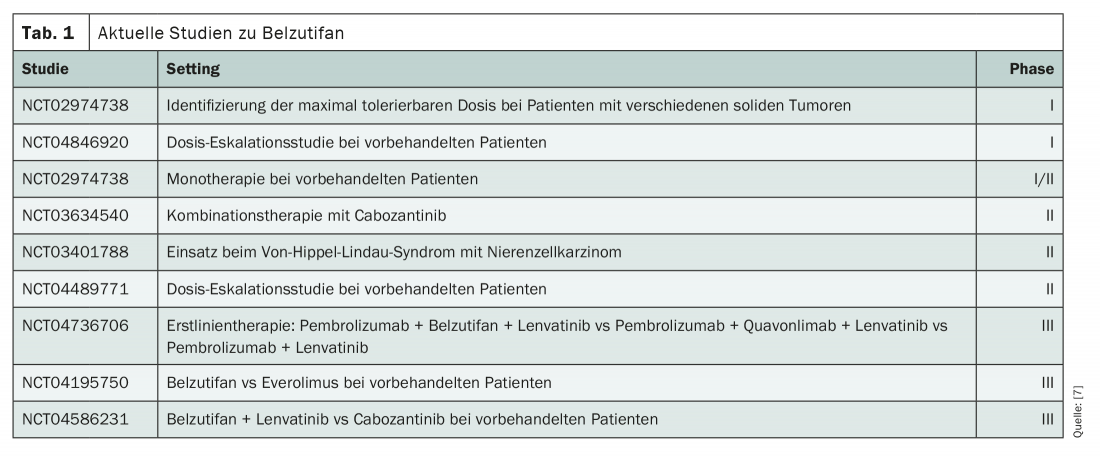
En combinaison avec le cabozantinib, une étude de phase II présentée récemment a montré des résultats similaires [2]. Ainsi, 88% des 41 patients prétraités ont vu leur tumeur diminuer, le taux de réponse objective était de 22% et la médiane de survie sans progression (PFS) de 16,8 mois. Après un an, 81% des patients étaient encore en vie. Des études de phase III examinent l’utilisation du belzutifan lui-même en première ligne. Ici, la substance est testée en combinaison avec le pembrolizumab et le lenvatinib. Dans les lignes de traitement ultérieures, le belzutifan est actuellement sur la sellette en monothérapie contre l’évérolimus et en association avec le lenvatinib contre le cabozantinib. Jusqu’à présent, l’anémie induite par le belzutifan, qui est due à une réduction de l’érythropoïétine, semble être le facteur limitant de la dose.
Le métabolisme des tumeurs en ligne de mire
Outre HIF-2α, le métabolisme des cellules malignes constitue également une nouvelle cible potentielle. Ainsi, la suractivation de la croissance cellulaire des cellules tumorales entraîne un métabolisme anormal du glucose. Ce phénomène, connu sous le nom d'”effet Warburg”, entraîne un manque de métabolites et une augmentation de la formation de lactate. Pour assurer un approvisionnement suffisant, les cellules malignes augmentent leur métabolisme de la glutamine. Celui-ci peut être perturbé par le télaglenastat, qui est actuellement testé en combinaison avec le cabozantinib dans une étude de phase I [3]. Jusqu’à présent, la molécule a montré une activité encourageante, avec une réponse continue dans les cas avancés.
Le telaglenastat est également étudié dans l’étude de phase II CANTATA, qui teste l’ajout de la substance au cabozantinib en deuxième et troisième lignes de traitement. 444 patients sans traitement préalable par cabozantinib ont été inclus, la fin de l’étude est prévue pour 2022. Malheureusement, dans une analyse publiée en janvier 2021, le critère d’évaluation principal PFS n’a pas été atteint. Si le profil de sécurité est bon, l’étude sera néanmoins poursuivie, notamment pour tester le telaglenastat dans d’autres entités comme le cancer du poumon non à petites cellules.
Retour aux sources : l’interleukine-2
L’interleukine-2 (IL-2) connaît actuellement une renaissance en tant qu’option thérapeutique potentielle dans le carcinome des cellules rénales. Les études initiales sur l’aldesleukine, menées dans les années 1980, montraient déjà souvent une durée de réponse impressionnante. Cependant, les taux de réponse au traitement étaient faibles et la substance s’est avérée toxique. Le taux de décès était de 4%, notamment en raison du syndrome de fuite capillaire provoqué par l’IL-2 [4]. Différentes modifications de l’IL-2 devraient maintenant permettre de prévenir ces effets négatifs et d’augmenter le taux de réponse. Par exemple, la liaison de la chaîne α peut être empêchée, ce qui entraîne moins d’effets secondaires et une augmentation de la prolifération des lymphocytes T effecteurs, tout en produisant moins de lymphocytes T régulateurs.
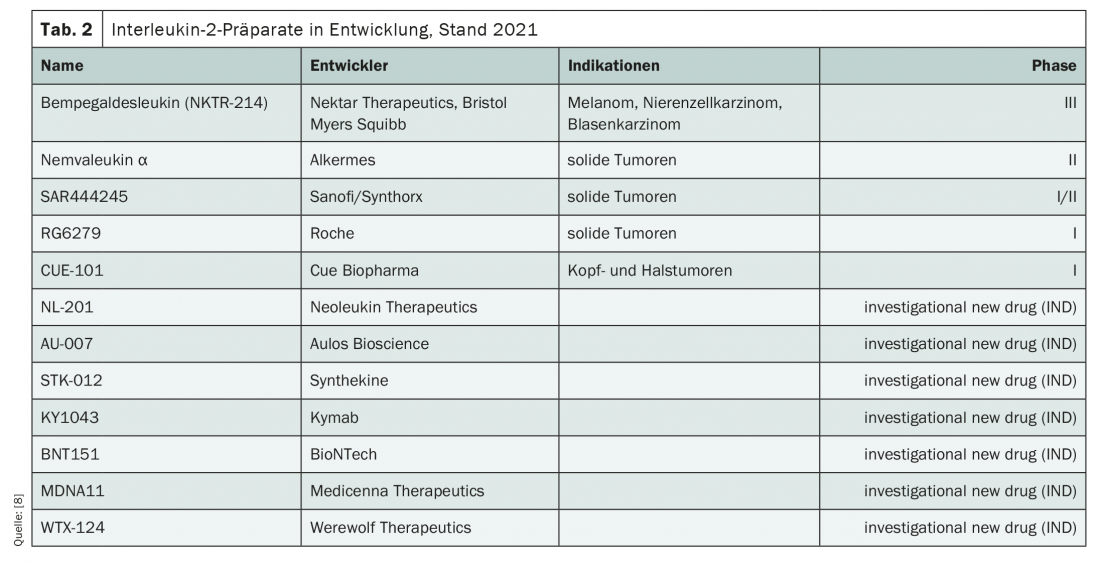
Un grand nombre de candidats IL-2 de différentes sociétés sont actuellement en développement (tableau 2). La Bempegaldesleukine, qui fait actuellement l’objet de l’étude de phase III PIVOT-09, est le produit pour lequel il existe le plus de données. Il devrait être utilisé dans le mélanome, le carcinome rénal et le cancer de la vessie. En association avec le nivolumab, le taux de réponse dans les premières études de phase I était de 71,4% en première ligne de traitement, contre 28,6% en deuxième ligne [5]. D’autres exemples de modifications chimiques de l’IL-2 sont Nemvaleukin α et SAR444245, qui font l’objet d’études de phase II pour une utilisation dans les tumeurs solides.
Quintessence
Même s’il faut attendre des données à plus long terme sur l’utilisation des inhibiteurs de HIF2α, de l’IL-2, des conjugués anticorps-médicament et des inhibiteurs du métabolisme de la glutamine dans le carcinome rénal à cellules claires et qu’il reste encore quelques obstacles à franchir avant une application clinique à grande échelle, les choses bougent dans le pipeline. Le blocage de HIF2α, en particulier, est prometteur dans les études cliniques. Ces succès ne peuvent toutefois pas masquer le fait qu’il manque toujours des options spécifiques, en particulier pour les sous-types papillaires, chromophobes et médullaires selon , et que des cibles appropriées doivent être identifiées.
Source : Présentation “Novel Targets and Promising New Therapies for Renal Cancer”, Howard Burries, American Association for Cancer Research (AACR) annual meeting, 09-14.04.2021, exécution virtuelle
Littérature :
- Bauer TM : The oral HIF-2 α inhibitor MK-6482 in patients with advanced clear cell renal cell carcinoma (RCC) : Updated follow-up of a phase I/II study2021 ; Présentation, Symposium sur les cancers génito-urinaires de l’American Society of Clinical Oncology (ASCO), 11-13.02.2021.
- Choueiri TK : Phase 2 study of the oral hypoxia-inducible factor 2α (HIF-2α) inhibitor MK-6482 in combination with cabozantinib in patients with advanced clear cell renal cell carcinoma (ccRCC) ; présentation, Genitourinary Cancers Symposium of the American Society of Clinical Oncology (ASCO), 11-13.02.2021.
- Meric-Bernstam F, et al : CB-839, un inhibiteur de la glutaminase, en association avec le cabozantinib chez les patients atteints de cancer rénal métastatique à cellules claires et papillaires (mRCC) : Résultats d’une étude de phase I. Journal of Clinical Oncology. 2019 ; 37(7_suppl) : 549.
- Fyfe G, et al : Résultats du traitement de 255 patients atteints de carcinome rénal métastatique qui ont reçu un traitement à haute dose d’interleukine-2 recombinante. J Clin Oncol. 1995 ; 13(3) : 688-696.
- Diab A, et al. : Bempegaldesleukin (NKTR-214) plus nivolumab chez les patients atteints de tumeurs solides avancées : étude de phase I par dosage et escalade de la sécurité, de l’efficacité et de l’activation immunitaire (PIVOT-02). Cancer Discov. 2020 ; 10(8) : 1158-1173.
- Choueiri T : Advanced Kidney Cancer Update – “A Glimpse into the Future”. Présentation, SOCIETY OF UROLOGIC ONCOLOGY (SUO) 21ST ANNUAL MEETING ; Washington, DC, décembre 2020.
- www.clinicaltrials.gov (dernier accès le 16.04.2021)
- Mullard A : Restaurer l’IL-2 à sa gloire d’immunothérapie du cancer. Nat Rev Drug Discov. 2021 ; 20(3) : 163-165.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(3) : 18-21 (publié le 17.6.21, ahead of print)