La prévalence croissante de l’insuffisance cardiaque constitue un problème médical et économique majeur. Le nombre de patients hospitalisés pour insuffisance cardiaque est en augmentation depuis plusieurs années. Le tableau clinique de l’insuffisance cardiaque est complexe. Les symptômes typiques sont notamment la dyspnée, la baisse des performances, l’épuisement et la rétention de liquide.
La prévalence croissante de l’insuffisance cardiaque constitue un problème médical et économique majeur [1]. Le nombre de patients hospitalisés pour insuffisance cardiaque est en augmentation depuis plusieurs années. Les coûts associés pour le système de santé sont élevés [1,2].
L’insuffisance cardiaque est définie comme l’incapacité du cœur à fournir suffisamment de sang et d’oxygène à l’organisme pour assurer un métabolisme stable dans des conditions de repos et d’effort. Le tableau clinique de l’insuffisance cardiaque est complexe. Les symptômes typiques sont notamment la dyspnée, la baisse des performances, l’épuisement et la rétention de liquide [1,2].
Les recommandations actuelles de l’ESC font une distinction entre les insuffisances cardiaques avec fraction d’éjection ventriculaire gauche réduite (Heart Failure with reduced Ejection Fraction, HFrEF ; FE 50%) [1]. Chacune de ces trois catégories d’insuffisance cardiaque est associée à un mauvais pronostic avec une morbidité et une mortalité accrues [1,2].
Insuffisance cardiaque avec réduction de la fraction d’éjection du ventricule gauche (FEVG)
Malgré d’énormes progrès avec un large éventail d’options thérapeutiques en pharmacologie et en thérapie de dispositif (DAI, CRT) jusqu’aux procédures interventionnelles ou chirurgicales (clip de Mitra, VAD), le pronostic des patients atteints d’HFrEF reste mauvais [1]. Au cours d’une période de suivi moyenne de 47 mois, la mortalité chez les patients HFrEF avec une FE VG de 35-50% était de 32%. Avec une FE VG <35%, la mortalité est passée à 41% à [1–3].
La capacité cardiopulmonaire, mesurée par la consommation maximale d’oxygène en spiroergométrie (pic de VO2 ml/min-1/kg-1), est nettement réduite chez les patients atteints d’HFrEF. Elle est plus faible chez les femmes que chez les hommes et diminue encore plus nettement avec l’âge et après une décompensation [3].
La VO2 de pointe est considérée comme un prédicteur significatif de la mortalité totale [3] et une VO2 de pointe inférieure de 1 ml/min-1/kg-1 est associée à une mortalité totale supérieure de 16% [3]. Les causes de la réduction des performances en cas d’HFrEF sont la diminution de la fonction de pompage du ventricule gauche, la réduction de la capacité pulmonaire due au dysfonctionnement cardiaque et un déconditionnement significatif des muscles squelettiques périphériques avec une masse musculaire réduite [1,3]. La sarcopénie (muscle wasting) existe chez 30 à 50% des patients atteints de HFrEF [3]. En outre, un manque d’adaptation de la fréquence cardiaque (incompétence chronotrope) et une irrigation sanguine insuffisante des muscles périphériques due à la vasoconstriction périphérique en cas d’hyperstimulation neuroendocrinienne et sympathicotonique peuvent également limiter les performances physiques.
Insuffisance cardiaque avec fraction d’éjection ventriculaire gauche (FEVG) préservée
La physiopathologie de l’insuffisance cardiaque avec FE VG préservée (HFpEF) est complexe, hétérogène et n’a pas encore été complètement élucidée [2]. L’HFpEf est souvent associée à des comorbidités telles que le diabète sucré et l’hypertension. Au premier plan, on trouve d’abord un trouble du remplissage du ventricule gauche (dysfonction diastolique), généralement accompagné d’une hypertrophie ventriculaire gauche et d’une fonction de pompe initialement préservée. Les troubles microvasculaires peuvent ensuite entraîner des lésions myocardiques et une réduction de la fonction systolique du ventricule gauche [2]. Outre les symptômes cliniques (dyspnée, diminution des performances, rétention hydrique), l’HFpEF est définie par une FE-VG ≥50%, une augmentation des peptides natriurétiques (BNP >35 pg/ml, NT-proBNP >125 pg/ml) et la mise en évidence par échocardiographie d’une cardiopathie structurelle (hypertrophie ventriculaire gauche, hypertrophie de l’oreillette gauche) ou d’un dysfonctionnement diastolique [1,4]. On estime que les patients atteints d’HFpEF représentent environ 50% de la population totale souffrant d’insuffisance cardiaque. Le pronostic de ces patients est aussi mauvais que celui des patients atteints de HFrEF [1,4]. Contrairement à l’HFrEF, le traitement pharmacologique des patients atteints d’HFpEF n’est pas assuré. La morbidité et la mortalité des patients atteints d’HFpEF n’ont pas pu être réduites jusqu’à présent par une pharmacothérapie inspirée du traitement de l’HFrEF [1,4]. La prévention et le traitement des facteurs de risque cardiovasculaire et des comorbidités de l’HFpEF revêtent donc proportionnellement une importance encore plus grande.
Les patients atteints d’HFpEF sont généralement plus âgés, plus souvent des femmes, souffrent plus souvent de diabète de type 2 et/ou d’hypertension et présentent plus de maladies associées. Ces patients sont souvent très symptomatiques, leur capacité physique au quotidien est fortement limitée et la qualité de vie s’en trouve nettement réduite [1,3,4], malgré une FE VG normale ! Des études récentes montrent que l’insuffisance cardiaque chez les patients atteints d’HFpEF est associée à des mécanismes d’adaptation périphériques comparables à ceux des patients atteints d’HFrEF, à savoir un déconditionnement musculaire squelettique important et une masse musculaire périphérique réduite [6].
Chez les patients HFpEF, une capacité physique réduite est associée à une augmentation significative de la morbidité et de la mortalité [3]. Cependant, les premières études montrent que l’amélioration des performances physiques est également associée à une diminution de la mortalité globale [5]. Dans ce contexte et en l’absence d’une pharmacothérapie sûre, l’entraînement physique revêt une importance primordiale dans le traitement des patients atteints d’HFpEF [1,4].
Activité physique et entraînement en cas d’insuffisance cardiaque (HFrEF et HFpEF)
En conséquence de l’insuffisance cardiaque avec dyspnée d’effort, fatigue et épuisement, la prévalence de l’inactivité physique de longue durée est très élevée dans ce collectif [3]. Des interventions d’entraînement personnalisées peuvent lutter efficacement contre le déconditionnement des muscles squelettiques et ses effets négatifs sur les activités de la vie quotidienne. De cette manière, l’activité physique régulière peut contribuer de manière très efficace à la stabilisation des capacités physiques et à l’amélioration de la qualité de vie des patients atteints d’HFrEF et d’HFpEF [3].
Depuis des décennies, l’entraînement physique a fait l’objet de nombreuses études dans le cadre du traitement des patients atteints de HFrEF et a été évalué dans des revues systématiques et des méta-analyses. Ceux-ci confirment unanimement la sécurité et la grande efficacité des interventions d’entraînement chez les patients HFrEF [3]. Ce n’est que ces dernières années que la science s’est intéressée à l’entraînement physique chez les patients atteints de HFpEF. Des études confirment de la même manière la sécurité et l’efficacité des entraînements adaptés pour ce groupe de patients [3].
Les résultats de ces études et méta-analyses démontrent une amélioration significative de la qualité de vie ainsi que des performances cardiopulmonaires et de la mobilité dans la vie quotidienne (par exemple lors du test de marche de 6 minutes) [3]. La participation à des programmes de réadaptation basés sur l’entraînement a également permis de réduire significativement le taux d’hospitalisation pour cause d’aggravation de l’insuffisance cardiaque. Cependant, aucune des méta-analyses récentes n’a démontré une réduction de la mortalité due à l’intervention d’entraînement [3]. C’est pourquoi les directives actuelles des sociétés savantes recommandent l’utilisation d’un entraînement physique personnalisé pour tous les patients souffrant d’insuffisance cardiaque cliniquement stable avec FCrF et FCpF, et ce pour tous les groupes d’âge [1,3].
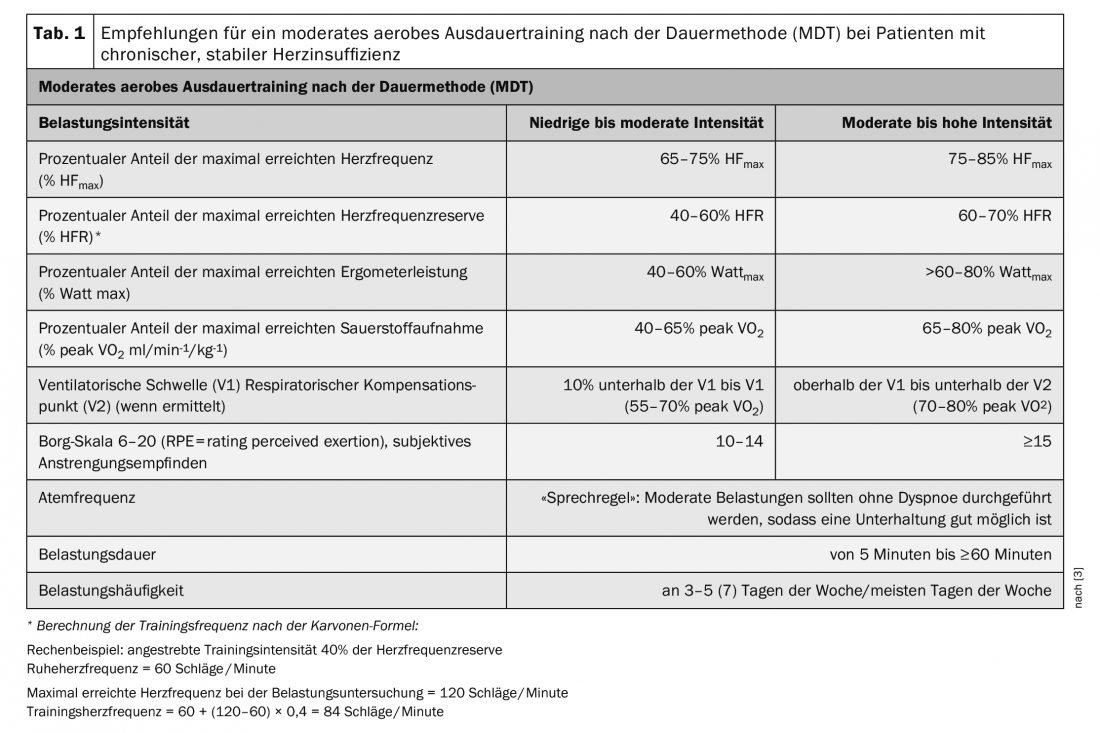
Les patients souffrant d’insuffisance cardiaque chronique stable doivent en principe être considérés comme des patients à risque accru. Les conditions préalables à la mise en place d’une intervention d’entraînement sont donc la stabilité clinique et un traitement médicamenteux, instrumental ou interventionnel optimal. L’ischémie myocardique et l’arythmie induites par l’effort ainsi que l’exsiccose ou l’hypervolémie doivent être exclues avant le début de l’entraînement [3]. Les recommandations d’entraînement doivent en principe être basées sur une stratification approfondie des risques, y compris des tests d’effort. L’épreuve d’effort doit être de préférence une spiro-ergométrie avec un effort sous-maximal, éventuellement en coopération avec un cabinet médical équipé à cet effet [3]. Les résultats permettent d’évaluer la tolérance individuelle à l’effort et de prescrire des formes et des intensités d’entraînement adaptées. Les recommandations d’entraînement définies dans les lignes directrices (tableaux 1-3) fournissent des “corridors” pour les limites inférieures et supérieures entre lesquelles un entraînement est sûr et efficace. Les recommandations individuelles de formation doivent se situer dans ces limites.
L’entraînement doit être commencé dans le cadre de programmes structurés, dirigés par un thérapeute spécialisé et supervisés par un médecin. Toutes les mesures d’entraînement doivent être poursuivies à long terme, par exemple dans le cadre de groupes ambulatoires pour l’insuffisance cardiaque. Les patients cliniquement stables et entraînés peuvent également suivre l’entraînement à domicile. Dans le cadre des programmes d’entraînement dirigés, le patient devrait être informé de l’importance d’une activité physique régulière sur l’évolution de la maladie et recevoir des conseils pour une organisation plus active de la vie quotidienne et des loisirs. L’accompagnement et le suivi initiaux de l’entraînement par des professionnels sont importants pour permettre aux patients d’évaluer correctement les symptômes qui peuvent apparaître pendant l’entraînement et de reconnaître leur pertinence pour la poursuite de l’entraînement. Les patients apprennent ainsi à évaluer de manière réaliste leur capacité et leurs limites de résistance, y compris dans la vie quotidienne [3].
Entraînement d’endurance aérobie modéré selon la méthode de la durée (MDT)
Les effets d’un entraînement aérobie modéré en endurance selon la méthode de la durée (MDT) sont les plus étudiés. Ce type d’entraînement influence la progression et les symptômes de l’HFrEF de plusieurs manières. Les effets positifs sur la fonction autonome du cœur sont bien établis, avec une réduction de l’activation sympathique, une amélioration de la fonction endothéliale, une réduction de la postcharge cardiaque, une amélioration de la FE du VG, une réduction de la taille du ventricule gauche et une amélioration de la capacité oxydative des muscles squelettiques [3]. Les résultats des méta-analyses confirment l’amélioration significative de la capacité cardiopulmonaire (+2,82 à +3,10 ml/min-1/kg-1) grâce à un entraînement d’endurance aérobie. Des intensités d’entraînement plus élevées sont associées à de plus grandes améliorations [3]. Les résultats d’une étude récemment publiée fournissent des preuves de l’efficacité de l’entraînement chez les patients HFrEF, indépendamment de leur capacité cardiopulmonaire au début de l’entraînement [3]. Autrement dit, même les patients les plus vulnérables en bénéficient ! Une augmentation significative de la VO2 de pointe grâce à l’entraînement était associée à une réduction de 81 % du risque d’hospitalisation et/ou de mortalité pour les patients dont la VO2 de pointe initiale était élevée, et à une réduction de 59 % du risque pour le critère d’évaluation primaire chez les patients dont la VO2 de pointe initiale était faible [3]. Ces résultats soutiennent la pertinence d’une augmentation de la VO2 de pointe par un entraînement adapté chez les patients HFrEF.
Chez les patients atteints d’HFpEF, les résultats d’une méta-analyse récemment publiée d’études sur l’efficacité d’un MDT montrent une augmentation significative des performances cardiopulmonaires (+1,67 ml/min-1/kg-1), de la mobilité (6MWD : +33,9 m) et de la qualité de vie. En revanche, la MDT n’a pas démontré d’effet positif sur la fonction diastolique ou la FE du VG [7].
Un entraînement d’endurance aérobie modéré selon la méthode de la durée (MDT) est donc recommandé comme entraînement de base pour tous les groupes de patients. Après l’épreuve d’effort sur bicyclette ergométrique, la puissance maximale atteinte (Wattmax) et la fréquence cardiaque (FCmax) peuvent être utilisées pour déterminer la charge d’entraînement individuelle. Un pourcentage de la FCmax ou de la réserve de fréquence cardiaque (RFC) est indiqué comme recommandation d’entraînement. Le contrôle de l’entraînement en pourcentage de la FCM est recommandé en cas d’incompétence chronotrope et, le cas échéant, en cas de traitement par bêtabloquants. L’indication en pourcentage de la Wattmax est utile pour les patients chez qui la FC ne peut pas être utilisée pour contrôler l’entraînement, par exemple en cas de fibrillation auriculaire. A titre de soutien ou d’alternative, la perception subjective de l’effort via l’échelle de Borg ainsi que la fréquence respiratoire peuvent être utilisées pour contrôler l’effort [3] (tableau 1).
Après un examen spiroergométrique, la recommandation d’entraînement peut être exprimée en pourcentage de la VO2 de pointe. La détermination des seuils ventilatoires (VT) et du point de compensation respiratoire (VT2) permet d’évaluer objectivement la capacité aérobie et de mieux cibler l’entraînement [3].
L’entraînement en endurance aérobie doit être initié sous forme de courtes périodes d’effort (5-10 minutes ≥2 fois/semaine) d’intensité faible à modérée (40-50% peak VO2, 40% HFR, échelle de Borg 10). Si la tolérance à l’effort est bonne, il est recommandé d’augmenter d’abord la fréquence de l’entraînement (≥5 fois/semaine, de préférence tous les jours) et d’allonger la durée de l’effort (20 à 30 minutes). Cette approche prudente est particulièrement importante pour les patients déconditionnés et peu résistants au début de l’entraînement. Les patients présentant une bonne tolérance à l’effort doivent être initiés progressivement à des efforts d’endurance plus intenses, en fonction des besoins individuels [3] (tableau 1).
Entraînement d’endurance selon la méthode par intervalles
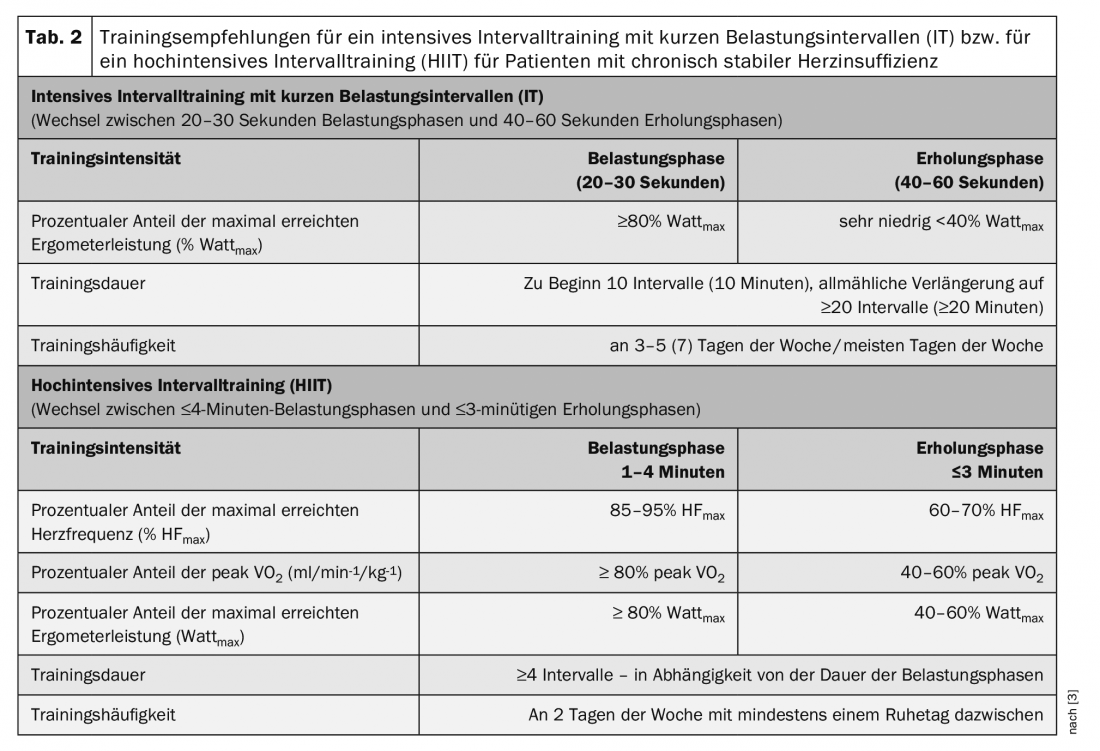
Un entraînement selon la méthode par intervalles se caractérise par une alternance constante de courtes périodes d’effort et de récupération. Cette forme d’entraînement permet de maintenir une intensité plus élevée, voire très élevée, de manière répétée pendant les phases d’effort. Aujourd’hui, l’efficacité et la sécurité à court terme d’un entraînement par intervalles chez les patients souffrant d’insuffisance cardiaque ont été bien étudiées. Le débat scientifique se concentre sur l’entraînement intensif à haute intensité par intervalles. Cela se définit comme des phases d’effort répétées, courtes (≤45 s) à longues (2-4 min), d’intensité élevée à très élevée, mais pas maximale (≥90% peak VO2), alternées avec des phases de récupération d’intensité modérée à faible.
Entraînement par intervalles avec de courtes périodes d’effort intense (IT)
Un entraînement par intervalles comprenant de courtes périodes d’effort intense (20-30 secondes) alternant avec des périodes de récupération deux fois plus longues (40-60 secondes) (IT) (tableau 2) permet d’obtenir des améliorations comparables de la capacité cardiorespiratoire et de la mobilité chez les patients HFrEF par rapport à un MDT [3].
Un tel entraînement par intervalles est généralement très bien toléré par les patients souffrant d’insuffisance cardiaque chronique stable et est considéré comme approprié et sûr pour tous les groupes de patients. Il est utilisé de manière routinière dans de nombreux programmes de réadaptation cardiaque. Il peut être réalisé en alternative ou en complément de la MDT. L’utilisation de l’IT est particulièrement recommandée chez les patients âgés et/ou particulièrement déconditionnés et peu résistants musculairement, ainsi que chez les patients souffrant de comorbidités telles que des troubles de la circulation périphérique des jambes et/ou des maladies pulmonaires obstructives chroniques [3]. Un IT doit être utilisé chaque fois que les patients ne tolèrent pas un effort continu de plusieurs minutes (dyspnée ou musculaire).
Entraînement par intervalles avec de longues périodes d’effort de haute intensité (HIIT)
Un protocole avec de longues périodes d’effort qui est souvent utilisé est le protocole dit 4×4. Après un court échauffement d’intensité modérée (60% FCmax), quatre intervalles d’effort de 4 minutes (85-95% FCmax) sont alternés avec des périodes de récupération de 3 minutes chacune (60-70% FCmax). Les résultats concernant l’efficacité et l’adéquation de cet entraînement par intervalles de haute intensité (HIIT) pour les patients HFrEF sont encore controversés. Les résultats des méta-analyses montrent certes une plus grande efficacité du HIIT pour améliorer la VO2 de pointe par rapport au MDT (+0,73 à +2,13 ml/min-1/kg-1). Cette supériorité du HIIT n’a toutefois pas été confirmée dans un grand ECR prospectif multicentrique [8]. Les résultats de cette étude montrent une efficacité comparable du HIIT et du MDT, avec une augmentation significative du peak VO2 (HIIT +1,4 vs. MDT +1,8 ml/min-1/kg-1), sans différence significative entre les deux groupes d’entraînement. Le HIIT n’a pas eu d’influence positive sur la FE du VG ou la taille du VG [8]. Pendant l’intervention de formation, les événements indésirables étaient répartis de manière égale dans les deux groupes. Cependant, au cours de la période de suivi de 52 semaines, on a observé une tendance non significative à un plus grand nombre d’incidents non mortels et mortels dans le groupe HIIT [8]. De plus, plusieurs auteurs rapportent que de nombreux patients ont des difficultés à atteindre l’intensité d’exercice très élevée visée pendant le HIIT ou à la maintenir pendant la phase d’exercice.
Les résultats de cette étude ont conduit à ce que l’entraînement par intervalles de haute intensité (HIIT) ne soit actuellement pas recommandé sans restriction pour les patients HFrEF. Ce type d’entraînement devrait plutôt être envisagé au cours de la thérapie d’entraînement à long terme chez les patients stables ayant une bonne tolérance à l’effort, éventuellement en complément du MDT, ou le HIIT devrait être réalisé alternativement avec des phases d’effort plus courtes et éventuellement moins intenses [3] (tableau 2).
Pour les patients atteints de HFpEF, une méta-analyse récemment publiée a démontré la sécurité, la bonne tolérance et l’efficacité du HIIT pour augmenter la VO2 de pointe. On ne sait pas encore si cette méthode d’entraînement contribue plus efficacement à l’amélioration de la VO2 de pointe par rapport à la MDT. En comparant les protocoles d’entraînement isocaloriques dans une étude, l’efficacité des deux méthodes est comparable [9].
En résumé, la méthode d’entraînement par intervalles offre de nombreuses possibilités de conception. Il peut être adapté aux besoins individuels par la durée et l’intensité des intervalles d’effort et de récupération, ainsi que par le rapport entre effort et récupération [3]. Pour tous les protocoles d’entraînement en endurance, l’entraînement sur bicyclette ergométrique (de préférence avec surveillance ECG) présente l’avantage d’être soulagé du poids du corps, de permettre un dosage précis et de reproduire l’effort. En alternative ou en complément de l’entraînement sur bicyclette ergométrique, l’entraînement de l’endurance aérobie peut être effectué sous forme de marche et/ou de walking (marche rapide avec une utilisation accrue des bras) ou de marche avec utilisation de bâtons (nordic walking) sur un parcours plat fixe, cross-trainer ou sur un tapis roulant [3].
Musculation dynamique
Les bénéfices et la sécurité d’un entraînement de musculation dynamique modéré chez les patients souffrant d’insuffisance cardiaque ont été bien étudiés. La musculation n’a pas d’effet négatif sur la fonction cardiaque systolique. La réponse hémodynamique centrale à des charges de force dynamiques modérées est comparable à celle observée lors d’un entraînement d’endurance aérobie [3].
En tant que forme d’entraînement à part entière, la musculation permet d’améliorer la force musculaire des patients HFrEF et de lutter contre la perte de masse musculaire due à la maladie. Il a également un impact positif sur la mobilité, la capacité cardiopulmonaire et la qualité de vie [3]. De plus, la musculation dynamique permet de prévenir les chutes.
Chez les patients atteints d’HFrEF, la combinaison de l’entraînement en force et en endurance entraîne une plus grande augmentation de la capacité cardiopulmonaire (+2,48 ml/min-1/kg-1) et de la mobilité (+50,05 m) par rapport à l’entraînement en endurance seul [3].
Chez les patients atteints de FEHP, trois mois d’entraînement combiné en endurance aérobie (MDT : 50-70% peak VO2) combiné à un entraînement de force dynamique modéré (50-60% “1-repeat maximum” [1RM]) ont entraîné une augmentation significative du peak VO2 (+3,3 ml/min-1/kg-1) et une amélioration de la fonction diastolique déterminée par échocardiographie par rapport à un groupe témoin non actif [10].
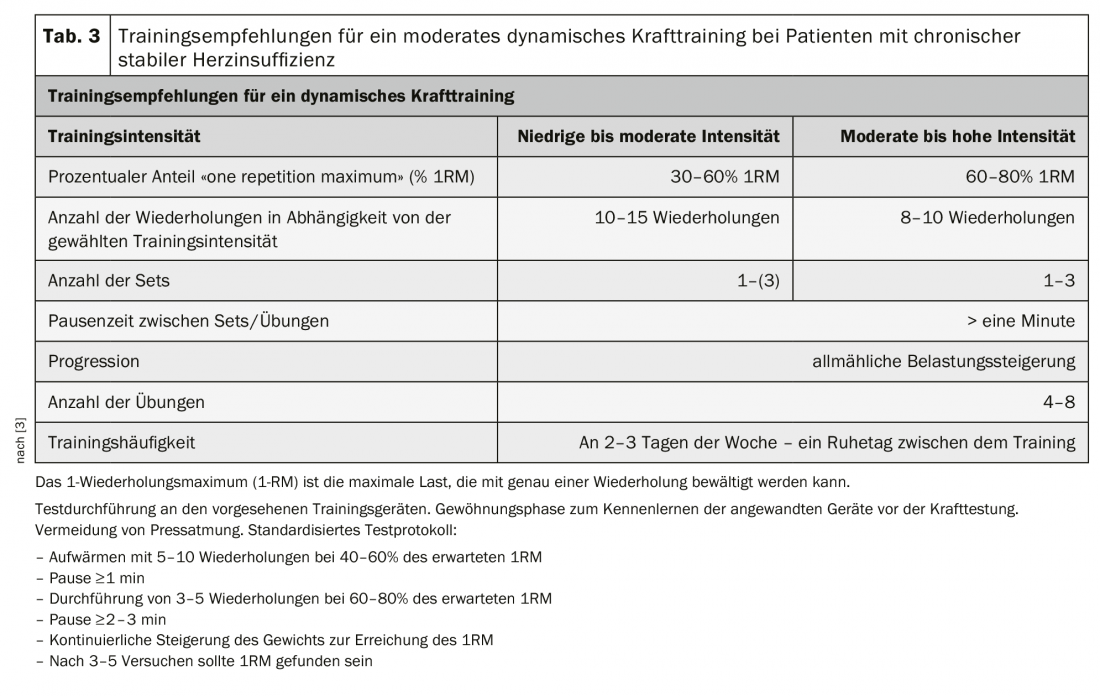
Un entraînement de musculation dynamique d’intensité faible à modérée, avec une faible part d’isométrie, est donc recommandé en complément de l’entraînement d’endurance aérobie, tant chez les patients HFrEF que chez les patients HFpEF [3]. Une initiation en douceur à la musculation, avec une intensité très faible, un nombre de répétitions réduit et un rythme de mouvement lent, permet d’apprendre et de s’exercer à une exécution correcte des exercices et à la respiration. Il faut absolument éviter de respirer en poussant et en fermant les lèvres. Les patients doivent inspirer et expirer lentement au rythme du mouvement, la bouche ouverte. L’entraînement de la force doit être entrepris avec des charges faibles à modérées <30-50 1RM. Si la tolérance à l’effort est bonne, l’intensité peut être augmentée progressivement de manière individuelle au cours du programme d’entraînement [3] (tableau 3).
Littérature :
- Ponikowski P, Voors AA, Anker SD, et al. : 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure : The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Développé avec la contribution spéciale de l’Association pour l’insuffisance cardiaque (HFA) de l’ESC. Eur J Heart Fail 2016 ; 18 : 891-975.
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Lignes directrices nationales de soins pour l’insuffisance cardiaque chronique – version longue, 3ème édition. Version 2. 2019 [cited : 17-06-2020] ; doi : 10.6101/AZQ/000467. www.herzinsuffizienz.versorgungsleitlinien.de.
- S3 – Ligne directrice sur la réadaptation cardiologique (LL-KardReha) dans les pays germanophones d’Europe, Allemagne, Autriche, Suisse (D-A-CH), version longue – partie 1, 2019 ; numéro de registre AWMF : 133/001, www.awmf.org.
- Tschöpe C, Birner C, Böhm M, et al : Heart failure with preserved ejection fraction : current management and future strategies : Expert opinion on the behalf of the Nucleus of the “Heart Failure Working Group” of the German Society of Cardiology (DKG). Clin Res Cardiol 2018 ; 107 : 1-19.
- Orimoloye OA, Kambhampati S, Hicks AJ, et al : Une meilleure forme cardiorespiratoire prédit la survie à long terme chez les patients souffrant de défaillance cardiaque et de fraction d’éjection préservée : le projet Henry Ford Exercise Testing (FIT). Arch Med Sci 2019 ; 15 : 350-358.
- Tucker WJ, Haykowsky MJ, Seo Y, et al : Impaired Exercise Tolerance in Heart Failure : Role of Skeletal Muscle Morphology and Function. Curr Heart Fail Rep 2018 ; 15 : 323-331.
- Fukuta H, Goto T, Wakami K, et al : Effects of exercise training on cardiac function, exercise capacity, and quality of life in heart failure with preserved ejection fraction : a meta-analysis of randomized controlled trials. Heart Fail Rev 2019 ; 24 : 535-547.
- Ellingsen Ø, Halle M, Conraads V, et al : High intensity interval training in heart failure patients with reduced ejection fraction. Circulation 2017 ; 135 : 839-849.
- Gomes Neto M, Durães AR, Conceição LSR, et al. : High intensity interval training versus moderate intensity continuous training on exercise capacity and quality of life in patients with heart failure with reduced ejection fraction : A systematic review and meta-analysis. Int J Cardiol 2018 ; 261 : 134-141.
- Edelmann F, Gelbrich G, Düngen HD, et al : Exercise training improves exercise capacity and diastolic function in patients with heart failure with preserved ejection fraction : results of the Ex-DHF (Exercise training in Diastolic Heart Failure) pilot study. J Am Coll Cardiol 2011 ; 58 : 1780-1791.
CARDIOVASC 2021 ; 20(2) : 11-16