L’étude SEQUENCE a comparé le risankizumab à l’ustékinumab dans le traitement de la maladie de Crohn (MC) chez les patients en échec aux traitements anti-TNF. Des biomarqueurs tels que la calprotectine fécale (FC) et la protéine C-réactive (CRP) ont également été mesurés [1]. Outre les critères d’évaluation cliniques et endoscopiques, ces biomarqueurs ont permis d’évaluer objectivement l’évolution de la maladie [1].
La MC est très invalidante pour les personnes concernées : l’inflammation sous-jacente du tractus gastro-intestinal peut provoquer des lésions intestinales durables et réduire considérablement la qualité de vie [2, 3]. En Suisse, deux inhibiteurs de l’interleukine (IL)-23 et de l’IL-12/-23, le risankizumab (SKYRIZI®) et l’ustékinumab, sont notamment autorisés pour le traitement de la MC [4, 5]. Les deux options thérapeutiques ont été comparées dans l’étude comparative SEQUENCE publiée dans le New England Journal of Medicine (NEJM) [1]. Il s’agit de la première étude tête-bêche dans la MC qui montre la supériorité d’un médicament biologique par rapport à un autre(lire le résumé de l’étude ici) [1]. Une analyse plus approfondie
montre maintenant la meilleure réponse sous risankizumab dans plusieurs sous-groupes et en ce qui concerne les biomarqueurs [1,6].
Risankizumab également bénéfique dans l’analyse de sous-groupes
Plus de 500 patients en échec à un ou plusieurs inhibiteurs du TNF ont été randomisés et traités pendant 48 semaines soit par risankizumab (N=255) soit par ustékinumab (N=265) en ouvert [1]. En comparaison directe avec l’ustékinumab, le risankizumab s’est révélé supérieur et tous les critères d’évaluation primaires et secondaires ont été atteints [1]. Ceux-ci comprenaient des critères cliniques et endoscopiques tels que la rémission clinique (CDAI* < 150) ou la rémission endoscopique à la semaine 48 (SES-CD* ≤ 4 et au moins 2 points de moins que la valeur initiale). De plus, les résultats dans les sous-groupes prédéfinis étaient généralement cohérents avec les résultats de l’analyse primaire. Le risankizumab s’est avéré plus efficace que l’ustékinumab pour obtenir une rémission endoscopique à 48 semaines chez des patients présentant des durées, des degrés de sévérité et des localisations de la maladie différents [1].
Réduction significativement plus importante des biomarqueurs avec le risankizumab [6]
L’une des limites possibles de l’étude SEQUENCE était sa conception ouverte, qui pourrait avoir influencé les rapports sur les symptômes. Cependant, outre les critères endoscopiques évalués de manière centralisée sans connaître la répartition des patients dans les groupes, l’analyse de biomarqueurs objectifs tels que la FC et la CRP souligne l’efficacité supérieure du risankizumab par rapport à l’ustékinumab [1]. La FC et la CRP sont les deux biomarqueurs les plus utilisés dans la MC et servent de marqueurs objectifs de l’inflammation intestinale [7]. La normalisation de la FC et de la CRP est donc également recommandée comme objectif thérapeutique à moyen terme dans les lignes directrices STRIDE II [7]. Dans l’étude SEQUENCE, la FC et la CRP ont été mesurées chez les patients avant le début du traitement et aux semaines 8, 24 et 48. Après 24 et 48 semaines, le niveau de FC a diminué en moyenne de manière significativement plus importante dans le groupe risankizumab que dans le groupe ustékinumab (figure 1) [6]. L’évaluation des taux de CRP a donné des résultats similaires. Après 8 semaines, la réduction par rapport à la ligne de base était déjà significativement plus importante avec le risankizumab qu’avec l’ustékinumab (Fig. 1) [6]. Dans l’ensemble, la réduction de la FC et de la CRP a été corrélée aux taux de rémission clinique et endoscopique à 48 semaines, pour lesquels le risankizumab a montré une supériorité par rapport à l’ustékinumab [1].
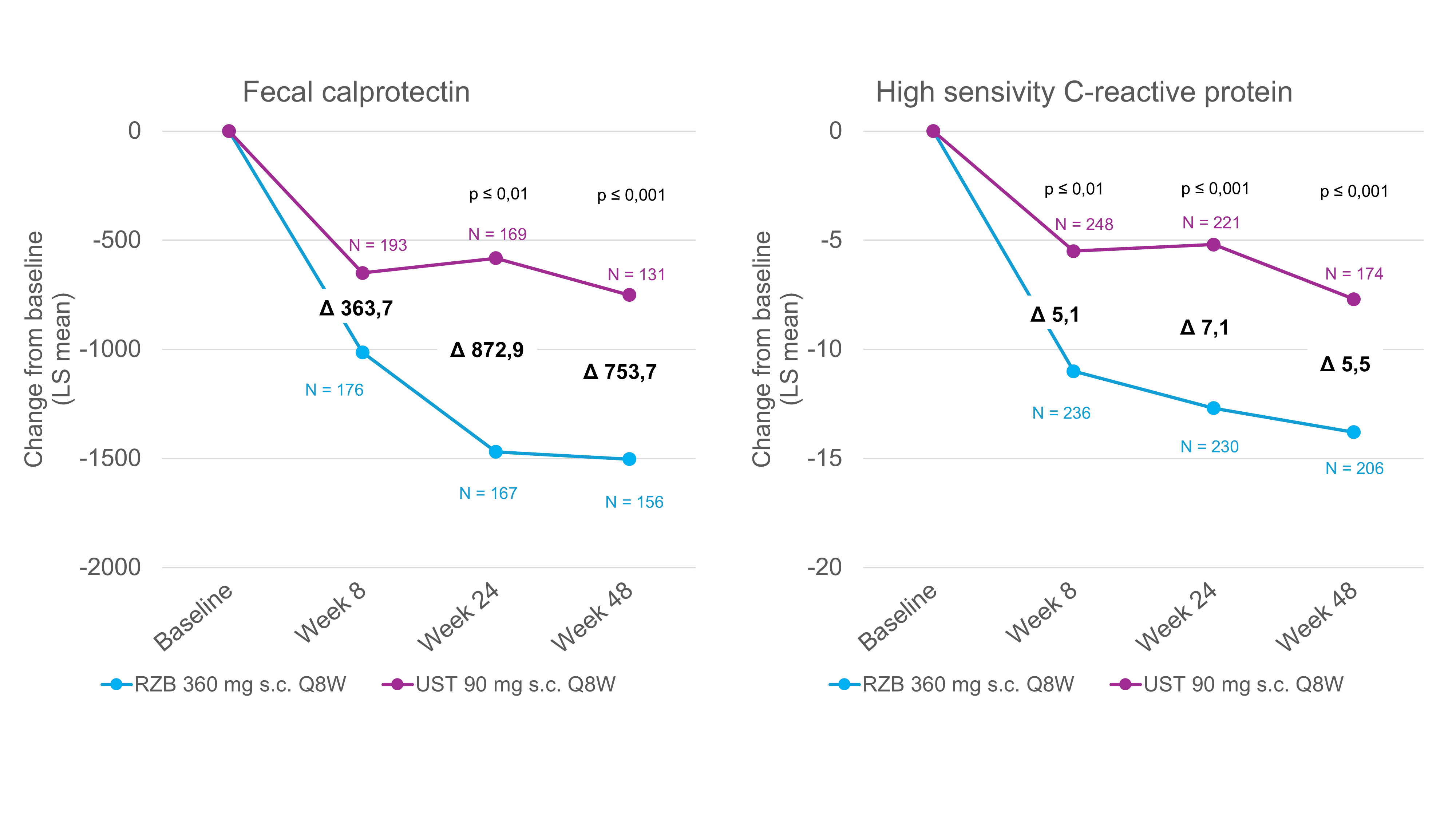
Fig. 1. Le risankizumab entraîne une réduction significativement plus importante des biomarqueurs par rapport à l’ustékinumab. LS = derniers carrés ; Q8W = toutes les 8 semaines ; RZB = risankizumab ; s.c. = sous-cutané ; UST = ustekinumab. Analyse post-hoc, toutes les valeurs P sont nominales et non contrôlées par multiplicité. Adapté de [6]
Conclusion
L’étude SEQUENCE montre que le risankizumab est non seulement cliniquement et endoscopiquement supérieur à l’ustékinumab dans le traitement de la MC, mais qu’il permet également une réduction plus rapide et plus importante des biomarqueurs objectifs FC et CRP [1]. L’amélioration des valeurs des biomarqueurs souligne le potentiel du risankizumab à permettre un contrôle durable de l’activité de la maladie et à offrir aux patients une meilleure qualité de vie à long terme.
* Abréviations : CDAI = Indice d’activité de la maladie de Crohn; SES-CD = Simple Endoscopic Score for Crohn’s Disease.
Information technique succincte SKYRIZI®.
Rapport : Dr. sc. Stefanie Jovanovic

Cet article a bénéficié du soutien financier d’AbbVie SA, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240070 10/2024
Cet article a été validé en allemand.
Références
1. Peyrin-Biroulet, L., et al, Risankizumab versus Ustekinumab for Moderate-to-Severe Crohn’s Disease. N Engl J Med, 2024. 391(3) : p. 213-223.
2. Jairath, V. et B.G. Feagan, Poids global de la maladie inflammatoire de l’intestin. Lancet Gastroenterol Hepatol, 2020. 5(1) : p. 2-3.
3. la charge mondiale, régionale et nationale de la maladie intestinale inflammatoire dans 195 pays et territoires, 1990-2017 : une analyse systématique pour l’étude Global Burden of Disease 2017. Lancet Gastroenterol Hepatol, 2020. 5(1) : p. 17-30.
4. information professionnelle actuelle de SKYRIZI® (risankizumab) Maladie de Crohn sur www.swissmedicinfo.ch.
5. information professionnelle actuelle de l’ustékinumab sur www.swissmedicinfo.ch.
6. Dubinsky, M., et al. Risankizumab Versus Ustekinumab pour l’obtention d’une rémission clinique et d’une réduction des biomarqueurs inflammatoires chez les patients atteints de la maladie de Crohn modérée à sévère : Résultats de l’essai SEQUENCE de phase 3B. Oral presentation 763 at DDW 2024 ; Washington D.C., USA, May 19-21, 2024.
7. Turner, D., et al., STRIDE-II : An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD) : Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology, 2021. 160(5) : p. 1570-1583.
Les références peuvent être demandées par les professionnels à medinfo.ch@abbvie.com.











