On a maintenant identifié plusieurs facteurs de risque qui prédisposent au développement d’une atteinte articulaire en présence d’un psoriasis. Les dermatologues jouent un rôle clé dans la détection précoce. Une thérapie systémique adéquate dans une “fenêtre d’opportunité” peut avoir un impact positif sur les résultats à long terme. Bien que les options thérapeutiques se soient améliorées, la réponse au traitement n’est pas satisfaisante pour tous les patients atteints de PsA. C’est pourquoi la recherche se poursuit fébrilement et de nouvelles stratégies de traitement sont testées.
Le succès du traitement de l’arthrite psoriasique (PsA) repose sur une activité minimale de la maladie (minimal disease activity, MDA). Les progrès réalisés dans le décryptage de la pathogenèse de la PsA ont favorisé le développement de traitements systémiques modernes, de sorte qu’il existe aujourd’hui des médicaments biologiques et des “petites molécules” qui s’attaquent à différentes cibles : TNF, interleukine (IL)-12/23, IL-17, IL-23, JAK-STAT, PDE-4. Les résultats thérapeutiques ont été portés à un niveau supérieur (tableau 1) [1]. Alors que 17% des patients atteints de PsA ont obtenu un MDA avec les médicaments antirhumatismaux de synthèse conventionnels (csDMARD**), selon une revue systématique publiée en 2020, le traitement par des médicaments biologiques (bDMARD) a permis d’obtenir un MDA dans 57% des cas [2]. Bien qu’il s’agisse d’un saut quantique, cela reflète également une proportion importante de non-répondants.
** csDMARDs : en particulier le méthotrexate, mais aussi la sulfasalazine ou le léflunomide ; à distinguer des médicaments synthétiques ciblés (tsDMARDS) comme l’aprémilast et des médicaments biologiques (bDMARDs).
Recommandations du GRAPPA et de l’EULAR
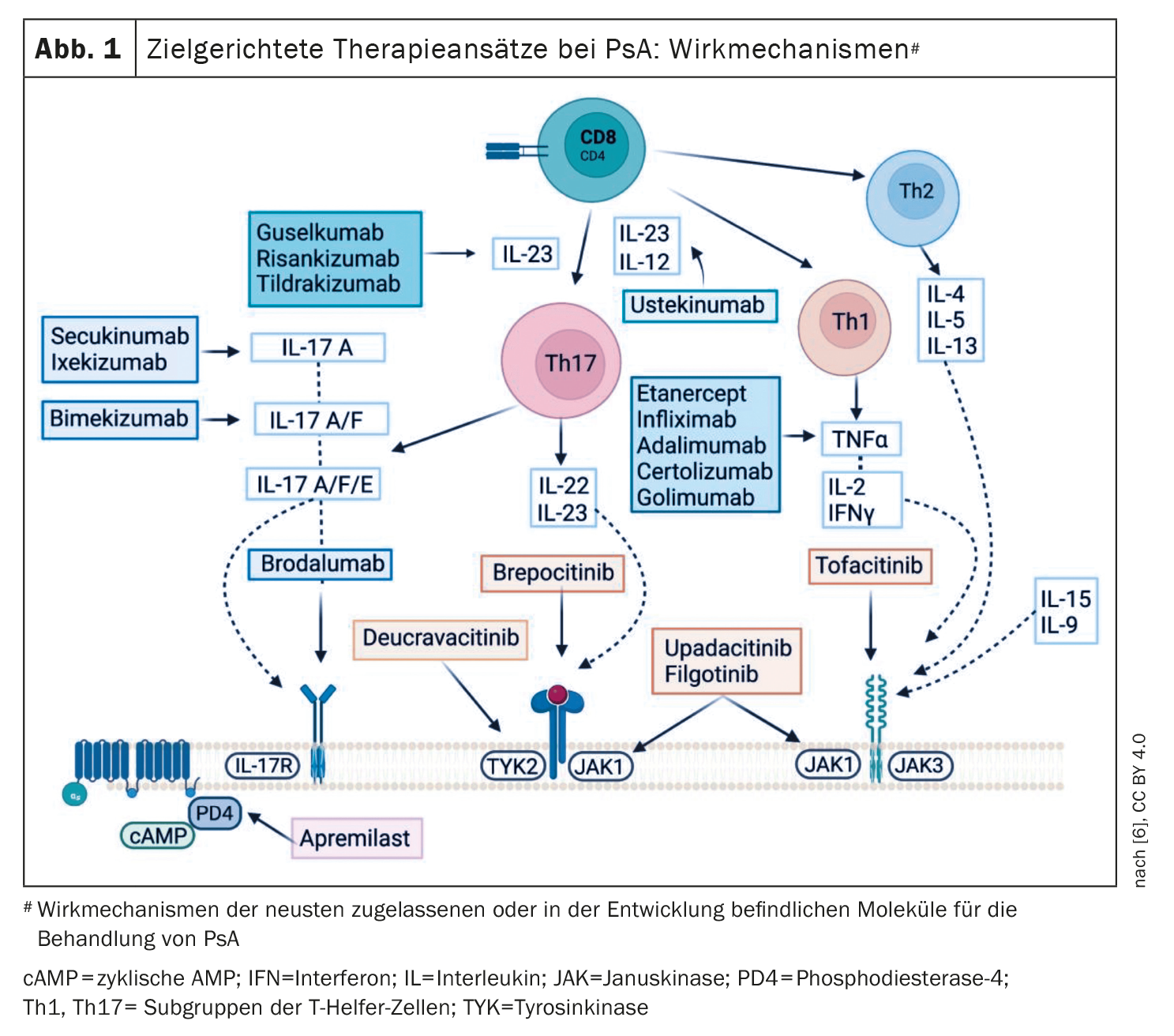
Compte tenu de l’hétérogénéité de la PsA, une stratégie de traitement personnalisée prend de plus en plus d’importance. Les recommandations actuelles du Groupe de recherche et d’évaluation du psoriasis et de l’arthrite psoriasique (GRAPPA) et de la Ligue européenne contre le rhumatisme (EULAR) proposent d’aborder tous les domaines actifs de la maladie ainsi que les comorbidités liées au PsA chez un patient donné [3,4]. Les lignes directrices S3 actuelles sur le psoriasis recommandent que les dermatologues établissent le diagnostic et choisissent le traitement de la PsA de manière interdisciplinaire, en coopération avec un rhumatologue [5]. Selon l’algorithme de traitement de l’EULAR et du GRAPPA, les csDMARD sont considérés comme traitement de première ligne, suivis par l’inhibiteur de la PDE-4, l’aprémilast, les médicaments biologiques (bDMARDs) ou l’utilisation de DMARDs synthétiques ciblés comme les inhibiteurs de la Janus kinase (JAK) [3,4]. Les DMARD actuellement autorisés en Suisse dans le domaine d’indication de l’arthrite psosriatique sont présentés dans la figure 1.
L’aprémilast et le TNF-α-i sont des options thérapeutiques qui ont fait leurs preuves
L’aprémilast est une “petite molécule” à prendre par voie orale qui inhibe la phosphodiestérase 4 (PDE-4). L’inhibition de la PDE-4 favorise une augmentation de l’AMP cyclique intracellulaire, ce qui empêche la synthèse de cytokines pro-inflammatoires et augmente les cytokines anti-inflammatoires (IL-10) [6]. Les lignes directrices recommandent l’aprémilast en particulier dans le psoriasis avec atteinte unguéale, la PsA périphérique, l’enthésite et la dactylite. Les études ESTEEM ont démontré leur efficacité dans le psoriasis en plaques et l’atteinte des ongles, et les études PALACE ont fourni des preuves d’efficacité dans le PsA [7,8]. De plus, dans plusieurs études randomisées contrôlées (RTC), les réponses ACR20 à la semaine 16 étaient significativement plus fréquentes avec les deux doses d’aprémilast (20 mg ou 30 mg, 2x/d) qu’avec le placebo [9–12].
Les inhibiteurs du TNF-α sont une option thérapeutique biologique éprouvée dans la PsA, pour laquelle il existe des preuves d’efficacité dans tous les domaines de la PsA [6]. Selon une méta-analyse, l’adalimumab, l’étanercept et l’infliximab sont équivalents en termes de réponse ACR20 [13].
“Hit hard and early” avec des médicaments biologiques très efficaces ?
Une approche pour optimiser les résultats du traitement consiste à intervenir le plus tôt possible avec des produits biologiques très efficaces, de sorte que le développement de la PsA puisse être retardé ou même empêché [14]. Les patients atteints de psoriasis présentant un risque élevé de développer un PsA (arthralgies, psoriasis des ongles ou de la tête ou PASI>6) ont reçu un traitement par sécukinumab, un inhibiteur de l’IL-17A, dans l’étude IVEPSA. Après une période de traitement de 24 semaines, les lésions cutanées, les arthralgies et les scores de synovite (évalués par scanner et IRM) se sont tous améliorés [15]. Et dans une autre étude, l’ustekinumab, un inhibiteur de l’IL12-/23, a entraîné une réduction de l’enthésopathie subclinique périphérique après 12 semaines chez 23 patients atteints de psoriasis en plaques modéré à sévère, et cet effet s’est maintenu jusqu’à la semaine 52 [16]. Il existe également des résultats d’études sur le guselkumab, un inhibiteur de l’IL-23, qui vont dans le même sens [17].
Études en tête-à-tête sur les inhibiteurs de l’IL-17A
Au cours des dernières décennies, il est apparu que les cellules Th17, l’IL-23 et l’IL-17 jouent un rôle immunopathologique central [1]. En conséquence, dans le cas de la PsA, les antagonistes du TNF-α ne sont plus considérés comme le premier choix parmi les produits biologiques, mais l’ustékinumab et les inhibiteurs de l’IL-17A gagnent du terrain. Chez les patients atteints de PsA qui n’avaient pas suffisamment répondu aux csDMARDs, l’ixekizumab IL-17A-i s’est avéré supérieur à l’adalimumab dans une étude en tête-à-tête, à la fois en termes d’amélioration de l’enthésite et de lésions cutanées [18]. Et dans une étude en tête-à-tête de McInnes et al. le sécukinumab a été au moins aussi efficace que l’inhibiteur du TNF-α sur les critères d’évaluation musculo-squelettiques, mais a obtenu de meilleurs résultats en termes d’amélioration des lésions cutanées [19]. Il s’agit, selon Sundanum et al. 2023, deux études importantes qui montrent que les IL-17A-i dans la PsA bénéficient d’un niveau de preuve croissant en termes d’efficacité et de sécurité [1]. Le bimekizumab, un inhibiteur de l’IL-17A/F, n’est actuellement autorisé en Suisse que pour le psoriasis en plaques, mais il s’est révélé supérieur au placebo en termes de réponse ACR50 dans l’étude BE COMPLETE chez des patients ayant reçu auparavant un traitement par TNF-α-i [20].
IL-23-i – deux représentants autorisés dans la PsA
Actuellement, Risankizumab et Guselkumab ont reçu une autorisation de mise sur le marché en Suisse dans le domaine de la PsA. Dans les études KEEPsAKE, les patients traités par risankizumab ont été significativement plus nombreux à obtenir une réponse ACR-20 à la semaine 24 que ceux sous placebo [21,22]. L’extension des indications du guselkumab est basée sur les études DISCOVER. Les patients naïfs de traitement et ceux précédemment traités par TNF-α-i ont tous deux montré une réponse ACR20 significativement plus élevée avec le guselkumab à la semaine 24 par rapport au placebo [23–25]. Le tildrakizumab, un autre IL-23-i autorisé dans le psoriasis en plaques, a obtenu des résultats positifs dans une étude de phase II dans la PsA, tandis que le programme d’études de phase III INSPIRE n’est pas encore terminé [26–28].
Et la voie de signalisation JAK/STAT ?
La famille JAK se compose de quatre représentants : Janus kinase(JAK)-1, JAK-2, JAK-3 et tyrosine kinase(TYK)-2. Des effets immunomodulateurs et pro-inflammatoires sont transmis par la voie de signalisation JAK/STAT. Le tofacitinib inhibe spécifiquement JAK1 et JAK3. Une étude de phase III a démontré l’efficacité du tofacitinib par rapport au placebo à la fois chez les patients atteints de PsA naïfs de traitement et chez les patients en échec de traitement par le TNF-α-i [30,31]. L’upadacitinib inhibe JAK1 et s’est révélé supérieur au placebo en termes de réponse ACR20 dans l’étude de phase III SELECT-PsA 1. En outre, l’upadacitinib 15 mg ne s’est pas révélé inférieur à l’adalimumab, tandis que le JAK-i était même supérieur à la dose de 30 mg, mais davantage d’événements indésirables graves sont survenus avec l’upadacitinib [32]. Et dans SELECT-PsA, les patients atteints de PsA chez qui le TNF-α-i n’était pas efficace ou qui ne le toléraient pas ont obtenu une réponse ACR20 et un taux de MDA significativement plus élevés sous upadacitinib (15 mg ou 30 mg par jour) [33]. Dans une étude de phase II, le deucravacitinib, un inhibiteur de TYK2, s’est également révélé supérieur au placebo dans le traitement de l’arthrite, de l’enthésite et de la dactylite, à l’une des deux doses (6 mg et 12 mg/jour) [34].
En ce qui concerne la sécurité des représentants de la famille des JAK, l’étude de surveillance ORAL a montré que les patients atteints de polyarthrite rhumatoïde traités par tofacitinib présentaient un risque plus élevé d’événements cardiovasculaires que ceux traités par TNF-α-i [35]. En conséquence, l’Agence européenne des médicaments (EMA) et la Food and Drug Administration (FDA) des États-Unis ont émis un avertissement concernant l’utilisation de JAK-i chez les patients de plus de 65 ans, les fumeurs et en présence de facteurs de risque cardiovasculaire, d’événements thromboemboliques ou d’antécédents de maladies malignes [6].
Littérature :
- Sundanum S, Orr C, Veale D : Thérapies ciblées dans l’arthrite psoriasique – Mise à jour. Int J Mol Sci 2023 Mar 28 ; 24(7):6384
- Zardin-Moraes M, et al : Prevalence of Psoriatic Arthritis Patients Achieving Minimal Disease Activity in Real-world Studies and Randomized Clinical Trials : Systematic Review with Metaanalysis. J Rheumatol 2020 ; 47 : 839.
- Gossec L, et al : Recommandations EULAR pour la prise en charge de l’arthrite psoriasique avec des traitements pharmacologiques : mise à jour 2019. Ann Rheum Dis 2020 ; 79 : S700-S712.
- Coates LC, et al : Groupe de recherche et d’évaluation du psoriasis et de l’arthrite psoriasique (GRAPPA) : Mise à jour des recommandations de traitement de l’arthrite psoriasique 2021. Nat Rev Rheumatol 2022 ; 18 : 465-479.
- Nast A et al. Ligne directrice S3 allemande sur le traitement du psoriasis vulgaire, adaptée par EuroGuiDerm, register.awmf.org/assets/guidelines/013-001l_S3_Therapie-Psoriasis-vulgaris_2021-07-verlaengert.pdf, (dernière consultation 23.01.2024)
- Azuaga AB, Ramírez J, Cañete JD : Psoriatic Arthritis : Pathogenesis and Targeted Therapies. Int J Mol Sci 2023 ; 24(5) : 4901. doi : 10.3390/ijms24054901. www.mdpi.com/1422-0067/24/5/4901#,(dernière consultation 23.01.2024)
- Papp K, et al : Apremilast, an Oral Phosphodiesterase 4 (PDE4) Inhibitor, in Patients with Moderate to Severe Plaque Psoriasis : Results of a Phase III, Randomized, Controlled Trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). JAAD 2015 ; 73 : 37-49.
- Paul C, et al. Efficacité et sécurité de l’aprémilast, un inhibiteur de la phosphodiestérase 4 par voie orale, chez les patients atteints de psoriasis en plaques modéré à sévère pendant 52 semaines : un essai contrôlé randomisé de phase III (ESTEEM 2). Br J Dermatol 2015 ; 173 : 1387-1399.
- Kavanaugh A, et al : Extended Report : Treatment of Psoriatic Arthritis in a Phase 3 Randomised, Placebo-Controlled Trial with Apremilast, an Oral Phosphodiesterase 4 Inhibitor. Ann Rheum Dis 2014 ; 73 : 1020.
- Cutolo M, et al : A Phase III, Randomized, Controlled Trial of Apremilast in Patients with Psoriatic Arthritis : Results of the PALACE 2 Trial. J Rheumatol 2016 ; 43 : 1724-1734.
- Edwards CJ, et al : Extended Report : Apremilast, an Oral Phosphodiesterase Inhibitor 4, in Patients with Psoriatic Arthritis and Current Skin Involvement : A Phase III, Randomised, Controlled Trial (PALACE 3). Ann Rheum Dis 2016 ; 75 : 1065.
- Wells AF, et al : Apremilast Monotherapy in DMARD-Naive Psoriatic Arthritis : Results of the Randomized, Placebo-Controlled PALACE 4 Trial. Rheumatology 2018 ; 57 : 1253.
- Fénix-Caballero S, et al : Comparaison directe et indirecte de l’efficacité et de la sécurité de l’adalimumab, l’étanercept, l’infliximab et le golimumab dans la polyarthrite psoriasique. J Clin Pharm Ther 2013 ; 38 : 286-293.
- Kimak A, et al : Psoriatic Arthritis : Development, Detection and Prevention : A Scoping Review. J Clin Med 2023 ; 12(11) : 3850
- 15. Kampylafka E, et al. Interception de la maladie par l’inhibition de l’interleukine-17 chez les patients atteints de psoriasis à haut risque et présentant une inflammation articulaire sous-clinique – données de l’étude prospective IVEPSA. Arthritis Res 2019 ; 21 : 178.
- Savage L, et al : Régression de l’enthésopathie subclinique périphérique chez des patients naïfs traités par ustékinumab pour un psoriasis en plaques chronique modéré à sévère : une étude de faisabilité prospective de cinq semaines et deux semaines, en label ouvert. Arthritis Rheumatol 2019 ; 71 : 626-631.
- Haberman RH, et al : Efficacité du guselkumab, un inhibiteur sélectif de l’IL-23, dans la prévention de l’arthrite dans une cohorte multicentrique Psoriasis At-Risk (PAMPA) : Protocole d’un essai multicentrique randomisé, en double aveugle, contrôlé par placebo. BMJ Open 2022 ; 12:e063650.
- Mease PJ, et al : A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological-naïve patients with active psoriatic arthritis : 24-week results of a randomised, open-label, blind-assessor trial. Ann Rheum Dis 2020;79 : 123-131.
- McInnes IB, et al : Secukinumab versus adalimumab pour le traitement de l’arthrite psoriasique active (EXCEED) : un essai de phase 3b, en double aveugle, en groupes parallèles, randomisé et contrôlé. Lancet 2020 ; 395 : 1496-1505.
- Merola JF, et al : Bimekizumab chez les patients atteints d’arthrite psoriasique active et ayant déjà présenté une réponse inadéquate ou une intolérance aux inhibiteurs du facteur de nécrose tumorale-α : un essai randomisé, en double aveugle, contrôlé par placebo, de phase 3 (BE COMPLETE). Lancet 2023 ; 401 : 38-48.
- Kristensen LE, et al : Efficacité et sécurité du risankizumab pour la polyarthrite psoriasique active : Résultats à 24 semaines de l’essai KEEPsAKE 1, randomisé, en double aveugle, phase 3. Ann Rheum Dis 2022 ; 81 : 225-231.
- Östör A, et al : Efficacité et sécurité du risankizumab pour la polyarthrite psoriasique active : Résultats à 24 semaines de l’essai KEEPsAKE 2, randomisé, en double aveugle, phase 3. Ann Rheum Dis 2022 ; 81 : 351-358.
- Deodhar A, et al. : Guselkumab chez les patients atteints de polyarthrite psoriasique active qui étaient naïfs en matière de biologie ou qui avaient déjà reçu un traitement par inhibiteur du TNFα (DISCOVER-1) : A Double-Blind, Randomised, Placebo-Controlled Phase 3 Trial. Lancet 2020 : 395 : 1115-1125.
- Mease PJ, et al. : Guselkumab chez des patients naïfs de traitement biologique atteints d’arthrite psoriasique active (DISCOVER-2) : A Double-Blind, Randomised, Placebo-Controlled Phase 3 Trial. Lancet 2020 ; 395 : 1126-1136.
- Coates LC, et al : Efficacité et sécurité du guselkumab chez les patients atteints de polyarthrite psoriasique active qui sont des répondeurs inadéquats aux inhibiteurs du facteur de nécrose tumorale : Résultats sur une année d’une étude de phase IIIb, randomisée, contrôlée (COSMOS). Ann Rheum Dis 2022 ; 81 : 359-369.
- ClinicalTrials.Gov. Identifiant : NCT04314544, https://clinicaltrials.gov,(dernière consultation 23.01.2024)
- ClinicalTrials.Gov. Identifiant : NCT04314531, https://clinicaltrials.gov,(dernière consultation 23.01.2024)
- Mease PJ, et al : Efficacité et sécurité du tildrakizumab chez les patients atteints d’arthrite psoriasique active : Résultats d’une étude randomisée, en double aveugle, contrôlée par placebo, à doses multiples, de 52 semaines de phase IIb Ann Rheum Dis 2021 ; 80 : 1147-1157.
- Swissmedic : Information sur les médicaments, https://swissmedicinfo.ch,(dernière consultation 23.01.2024)
- 30. Gladman D, et al : Tofacitinib pour l’arthrite psoriasique chez les patients ayant une réponse inadéquate aux inhibiteurs du TNF. NEJM 2017 ; 377 : 1525-1536.
- Mease P, et al. Tofacitinib ou adalimumab versus placebo pour la polyarthrite psoriasique. NEJM 2017 ; 377 : 1537-1550.
- McInnes IB, et al : Upadacitinib chez les patients atteints de polyarthrite psoriasique et une réponse inadéquate à la thérapie non biologique : 56-semaine de données de la phase 3 SELECT-PsA 1 étude. RMD Open 2021 ; 7 : e00183
- Mease PJ, et al : Upadacitinib for Psoriatic Arthritis Refractory to Biologics : SELECT-PsA 2. Ann Rheum Dis 2021 ; 80 : 312-320.
- Mease PJ, et al : Efficacité et sécurité de l’inhibiteur sélectif de TYK2, le deucravacitinib, dans un essai de phase II dans la polyarthrite psoriasique. Ann Rheum Dis 2022 ; 81 : 815-822.
- Ytterberg SR, et al : Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. NEJM 2022 ; 386 : 316-326.
DERMATOLOGIE PRATIQUE 2024 ; 34(1) : 40-41