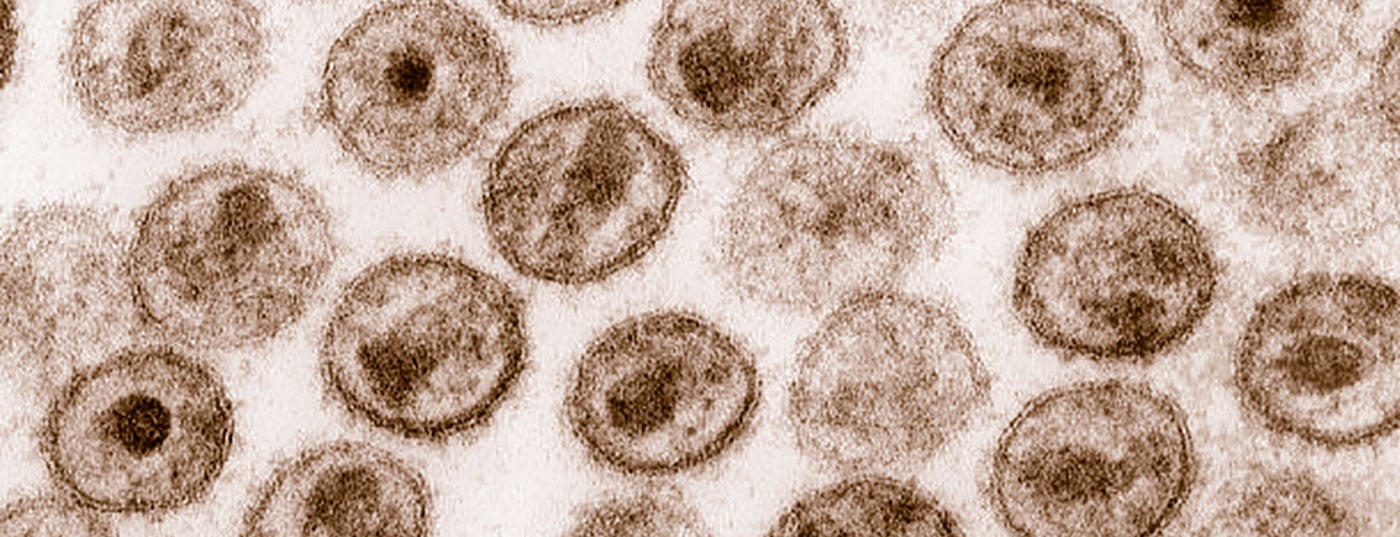
Lors de la 29e CROI, Gilead Sciences a présenté les données à cinq ans de deux études de phase 3 (Study 1489 et Study 1490) qui ont évalué l’utilisation chez des personnes non traitées vivant avec le VIH. Les résultats présentés confirment un profil de sécurité et de tolérance à long terme, ainsi qu’une efficacité continue avec une barrière élevée contre la résistance chez les participants à l’étude. Christophe Griolet, directeur général de Gilead Suisse, fait le point sur les dernières découvertes dans une interview.
Christophe Griolet :
Les études 1489 et 1490 sont des études de phase 3 randomisées, en double aveugle, multicentriques et contrôlées activement. L’objectif des études de non-infériorité était d’évaluer l’efficacité et la sécurité du bictégravir (50 mg) co-formulé avec l’emtricitabine (200 mg) et le ténofovir alafénamide (25 mg) sous forme de comprimé combiné à dose fixe Biktarvy® versus les trithérapies contenant du dolutégravir. Pendant 144 semaines, des participants adultes infectés par le VIH-1 et naïfs de traitement ont reçu en aveugle soit Biktarvy (n=634), soit une trithérapie contenant du dolutégravir (n=640). Après la semaine 144, les participants pouvaient recevoir Biktarvy dans le cadre d’une phase de prolongation active et ouverte jusqu’à 96 semaines.
Quel était exactement le critère d’évaluation primaire de l’étude et a-t-il été satisfait ?
Le critère d’évaluation principal était le pourcentage de participants à l’étude ayant un ARN du VIH-1 <50 copies/ml dans le plasma à la semaine 48, en utilisant l’algorithme Snapshot de la FDA.
Dans l’étude 1489, un ARN du VIH-1 inférieur à 50 copies/ml a été mesuré à la semaine 48 chez 92,4% des patients (n=290 sur 314) du groupe bictégravir et 93% des patients (n=293 sur 315) du groupe dolutégravir (différence -0,6%, IC 95% -4,8 à 3,6 ; p=0,78). Dans l’étude 1490, un ARN du VIH-1 <50 copies/ml a été obtenu à la semaine 48 chez 286/320 (89%) participants dans le groupe bictégravir et 302/325 (93%) dans le groupe dolutégravir (différence -3,5%, IC 95% -7,9 à 1,0, p=0,12). Les deux études ont donc atteint leur critère d’évaluation principal et montrent une non-infériorité du régime bictégravir par rapport au régime dolutégravir.
De quoi s’agit-il exactement et comment agissent le bictégravir, l’emtricitabine et le ténofovir alafénamide ?
Le bictégravir est un inhibiteur d’intégrase (INSTI) de deuxième génération qui inhibe la fonction de l’enzyme virale intégrase, laquelle intègre le génome viral dans l’ADN de la cellule hôte. L’emtricitabine et le ténofovir alafenamide sont des agents de la classe des inhibiteurs nucléosidiques ou nucléotidiques de la transcriptase inverse (NRTI) et inhibent l’enzyme virale transcriptase inverse qui transcrit le génome viral ARN en ADN.
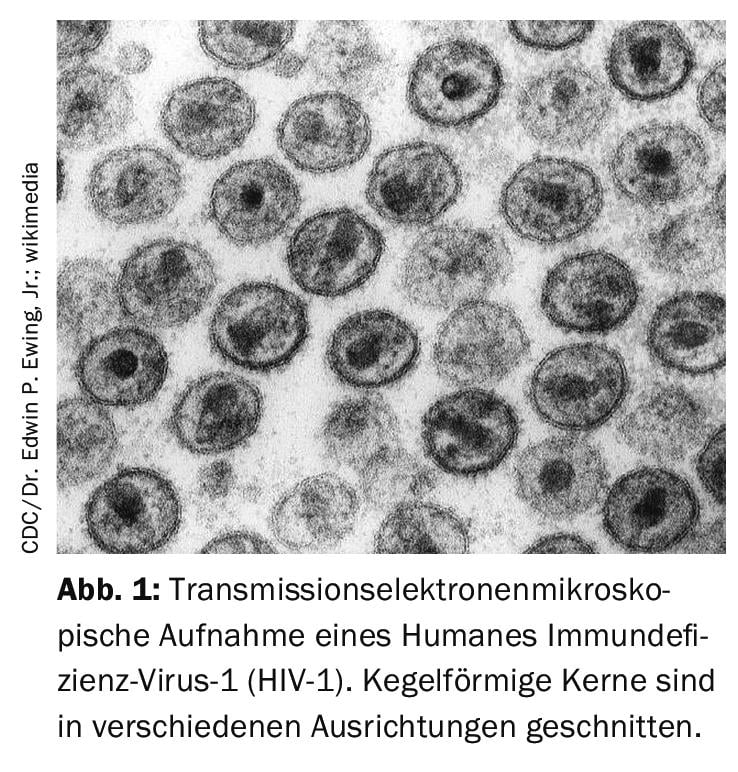
Quels sont les avantages des substances actives dans l’étude ?
Dans les deux études, ≥98% des participants qui ont commencé le traitement par Biktarvy et sont restés dans l’étude pendant 240 semaines ont atteint une charge virale indétectable (ARN du VIH-1 <50 copies/ml) et l’ont maintenue jusqu’à la fin de la période de suivi de cinq ans (semaine 240, 1489 : n=208/213, 1490 : n=218/219, Missing=analyse exclue). Au cours des cinq années d’analyse, aucun cas d’échec du traitement dû à une résistance émergente n’a été observé dans la population finale d’analyse de la résistance des deux études, ce qui démontre encore davantage le profil d’efficacité et de tolérance de Biktarvy dans le traitement du VIH-1 chez les adultes naïfs de traitement.
Quels sont les risques associés aux substances actives ?
Les données soutiennent l’utilisation à long terme de Biktarvy, aucune modification significative des marqueurs métaboliques, osseux et rénaux n’ayant été observée. Dans les deux études, cinq participants (n=5/634) ont présenté des événements indésirables liés au traitement qui ont entraîné l’arrêt de l’étude. En outre, sur une période de 240 semaines, les deux études n’ont observé que de faibles variations médianes de l’eGFR et un ratio TC:HDL stable.
Les données Biktarvy à cinq ans sur les patients naïfs de traitement, présentées lors de la CROI 2022, ont montré d’excellents résultats en termes d’efficacité et aucun cas de résistance n’a été observé au cours des cinq années de l’étude. En ce qui concerne la sécurité du traitement, le pourcentage d’arrêts dus à des événements indésirables était inférieur à 1%, la fonction rénale et le développement lipidique sont restés stables et les effets sur les os sont restés minimes. Ces résultats d’études confirment la robustesse que Biktarvy peut apporter aux patients pour un succès thérapeutique à long terme. Chez Gilead Sciences, nous sommes fiers que les patients du monde entier puissent bénéficier d’un traitement par Biktarvy.
Source : Gilead Sciences, Inc.
Littérature complémentaire :
- Sax PE, Pozniak A, Montes ML, et al : Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490) : a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet 2017 Nov 4;390(10107) : 2073-2082. doi : 10.1016/S0140-6736(17)32340-1. Epub 2017 Aug 31. PMID : 28867499.
- Gallant J, Lazzarin A, Mills A, et al : Bictegravir, emtricitabine, et tenofovir alafenamide versus dolutegravir, abacavir, et lamivudine pour le traitement initial de l’infection par le VIH-1 (GS-US-380-1489) : un essai randomisé, contrôlé, en double aveugle, multicentrique, de phase 3 et de non-infériorité. Lancet 2017 Nov 4 ; 390(10107) : 2063-2072. doi : 10.1016/S0140-6736(17)32299-7. Epub 2017 Aug 31. PMID : 28867497.
- Wohl, et al : B/F/TAF Five-year outcomes in treatment-naive adults. CROI 2022. 12-16 février 2022, virtuel. Poster abstract 494.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(3) : 47