Les dosages en pédiatrie représentent un grand défi pour les médecins pédiatres, car dans de nombreux cas, il n’existe pas de données obligatoires. C’est également le cas en phytothérapie, car des données contraignantes ne peuvent être trouvées qu’avec des études cliniques correspondantes, qui sont rarement réalisées pour des raisons éthiques ou pour lesquelles les autorisations sont rarement accordées.
La phytothérapie adaptée aux enfants
La phytothérapie se présente comme une forme de thérapie adaptée aux enfants pour plusieurs raisons. De nombreux médicaments à base de plantes ont une large marge thérapeutique, c’est pourquoi le risque de surdosage est très faible dans la majorité des cas. En raison de leurs effets généralement doux, de nombreuses plantes médicinales conviennent aux applications pédiatriques, que ce soit en tant que traitement unique ou complémentaire. En outre, les médicaments à base de plantes conviennent très bien aux indications qui doivent souvent être traitées chez les enfants, telles que les maladies respiratoires, les troubles gastro-intestinaux, l’agitation et les troubles du sommeil, ainsi que les applications dermatologiques. Il est très avantageux que les professionnels tels que les médecins et les pharmaciens disposent de suffisamment d’informations sur la posologie des médicaments à base de plantes pour pouvoir conseiller au mieux les parents et utiliser en toute sécurité les médicaments à base de plantes dans les indications appropriées.
Principes de base du dosage
Pour calculer les doses de médicaments pour enfants, on utilise des formules qui tentent de tenir compte de la nature de l’enfant (tableau 1). Il existe peu de littérature sur le dosage des médicaments à base de plantes chez les enfants [1–3]. Si des indications sur les dosages pédiatriques figurent sur la notice d’un médicament, ce sont bien entendu ces indications qui s’appliquent, car elles sont approuvées par Swissmedic. Le tableau 2 présente les médicaments à base de plantes de la liste des spécialités (LS) pour lesquels des dosages pédiatriques sont indiqués dans le prospectus d’emballage.
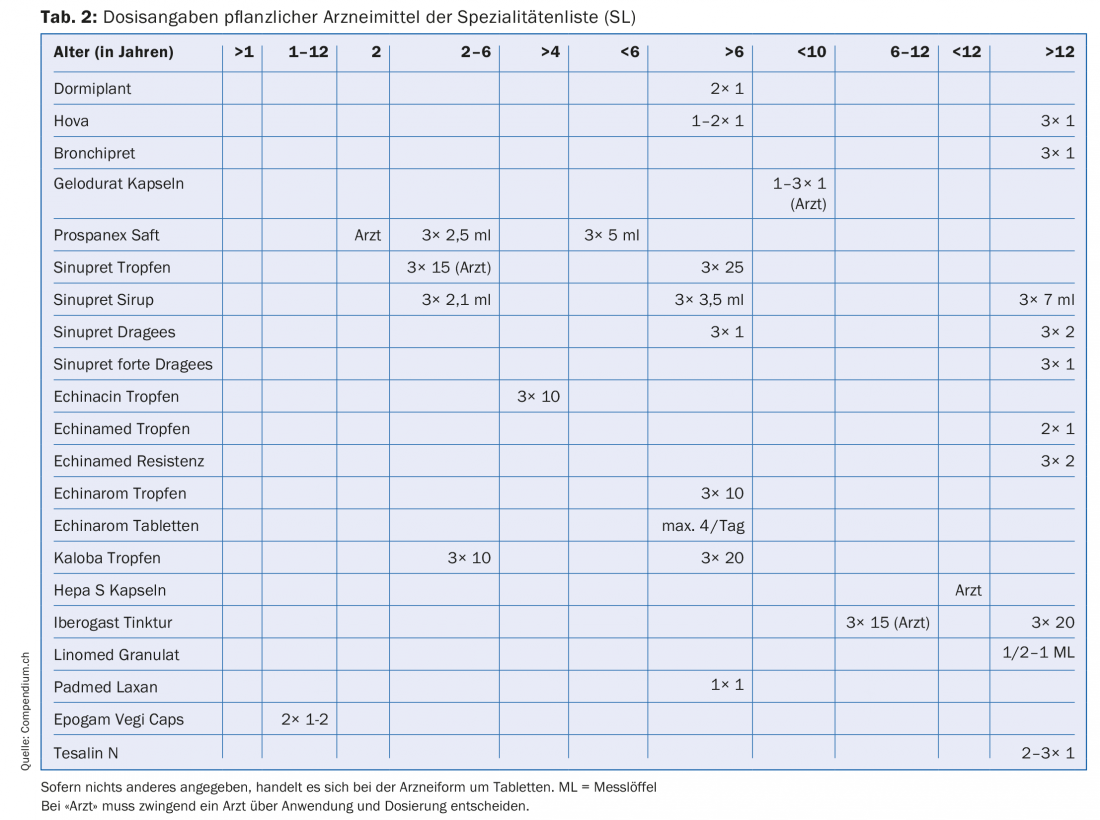
Les indications d’âge
Le tableau 2 montre qu’il existe des indications de dosage pour des groupes d’âge très différents. La gamme des groupes d’âge va de >1 an à >12 ans, avec de nombreux sous-groupes entre les deux.
En outre, il existe des informations destinées aux patients qui, pour certains groupes d’âge, prévoient obligatoirement l’intervention d’un médecin pour une utilisation prévue. Ex. Prospanex sirop contre la toux : chez les nourrissons de moins de deux ans, seul un médecin peut décider de l’utilisation et de la dose. Il existe également des médicaments pour lesquels les informations destinées aux patients indiquent des doses pour un groupe d’âge donné, tout en renvoyant au médecin, qui est responsable en dernier ressort. C’est le cas, par exemple, de l’Iberogast gouttes pour enfants de 6 à 12 ans.
Pourquoi y a-t-il des groupes d’âge si différents ? Plusieurs raisons expliquent cette situation.
Agence européenne des médicaments (EMA)
L’European Medical Agency, l’autorité d’enregistrement de l’Union européenne basée à Londres, stipule que lorsqu’un médicament est nouvellement autorisé, le médicament en question est contre-indiqué chez les enfants et les adolescents de moins de 12 ans, sauf si le demandeur peut fournir des données cliniques pertinentes [4].
Ainsi, si une entreprise pharmaceutique souhaite enregistrer des applications pédiatriques dans le cadre d’une autorisation de mise sur le marché ou du renouvellement d’une autorisation de mise sur le marché d’un médicament, elle doit soumettre un plan d’investigation pédiatrique (PIP). Ce document, créé par l’EMA, définit précisément les documents et le type d’études nécessaires pour obtenir une telle autorisation. Un PIP soumis est examiné par le Paediatric Committee (PDCO), une organisation de l’EMA. Le PDCO décide des autorisations de ces applications pour enfants.
Conférence internationale sur l’harmonisation (ICH)
La définition des classes d’âge des enfants est du ressort de l’International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use, une organisation créée en 1990. Selon son site Internet, son but est de parvenir à une meilleure harmonisation mondiale dans le développement et l’enregistrement de médicaments efficaces et sûrs. Elle encourage le dialogue entre les fabricants et les autorités d’enregistrement. Dans les Guidlines “Clinical Investigation of Medicinal Products in the Pediatric Population” [5] approuvées le 20 juillet 2000, l’ICH définit les classes d’âge pédiatriques suivantes :
- Nouveau-né : 0-27 jours
- nourrissons/petits enfants : de 28 jours à 23 mois
- Enfants : 2-11 ans
- Jeunes : 12 à 16-18 ans
Cette classification est justifiée par les différences de développement du système nerveux central (SNC), du système immunitaire, de la clairance rénale et hépatique, ainsi que par les changements hormonaux (adolescents) de ces classes d’âge.
Autorisation sans PIP
Si, dans le cadre de l’autorisation de mise sur le marché d’un médicament, un laboratoire pharmaceutique souhaite obtenir une recommandation de dosage pour une ou plusieurs de ces classes d’âge dans une indication donnée, il doit, comme nous l’avons déjà mentionné, soumettre un PIP contenant les informations correspondantes. Dans la mesure où elle ne le fait pas ou que les informations contenues dans le PIP ne sont pas approuvées, l’EMA estime que l’utilisation de ce médicament est contre-indiquée pour les enfants et les adolescents de moins de 18 ans. C’est le cas, par exemple, du médicament à base de plantes Kardionin, une préparation à base de Crataegus, qui est enregistré depuis 2013. Comme le fournisseur de Kardionin n’a pas pu ou voulu fournir de documentation sur l’utilisation chez les enfants, ce qui est tout à fait possible compte tenu de l’indication du médicament, le prospectus d’emballage ne mentionne l’utilisation que chez les adultes. >18 ans, ainsi que l’information “L’utilisation et la sécurité de Kardionin chez les enfants et les adolescents n’ont pas encore été évaluées”.
Données divergentes
Dans la liste des médicaments à base de plantes ci-dessous (tableau 2), qui contient des informations sur les dosages pour les enfants, il y a de nombreuses informations qui ne correspondent pas à la classification par âge de l’ICH, par exemple les dosages pour les enfants de plus de six ans ou entre 2 et 6 ans. Ces informations peuvent être fournies parce que les médicaments concernés ont reçu une autorisation de mise sur le marché avant l’entrée en vigueur des dispositions de l’EMA et de l’ICH et qu’ils peuvent fournir les informations correspondantes sur la base des dispositions en vigueur à l’époque.
Résumé
Les médicaments à base de plantes étant bien adaptés à une utilisation en pédiatrie, il est important que les professionnels disposent de bases fiables pour le dosage des classes d’âge correspondantes. En l’absence de telles informations, des approximations de doses appropriées peuvent être faites en utilisant la surface corporelle, le poids ou l’âge de l’enfant. Il s’agit toutefois d’approximations qui doivent être maniées avec précaution. Lors du réenregistrement d’un médicament, donc également d’un médicament à base de plantes, le demandeur doit, conformément aux prescriptions de l’EMA et de l’ICH, fournir des informations précises, justifiées par des études cliniques, sur l’efficacité et la sécurité du médicament afin que des indications correspondantes puissent être fournies. Dans le cas contraire, le médicament est contre-indiqué chez les enfants et les adolescents <18 ans.
Littérature :
- Schicher H, Dorsch W : Phytothérapie en pédiatrie. Wissenschaftliche Verlagsgesellschaft Stuttgart 2006.
- Kooperation Phytopharmaka, Bonn : “Kinderdosierungen von Phytopharmaka” – 3ème édition revue et augmentée 2002.
- von Mandach U, et al. : Utilisation de médicaments à base de plantes en pédiatrie. Phytothérapie 2002(5) ; 2 : 8-16.
- www.ema.europa.eu
- www.ich.org
PRATIQUE DU MÉDECIN DE FAMILLE 2017 ; 12(8) : 2-4












