La colite ulcéreuse (CU) et la maladie de Crohn (MC) sont des maladies inflammatoires chroniques de l’intestin (MICI) qui peuvent entraîner des lésions intestinales progressives et des restrictions massives dans la vie quotidienne des patientes et des patients [2, 3]. Avec la double autorisation de RINVOQ® (upadacitinib), les patientes et les patients en Suisse disposent pour la première fois d’un inhibiteur sélectif de Janus kinases 1 (JAK1) s’administrant par voie orale pour le traitement de la CU et de la MC [1]. Les résultats des études cliniques pivots montrent une réponse rapide en l’espace de quelques jours, une rémission durable pendant 52 semaines et permettent d’envisager des objectifs thérapeutiques stricts à long terme tels que la cicatrisation muqueuse dans le cadre des deux indications [1, 4-8].
Depuis le 7 juin 2024, RINVOQ® est autorisé pour le traitement de la CU active modérée à sévère et de la MC active modérée à sévère chez les patientes et les patients adultes présentant une réponse insuffisante ou une perte de réponse à au moins un agent biologique, qui ne l’ont pas toléré ou pour lesquels ce type de traitement est contre-indiqué [1]. L’autorisation s’appuie sur les résultats de plusieurs études internationales de phase 3 et montre, pour résumer, que RINVOQ®, administré en traitement d’induction de 8 semaines (pour la CU) et de 12 semaines (pour la MC), suivi d’un traitement d’entretien, est bien toléré par les patientes et les patients dans les deux indications et que les critères d’évaluation principaux et secondaires ont été atteints [4, 5, 7]. Sont présentées ci-dessous les données relatives aux populations de patientes et de patients qui, avant le traitement par RINVOQ®, ont présenté une réponse insuffisante au traitement par un agent biologique (bio-IR), c’est-à-dire une réponse insuffisante, une perte de réponse ou une intolérance à ≥ 1 agent biologique [5, 7].
Réponse rapide, rémission durable et cicatrisation muqueuse dans la CU [4-6]
Les études d’induction sur la CU, U-ACHIEVE et U-ACCOMPLISH, ont inclus 988 patientes et patients au total (RINVOQ® n = 660, placebo n = 328), dont environ la moitié présentaient une bio-IR (51,5% sous RINVOQ®, 50,9% sous placebo) [4, 6]. Dès le premier jour, une amélioration significative des symptômes (fréquence des selles, hémorragies rectales) a été observée avec RINVOQ® (45 mg/jour) par rapport au placebo† [6]. Dans l’étude d’entretien U-ACHIEVE, 681 patientes et patients ayant présenté une réponse lors de la phase d’induction ont continué à recevoir 15 mg/jour ou 30 mg/jour de RINVOQ® (respectivement n = 225 et n = 233; placebo n = 223; dont 48% présentaient une bio-IR sous RINVOQ® et 52% sous placebo) [5]. À la semaine 52, respectivement 38,7% (15 mg) et 54,2% (30 mg) des patientes et patients avec bio-IR traités par RINVOQ® ont obtenu une rémission clinique#, contre 6,9% sous placebo (Figure 1). Une amélioration endoscopique£ a même été observée dans respectivement 43,9% (15 mg) et 59,2% (30 mg) des cas, contre 7,4% sous placebo [5]. En outre, respectivement 61% (15 mg) et 73% (30 mg) de s patientes et patients en rémission clinique après le traitement d’induction ont conservé cette rémission clinique jusqu’à la semaine 52 [5].
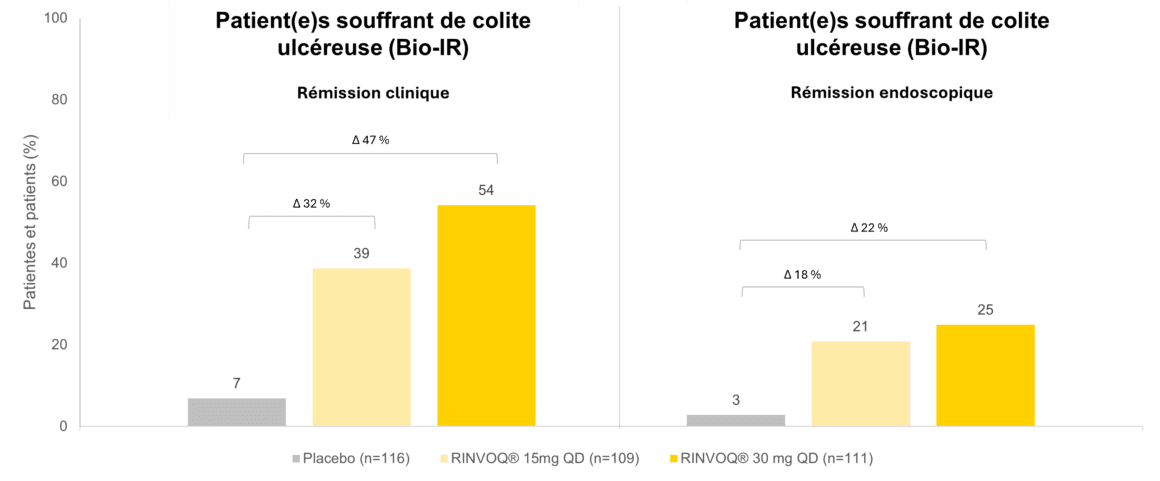
FIGURE 1: RÉMISSION CLINIQUE DÉFINIE SELON LE SCORE DE MAYO ADAPTÉ (SFS ≤1 ET NON SUPÉRIEUR A LA VALEUR
INITIALE, RBS = 0, ESS ≤1 SANS FRIABILITE) ET RÉMISSION ENDOSCOPIQUE DÉFINIE COMME ESS = 0 À LA SEMAINE 52
DE LA PHASE D’ENTRETIEN. BIO-IR = BIOLOGIC INADEQUATE RESPONSE = PATIENTES ET PATIENTS QUI PRÉSENTÉS
UNE RÉPONSE INSUFFISANTE AU TRAITEMENT PAR UN AGENT BIOLOGIQUE, ESS = SCORE ENDOSCOPIQUE, QD = UNE
FOIS PAR JOUR, RBS = SCORE D’HEMORRAGIE RECTALE, SFS = SCORE POUR LA FRÉQUENCE DES SELLES. ADAPTÉ
D’APRÈS [5].
Réponse rapide, rémission durable et cicatrisation muqueuse, également dans la MC [1,7,9]
Les études d’induction sur la MC, U-EXCEL et U-EXCEED, ont inclus 1021 patientes et patients (RINVOQ® n = 350, placebo n = 176 et RINVOQ® n = 324, placebo n = 171, respectivement), dont 46,0% présentaient une bio-IR sous RINVOQ® et 44,3% sous placebo, ou 100% avec bio-IR [7]. À la fin de la phase d’induction de 12 semaines avec 45 mg/jour de RINVOQ®, respectivement 47% (U-EXCEL) et 40% (U-EXCEED) des patientes et patients avec bio-IR ont obtenu une rémission clinique§, contre 14% sous placebo dans les deux études [1]. L’étude d’entretien U-ENDURE, réalisée à la suite, a été poursuivie avec 502 patientes et patients ayant présenté une réponse pendant la phase d’induction [7]. Ceux-ci ont reçu respectivement 15 mg/jour et 30 mg/jour de RINVOQ® (n = 169 et n = 168) ou un placebo (n = 165), 74,5% d’entre eux ayant présenté une bio-IR sous RINVOQ® et 76,4% sous placebo [7]. À la semaine 52, respectivement 32,3% (15 mg) et 42,5 % (30 mg) des patientes et patients avec bio-IR avaient obtenu une rémission clinique§, contre 8,7% sous placebo [7]. À cet égard, 44% (15 mg) et 60% (30 mg) des patientes et patients en rémission clinique après le traitement d’induction ont pu conserver cette rémission clinique jusqu’à la semaine 52 [9]. Une cicatrisation muqueuse, définie comme une endoscopie sans ulcération, a été observée chez respectivement 12% (15 mg) et 20% (30 mg) des patientes et patients avec bio-IR traités par RINVOQ® et chez 2% des patientes et patients avec bio-IR sous placebo [1].
Le profil de sécurité de RINVOQ® présente un rapport bénéfice/risque positif [1,5,7]
RINVOQ® a été bien toléré dans les études cliniques sur la CU et la MC contrôlées contre placebo et aucun nouveau risque en matière de sécurité n’a été observé par rapport aux autres indications autorisées en rhumatologie et en dermatologie [1, 5, 7]. Les effets indésirables les plus fréquemment rapportés (≥ 3% des patientes et des patients atteints de CU ou de MC) sous RINVOQ® (45 mg, 30 mg ou 15 mg) ont été les infections des voies respiratoires supérieures, la fièvre, l’augmentation de la créatine phosphokinase, l’anémie, les céphalées, l’acné, le zona, la neutropénie, l’éruption, la pneumonie, l’hypercholestérolémie, la bronchite, l’augmentation de l’aspartate aminotransférase, la fatigue, la folliculite, l’augmentation de l’alanine aminotransférase, l’herpès simplex et la grippe [1]. L’efficacité et la sécurité de RINVOQ® continuent d’être évaluées dans le cadre d’études à long terme en cours [5, 7]. Compte tenu du risque accru d’infections graves, d’infarctus du myocarde et de tumeurs malignes associé aux inhibiteurs de JAK chez les patientes et les patients âgés de plus de 65 ans, RINVOQ® doit être utilisé avec une prudence particulière chez les personnes atteintes de CU ou de MC dans ce groupe d’âge ou présentant des facteurs de risque cardiovasculaires (y compris les fumeurs actuels et les ex-fumeurs) ou de tumeurs malignes [1]. En résumé, les données des études pivots sur la CU et la MC montrent que les deux doses d’entretien de RINVOQ® étaient significativement plus efficaces que le placebo, et ce, en termes de résultats cliniques, endoscopiques et histologiques importants [5, 7]. Parallèlement, un profil de sécurité bien étudié, ne présentant pas de nouveaux risques en matière de sécurité, s’est maintenu dans l’ensemble de la population étudiée pendant 52 semaines [5, 7].
Conclusion
Pour les patientes et les patients atteints de CU et de MC, RINVOQ® constitue une option thérapeutique prometteuse après l’échec d’au moins un agent biologique, et est associé à un délai d’action rapide, à une rémission durable et à une cicatrisation muqueuse pendant au moins 52 semaines. La double autorisation de RINVOQ® pour la CU et la MC constitue donc une nouvelle étape importante qui peut permettre d’atteindre les objectifs thérapeutiques à court, moyen et long terme, y compris la guérison endoscopique, tels qu’ils sont recommandés dans l’algorithme «Treat-to-Target» de STRIDE II [4-8, 10].
† Cette analyse comprend les patientes et patients qui n’ont pas encore répondent insuffisante au traitement par un agent biologique et qui sont donc hors étiquette selon l’autorisation de mise sur le marché suisse.
# Rémission clinique de la CU = Adapted Mayo Score (score de Mayo adapté ≤ 2, avec SFS ≤ 1 et non supérieur à la valeur initiale, RBS = 0 et ESS ≤ 1 sans friabilité. ESS, score endoscopique (endoscopic score); RBS, score d’hémorragie rectale (rectal bleeding score); SFS, score pour la fréquence des selles (stool frequency score)) [4]
£ Amélioration endoscopique de la CU = ESS ≤ 1 sans friabilité. ESS, score endoscopique (endoscopic score) [5].
§ Rémission clinique de la MC = FS/APS (FS quotidienne moyenne ≤ 2,8 ET APS quotidien moyen ≤ 1, les deux valeurs n’étant pas plus mauvaises que la valeur initiale. APS, score de douleur abdominale (abdominal pain score); FS, fréquence des selles) [7]
Version abrégée de l’information professionnelle RINVOQ®
Références:
1. Information professionnelle actuelle de RINVOQ® (upadacitinib) sur www.swissmedicinfo.ch.
2. Dolinger, M., J. Torres, and S. Vermeire, Crohn’s disease. Lancet, 2024. 403(10432): p. 1177-1191.
3. Le Berre, C., S. Honap, and L. Peyrin-Biroulet, Ulcerative colitis. Lancet, 2023. 402(10401): p. 571-584.
4. Danese, S., et al., Upadacitinib as induction and maintenance therapy for moderately to severely active ulcerative colitis: results from three phase 3, multicentre, double-blind, randomised trials. Lancet, 2022. 399(10341): p. 2113-2128. Incl. Suppl.
5. Vermeire, S., et al., Efficacy and safety of upadacitinib maintenance therapy for moderately to severely active ulcerative colitis in patients responding to 8 week induction therapy (U-ACHIEVE Maintenance): overall results from the randomised, placebo-controlled, double-blind, phase 3 maintenance study. Lancet Gastroenterol Hepatol, 2023. 8(11): p. 976-989. Incl. Suppl.
6. Loftus, E.V., Jr., et al., Upadacitinib Therapy Reduces Ulcerative Colitis Symptoms as Early as Day 1 of Induction Treatment. Clin Gastroenterol Hepatol, 2023. 21(9): p. 2347-2358 e6.
7. Loftus, E.V., Jr., et al., Upadacitinib Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med, 2023. 388(21): p. 1966-1980. Incl. Suppl.
8. Colombel, J.F., et al., Upadacitinib Reduces Crohn’s Disease Symptoms Within the First Week of Induction Therapy. Clin Gastroenterol Hepatol, 2024.
9. Peyrin-Biroulet, L., et al., Upadacitinib Achieves Clinical and Endoscopic Outcomes in Crohn’s Disease Regardless of Prior Biologic Exposure. Clin Gastroenterol Hepatol, 2024. 22(10): p. 2096-2106.
10. Turner, D., et al., STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology, 2021. 160(5): p. 1570-1583.
Les références peuvent être demandées par les professionnels de la santé en écrivant à medinfo.ch@abbvie.com.
Cet article a bénéficié du soutien financier d’AbbVie SA, Alte Steinhauserstrasse 14, Cham.
CH-RNQG-240118 02/2025











