En Suisse, l’autorisation de mise sur le marché du dupilumab, un médicament biologique très efficace, dans le domaine d’indication de la dermatite atopique est jusqu’à présent limitée aux patients adultes et adolescents de plus de 12 ans. L’anticorps monoclonal convainc par un soulagement rapide et durable des symptômes et améliore de manière prouvée la qualité de vie des personnes atteintes de dermatite atopique. Dans l’UE, une extension d’indication pour la tranche d’âge 6-11 ans a été accordée il y a quelques mois sur la base d’études de phase III correspondantes. Des données récemment publiées dans le cadre de l’étude LIBERTY AD-PRESCHOOL montrent que le dupilumab est également efficace et sûr chez les enfants d’âge préscolaire.
Les patients atteints de dermatite atopique souffrent d’une qualité de vie considérablement réduite, en particulier lorsque la maladie est sévère. Les démangeaisons sont très désagréables, peuvent entraîner des troubles du sommeil et contribuer à des difficultés de concentration et d’apprentissage, en particulier chez les enfants et les adolescents. En outre, les patients se sentent très stigmatisés par les modifications visibles de la peau. L’objectif principal du traitement est de soulager les démangeaisons et de traiter les lésions inflammatoires de la peau. Une thérapie basée sur les lignes directrices est adaptée à chaque étape. La thérapie systémique est recommandée pour les eczémas persistants et sévères qui ne répondent pas suffisamment aux traitements locaux.
Pour les 12-17 ans, schéma posologique adapté au poids
L’anticorps monoclonal dupilumab bloque la transduction du signal des interleukines 4 et 13, dont l’expression est corrélée à l’activité de la maladie chez les personnes atteintes de dermatite atopique. Le dupilumab (Dupixent®) est disponible sous forme de seringue prête à l’emploi au dosage prescrit et peut être administré par les patients eux-mêmes par voie sous-cutanée après avoir reçu des instructions médicales [1]. Pour les adultes souffrant de dermatite atopique modérée à sévère, Dupixent® est autorisé en Suisse depuis 2019. En novembre 2020, Swissmedic a accordé une extension d’indication pour les adolescents à partir de 12 ans. Dupixent® est indiqué lorsque le traitement par des médicaments topiques délivrés sur ordonnance ne permet pas un contrôle adéquat de la maladie ou n’est pas recommandé [1]. La condition pour une prise en charge par la caisse d’assurance maladie est qu’un traitement avec au moins un immunosuppresseur conventionnel n’ait pas eu d’effet suffisant. Chez les adultes, le dupilumab est administré à une dose initiale de 600 mg (2× 300 mg), puis 300 mg à deux semaines d’intervalle. Chez les patients âgés de 12 à 17 ans, l’intervalle d’administration est également de deux semaines, le schéma posologique est adapté au poids : chez les adolescents dont le poids corporel est <60 kg, la dose initiale est de 400 mg (2× 200 mg), puis 200 mg à deux semaines d’intervalle. Chez les adolescents dont le poids corporel est ≥60 kg, une dose initiale de 600 mg (2× 300 mg) est recommandée, puis 300 mg à intervalles de deux semaines [1].
Déjà autorisé dans l’UE pour les enfants de 6 à 11 ans et
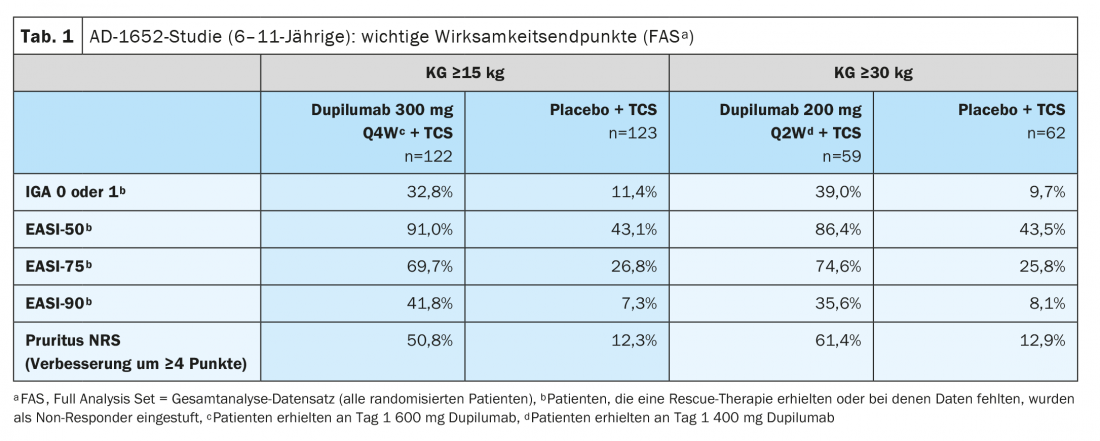
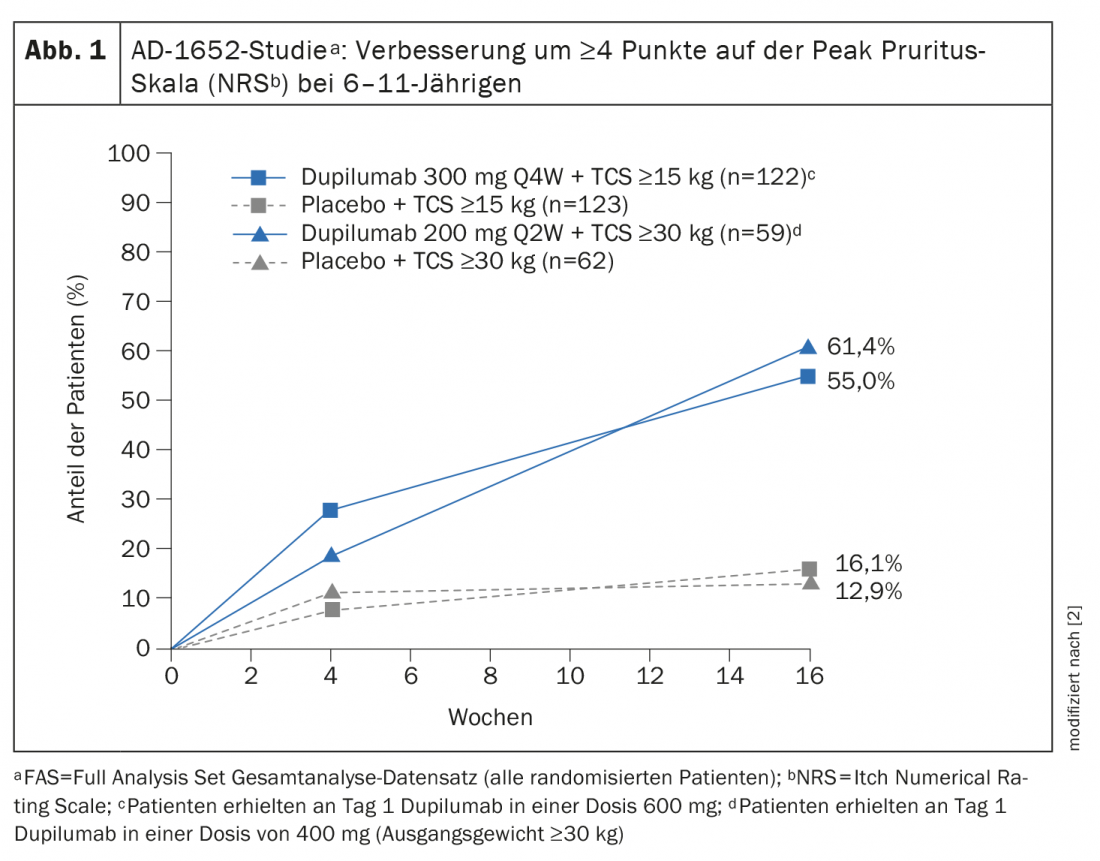
La Commission européenne a accordé une autorisation de mise sur le marché au dupilumab pour les enfants de plus de 6 ans en novembre 2020 [2,3]. L’extension d’indication est basée sur les données de l’étude AD-1652 randomisée, contrôlée en double aveugle, qui a évalué l’efficacité et la sécurité du dupilumab en association avec les TCS chez 367 patients âgés de 6 à 11 ans. Les résultats des principaux critères d’efficacité sont présentés dans le tableau 1 [2]. Le critère d’évaluation coprimaire était le pourcentage de patients avec IGA* 0 ou 1 (sans ou presque sans apparition) avec une amélioration de ≥2 points et le pourcentage de patients avec EASI-75 (amélioration EASI d’au moins 75%) entre la ligne de base et la semaine 16. Les résultats stratifiés par poids initial ont montré que pour les participants à l’étude ayant un PG de 15-29,9 kg traités par dupilumab 300 mg Q4Wd#+ TCS, 32,8% des patients n’ont pas ou presque pas eu d’apparition de la peau (IGA 0 ou 1), contre 11,4% des participants à l’étude traités par placebo plus TCS. Chez les patients ≥30 kg, qui ont reçu 200 mg de dupilumab toutes les deux semaines, les chiffres étaient même de 39,0% contre 9,7%. Une amélioration de 75% de l’aspect de la peau selon l’Eczema Area and Severity Index (EASI-75) a été observée chez 69,7% et 74,6% des patients traités par dupilumab, contre 26,8% et 25,8% dans les groupes placebo correspondants. Dupilumab+TCS s’est également révélé nettement supérieur au placebo+TCS en termes de réduction du SCORAD et d’amélioration du NRS. Plus de la moitié des patients des groupes dupilumab ont obtenu une amélioration de ≥4 points dans le NRS, alors que dans les groupes placebo, ces pourcentages étaient respectivement de 12,9% et de 12%. 16,1% (graphique 1).
* IGA = Évaluation globale de l’investigateur
#
Q4Wd = intervalle de dosage de 4 semaines
Patients âgés de 6 mois à 5 ans : de nouvelles données prometteuses
La dermatite atopique débute généralement entre 3 et 6 mois, 60% des patients développant la maladie au cours de la première année de vie Jusqu’à l’âge de 5 ans , la maladie se déclare chez 90 % des patients [4]. L’étude de phase III LIBERTY AD PRESCHOOL a confirmé le profil d’efficacité et de sécurité bien établi de Dupixent® dans d’autres groupes d’âge chez des enfants âgés de 6 mois à 5 ans souffrant de dermatite atopique modérée à sévère. Tous les critères d’évaluation primaires et secondaires ont été atteints. Les données montrent que l’ajout du dupilumab au traitement standard par corticostéroïdes topiques (TCS) a réduit de manière significative la sévérité globale de la maladie et, après 16 semaines, a amélioré l’absence de peau, les démangeaisons et la qualité de vie liée à la santé par rapport au TCS seul. Au cours de la période de traitement de 16 semaines, le taux global d’événements indésirables (EI) était de 64% pour le dupilumab et de 74% pour le placebo. Les EI les plus fréquents ont été la rhinopharyngite (8% dupilumab, 9% placebo), les infections des voies respiratoires supérieures (6% dupilumab, 8% placebo) et la conjonctivite (5% dupilumab, 0% placebo), les infections virales à herpès (6% dupilumab, 5% placebo) et les réactions au site d’injection (2% dupilumab, 3% placebo). En résumé, les résultats de sécurité de cette étude étaient conformes au profil de sécurité connu du dupilumab dans la dermatite atopique.
Littérature :
- Information professionnelle brève : Dupixent®, www.swissmedicinfo.ch (dernière consultation 19.11.2021)
- Agence européenne des médicaments (EMA), www.ema.europa.eu/en/documents/product-information/dupixent-epar-product-information_de.pdf (dernière consultation 19.11.2021)
- “Dupixent® (dupilumab) approuvé par la Commission européenne comme premier et seul médicament biologique pour les enfants âgés de 6 à 11 ans atteints de dermatite atopique sévère”, Sanofi, 30.11.2021
- Barbarot S, et al : Epidémiologie de la dermatite atopique chez l’adulte : Résultats d’une enquête internationale. Allergy 2018 ; 73(6) : 1284-1293.
DERMATOLOGIE PRATIQUE 2021 ; 31(6) : 41-42