Les malformations cardiaques congénitales font partie des anomalies congénitales les plus courantes. Les développements modernes de la chirurgie cardiaque permettent généralement d’y remédier avec succès. Toutefois, cela ne suffit pas. En effet, le risque de complications cardiovasculaires augmente pour les adultes atteints de malformations cardiaques. L’endocardite infectieuse, par exemple, est une menace croissante.
Les cardiopathies congénitales sont les défauts de naissance les plus fréquents. Environ 1/100 bébés nés vivants sont concernés et environ 6/1000 bébés ont une cardiopathie congénitale complexe [1]. Sans intervention, beaucoup de ces malformations cardiaques ont un très mauvais pronostic. Grâce au développement de la médecine cardiaque moderne, en particulier de la chirurgie cardiaque, la plupart de ces défauts peuvent être réparés avec succès et la majorité des patients atteints atteignent désormais l’âge adulte [2]. Cette évolution se traduit par une croissance rapide des cohortes d’adultes atteints de cardiopathies congénitales [3,4]. Rapiécé n’est pas guéri ! Bien que la plupart des adultes atteints de malformations cardiaques aient une bonne qualité de vie, le risque de complications cardiovasculaires est élevé. Outre un risque élevé d’arythmie cardiaque et un risque accru de développer une insuffisance cardiaque, l’endocardite infectieuse constitue une menace croissante.
Épidémiologie et risque d’endocardite
Les études basées sur la population ont montré une augmentation lente mais constante de l’incidence des endocardites infectieuses au cours des deux dernières décennies, en particulier chez les personnes âgées [5]. Cette augmentation est probablement due au vieillissement de la société et à l’augmentation des interventions cardiaques dans le groupe de population plus âgé. Ces interventions comprennent l’implantation de stimulateurs et de défibrillateurs transveineux et, en particulier, l’augmentation des interventions sur valves grâce à la disponibilité d’options de traitement percutanées basées sur des cathéters.
En revanche, l’incidence de l’endocardite infectieuse dans la cohorte des adultes atteints de cardiopathies congénitales est plusieurs fois supérieure à celle de la population générale. Dans les études contemporaines basées sur la population, l’incidence des endocardites infectieuses dans la population générale est d’environ 7,6 cas/100 000 années-patients, alors que l’incidence chez les adultes atteints de cardiopathies congénitales est de 133 cas/100 000 années-patients [5–7]. En conséquence, le nombre d’adultes atteints d’endocardite infectieuse liée à une cardiopathie congénitale nécessitant un traitement dans des centres spécialisés est en forte augmentation (figure 1).
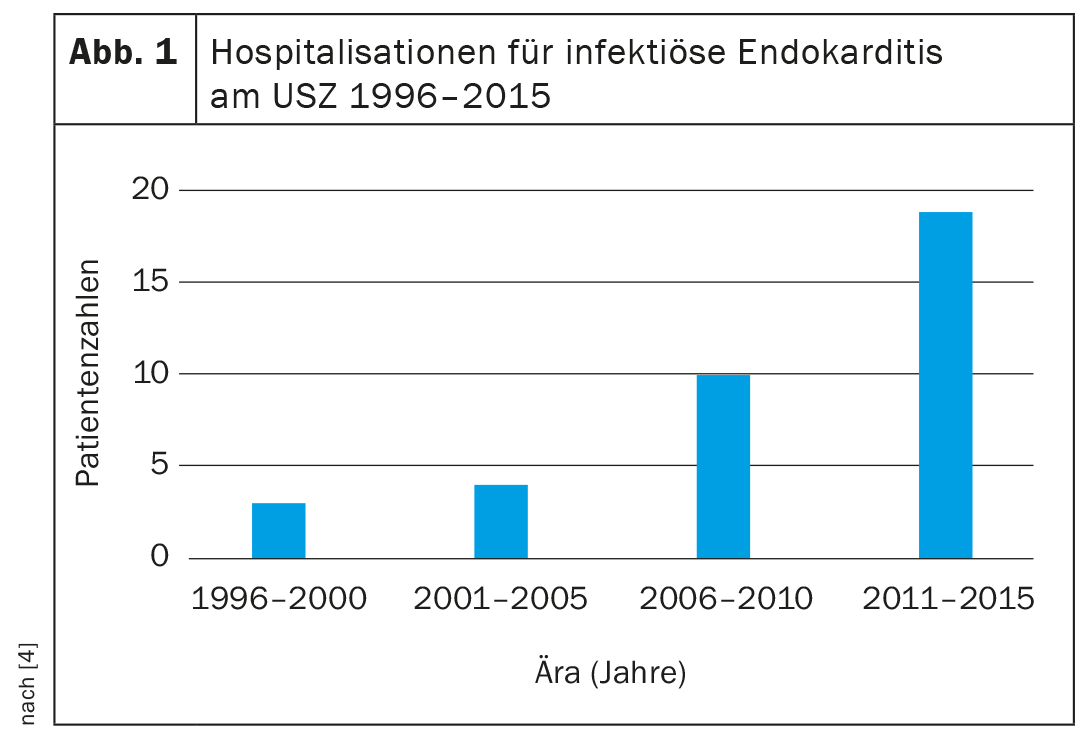
L’augmentation du nombre de cas et du risque d’endocardite chez les adultes atteints de cardiopathies congénitales est due, d’une part, à l’augmentation rapide du nombre de patients concernés et, d’autre part, au fait qu’environ 20 à 25% des adultes atteints de cardiopathies congénitales appartiennent au groupe le plus exposé au risque d’endocardite infectieuse. (Aperçu 1) [4,8].

Présentation et diagnostic
Comme pour les patients atteints d’endocardite infectieuse dans le cadre de cardiopathies acquises, le diagnostic d’endocardite infectieuse chez les adultes atteints de cardiopathies congénitales repose sur la présentation clinique du patient, la cardiopathie individuelle, la détection de l’agent pathogène responsable (dans les tissus, les hémocultures ou les sérologies) et la mise en évidence de modifications morphologiques typiques de l’endocardite sur les valves cardiaques ou le matériel étranger (électrodes de stimulateur cardiaque ou de DAI). Les critères de diagnostic clinique de l’endocardite infectieuse sont résumés dans le tableau 2 (critères de Duke modifiés) [9].
Particularités des adultes atteints de cardiopathies congénitales
Endocardite des valves pulmonaires : L’endocardite des prothèses des valves pulmonaires, illustrée dans la vignette de cas, représente un défi particulier. Les résidus hémodynamiques de la voie d’écoulement du ventricule droit sont fréquents chez les adultes dont les cardiopathies congénitales ont été réparées. En particulier, la popularité de la chirurgie de Ross et les indications libérales pour le remplacement secondaire de la valve pulmonaire chez les patients présentant une insuffisance valvulaire pulmonaire résiduelle après une chirurgie de réparation dans l’enfance, a conduit à une cohorte rapidement croissante d’adolescents et d’adultes plus jeunes avec des prothèses de valve pulmonaire [10]. En cas de dégénérescence de la prothèse valvulaire pulmonaire, le remplacement valvulaire pulmonaire percutané est devenu la procédure standard au cours des deux dernières décennies. Plusieurs études ont montré que le risque d’endocardite infectieuse après un remplacement valvulaire pulmonaire prothétique, en particulier percutané, est très élevé et atteint au moins 2% par année-patient [11].
Alors que l’endocardite des valves pulmonaires est exceptionnellement rare dans la population générale, l’endocardite des prothèses de valves pulmonaires est désormais la forme d’endocardite la plus fréquente chez les adultes atteints de cardiopathies congénitales. La présentation, les signes cliniques et l’imagerie sont souvent atypiques et inhabituels pour les cardiologues non spécialisés et les médecins généralistes. Dans notre expérience, le diagnostic est donc souvent retardé, ce qui est associé à une morbidité accrue [12].
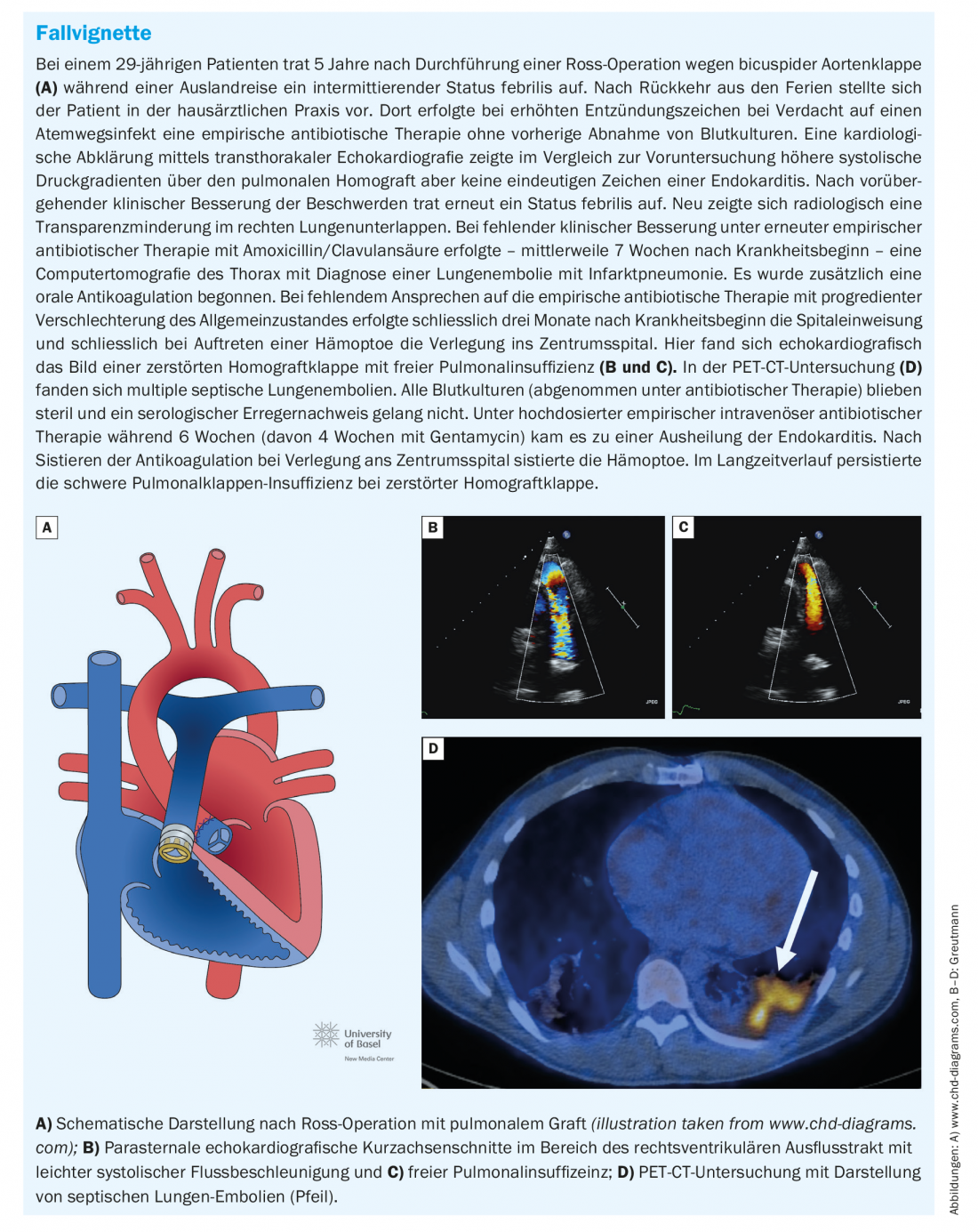
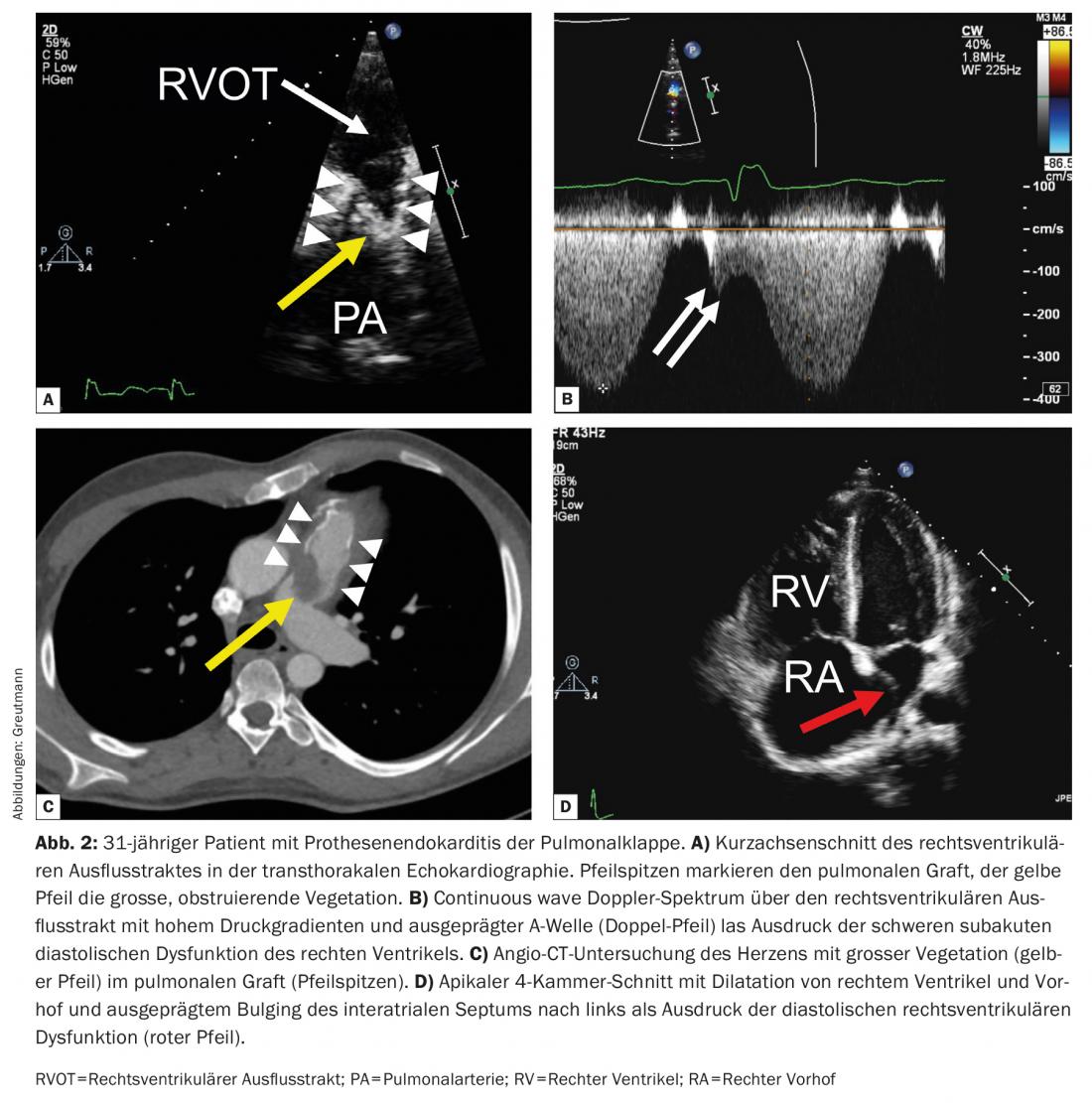
Contrairement aux endocardites valvulaires natives, qui se présentent souvent sous la forme d’une insuffisance valvulaire croissante, l’endocardite prothétique de la valve pulmonaire se caractérise le plus souvent par une obstruction de la valve comme principale manifestation hémodynamique (environ 60% des cas). Celle-ci peut être très prononcée et aller jusqu’au choc cardiogénique. Outre l’infection non maîtrisée, l’obstruction valvulaire sévère est l’indication la plus fréquente pour un remplacement valvulaire chirurgical d’urgence. Il est donc important de transférer rapidement les patients concernés vers un centre spécialisé offrant la possibilité d’une intervention chirurgicale rapide. En raison de la position antérieure des prothèses valvulaires pulmonaires dans le thorax, il est parfois difficile de les visualiser sur l’échocardiographie tranœsophagienne et un examen transthoracique minutieux doit toujours être effectué en premier lieu. Les embolies pulmonaires septiques sont fréquentes et peuvent être utiles comme critère mineur supplémentaire pour poser le diagnostic lorsque la prothèse valvulaire est difficile à visualiser en échocardiographie. Les embolies pulmonaires septiques cliniquement manifestes, voire les abcès pulmonaires, sont plus fréquents en cas de retard de diagnostic et doivent être distingués d’une simple pneumonie lorsque la constellation le permet ( Fig. 2) [12].
Endocardite au niveau des lésions du jet
En ce qui concerne la pathogenèse de l’endocardite, nous partons du principe que les défauts (subcliniques) de l’endocarde constituent le principal facteur de risque pour le développement d’une endocardite due à des bactériémies quotidiennes. Ces défauts de l’endocarde sont dus à un flux sanguin turbulent au niveau de valves cardiaques fonctionnant anormalement ou de corps étrangers endovasculaires. Des vitesses de flux sanguin élevées associées à des gradients de pression élevés favorisent ces défauts endocardiques (valves cardiaques gauches, petits défauts du septum ventriculaire), tandis que les structures présentant des vitesses de flux plus faibles sont peu (par exemple, les valves pulmonaires natives chez les patients sans hypertension pulmonaire) ou jamais affectées par une endocardite (par exemple, les défauts du septum auriculaire).
Les défauts de l’endocarde peuvent également apparaître au niveau des lésions du jet et provoquer une endocardite au niveau des structures cardiaques qui ne sont pas primitivement modifiées. Cela concerne notamment les valves aortiques bicuspides insuffisantes et les défauts du septum ventriculaire. La valve aortique bicuspide entraîne souvent une insuffisance aortique excentrique dirigée vers le voile mitral antérieur. Fig. 3A-C) montre un exemple typique d’endocardite de la valve mitrale dans le cadre d’une pathologie valvulaire aortique primaire. De même, les endocardites liées aux petits défauts du septum ventriculaire surviennent généralement dans la zone où le jet systolique du shunt gauche-droite rencontre l’appareil sous-valvulaire de la valve tricuspide (Fig. 3D-F).

Prévention, prophylaxie et éducation des patients
Jusqu’à récemment, la prévention de l’endocardite consistait à identifier les patients présentant le risque le plus élevé d’endocardite (tableau 2) et à leur donner des instructions sur la protection antibiotique à utiliser lors des interventions dentaires (avec une carte d’endocardite correspondante). Cependant, comme l’illustre la vignette de cas, notre expérience clinique montre que le diagnostic d’endocardite est souvent retardé, avec des conséquences parfois désastreuses. Cela s’explique par le fait que les endocardites dues à des germes buccaux ne sont responsables que d’environ un quart de toutes les endocardites. De plus, des études montrent que des bactériémies transitoires avec des germes buccaux se produisent plusieurs fois par jour, par exemple lors du brossage des dents ou de la mastication [13]. Pour la prévention de l’endocardite infectieuse, la prophylaxie antibiotique lors d’interventions dentaires est donc d’une importance secondaire. Les directives suisses révisées sur l’endocardite tiennent compte de cet aspect [14]. L’accent est désormais mis en premier lieu sur l’éducation des patients pour tous les patients présentant un risque accru d’endocardite. En collaboration avec la Fondation Suisse de Cardiologie, des brochures d’information ont été élaborées et peuvent être distribuées aux patients présentant un risque d’endocardite. Ces dépliants peuvent être commandés gratuitement auprès de la Fondation Suisse de Cardiologie (www.endocarditis.ch).
Notre propre expérience montre qu’avec un simple programme d’éducation des patients, que nous avons mis en place depuis quelques années dans notre routine quotidienne de consultation, le délai entre le début des symptômes et le diagnostic et le traitement correct d’une endocardite infectieuse peut être considérablement réduit [12].
La mesure préventive la plus importante pour éviter une endocardite à prothèse de valve pulmonaire est d’éviter l’implantation d’une prothèse ! Nous sommes donc tenus de peser très soigneusement les bénéfices et les risques à long terme lors de l’indication d’un remplacement valvulaire pulmonaire.
Littérature :
- Hoffman JI, Kaplan S : L’incidence des cardiopathies congénitales. Journal de l’American College of Cardiology 2002 ; 39(12) : 1890-1900.
- Moons P, Bovijn L, Budts W, et al : Tendances temporelles de la survie à l’âge adulte chez les patients nés avec une cardiopathie congénitale de 1970 à 1992 en Belgique. Circulation 2010 ; 122(22) : 2264-2272.
- Marelli AJ, Ionescu-Ittu R, Mackie AS, et al. : Lifetime prevalence of congenital heart disease in the general population from 2000 to 2010. Circulation 2014 ; 130(9) : 749-756.
- Padrutt M, Bracher I, Bonassin F, et al : Impact of growing cohortes of adults with congenital heart disease on clinical workload : a 20-year experience at a tertiary care centre. Swiss medical weekly 2017 ; 147 : w14443.
- Erichsen P, Gislason GH, Bruun NE : L’augmentation de l’incidence de l’endocardite infectieuse au Danemark, 1994-2011. Eur J Intern Med 2016 ; 35 : 95-99.
- Toyoda N, Chikwe J, Itagaki S, et al : Trends in Infective Endocarditis in California and New York State, 1998-2013. Jama 2017 ; 317(16) : 1652-1660.
- Kuijpers JM, Koolbergen DR, Groenink M, et al : Incidence, facteurs de risque et prédicteurs d’endocardite infectieuse dans les cardiopathies congénitales adultes : focus sur l’utilisation de matériel prothétique. European heart journal 2017 ; 38(26) : 2048-2056.
- Tobler D, Schwerzmann M, Bouchardy J, et al : Swiss Adult Congenital HEart disease Registry (SACHER) – rationale, design and first results. Swiss medical weekly 2017 ; 147 : w14519.
- Habib G, Lancellotti P, Antunes MJ, et al. : 2015 ESC Guidelines for the management of infective endocarditis : The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by : European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). European heart journal 2015;36(44) : 3075-3128.
- O’Byrne ML, Glatz AC, Mercer-Rosa L, et al. : Trends in pulmonary valve replacement in children and adults with tetralogy of fallot. The American journal of cardiology 2015 ; 115(1) : 118-124.
- Van Dijck I, Budts W, Cools B, et al : Endocardite infectieuse d’une valve pulmonaire transcathéter en comparaison avec des implants chirurgicaux. Heart 2015 ; 101(10) : 788-793.
- Babic D, Hammerli R, Santos Lopes B, et al : Impact of a structured patient education programme on early diagnosis of prosthesis pulmonary valve endocarditis. Cardiology in the young 2021 : 1-6.
- Lockhart PB, Brennan MT, Sasser HC, et al : Bacteremia associated with toothbrushing and dental extraction. Circulation 2008 ; 117(24) : 3118-3125.
- Sendi P, Hasse B, Frank M, et al : Endocardite infectieuse : prévention et prophylaxie antibiotique. Swiss medical weekly 2021 ; 151 : w20473.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(3) : 11-15













