Les patients atteints de LMC ont une espérance de vie normale lorsqu’ils sont traités en phase chronique par des inhibiteurs de kinase spécifiques de l’Abl (TKI). Dans le traitement de première ligne de la LMC, l’imatinib, le dasatinib et le nilotinib sont autorisés. En cas de résistance ou d’intolérance, le bosutinib et le ponatinib sont des alternatives aux ITK. L’objectif du traitement est d’atteindre une rémission moléculaire profonde (RM). Il s’agit d’une condition préalable aux concepts d’arrêt des ITK et à l’obtention d’une rémission sans traitement (TFR). Les mécanismes biologiques qui sous-tendent le TFR ne sont pas connus avec précision, mais ils sont probablement à médiation immunologique. Il est possible qu’un traitement temporaire à l’interféron alpha (IFN) ou un traitement par inhibiteur de point de contrôle immunitaire puisse augmenter le taux de TFR. Ces questions sont actuellement abordées dans le cadre d’études cliniques.
Chaque patient atteint de LMC doit être traité avec un TKI spécifique à l’Abl approuvé en première ligne. Une réponse thérapeutique moléculaire opportune est importante pour le pronostic. Pour pouvoir en juger, il est essentiel de mesurer régulièrement la charge en ARNm de BCR-ABL (tous les trois mois jusqu’à ce que le RMM soit stable, puis au moins tous les six mois) sous traitement par ITK [1]. Le nombre de copies de BCR-ABL est mesuré dans des laboratoires standardisés et exprimé de manière unifiée dans l’unité internationale “IS” [2]. La charge BCR-ABL après IS donne une indication de la profondeur de la rémission obtenue. Il exprime la chute du nombre de copies de BCR-ABL dans le sang périphérique par paliers logarithmiques par rapport à la valeur initiale au moment du diagnostic. Pour simplifier, une MR3 (MMR) correspond à une baisse de la charge de BCR-ABL de trois niveaux log, une MR4 à une baisse de quatre niveaux log, etc.
La mesure de la charge BCR-ABL en fonction du moment du traitement permet d’évaluer la réponse et, le cas échéant, de modifier le traitement en cas de résistance au traitement [1]. En cas de résistance, de comorbidités ou d’intolérance, des inhibiteurs d’Abl tels que le bosutinib ou le ponatinib sont disponibles comme alternatives thérapeutiques en plus des traitements de première ligne.
La transplantation de cellules souches allogéniques (allo-SCT) est une option de traitement qui n’est généralement indiquée que chez les patients atteints de LMC avancée ou réfractaire à plusieurs ITK.
Interféron alpha (IFN)
Une monothérapie par IFN n’est que peu efficace chez les patients atteints de LMC.
En revanche, le traitement combiné de l’imatinib ou d’un ITK de deuxième génération (nilotinib, dasatinib) avec l’interféron alpha pégylé (IFN) est très efficace. Une RM profonde est obtenue plus rapidement par la combinaison et chez beaucoup plus de patients que par les ITK seuls [3–5]. Dans des études non contrôlées, un traitement d’entretien par IFN après un traitement combiné préalable a également induit un taux élevé de TFR [6,7].
Objectifs thérapeutiques en phase chronique
L’objectif principal d’un traitement par ITK dans la LMC est d’obtenir le plus rapidement possible une rémission moléculaire qui doit être au moins de l’ordre de la MMR (MR3). Ceci est important car une rémission moléculaire profonde protège contre la progression de la maladie et normalise la survie globale avec la LMC [8–10].
L’objectif thérapeutique secondaire est l’obtention rapide d’une RM profonde (par ex. au sens d’une RM4, RM4,5 ou RM5), car cela permet l’inclusion dans des concepts d’arrêt des ITK.
Rémission sans traitement (“treatment free remission”, TFR)
A l’origine, le traitement par ITK de la LMC était conçu comme un traitement continu, car il est rapidement apparu que les inhibiteurs de BCR-ABL (imatinib, dasatinib, nilotinib) ne pouvaient pas éradiquer les cellules souches de la LMC [11,12].
Étonnamment, des rapports de cas cliniques et des études ultérieures (STIM, STIM-2, EURO-SKI) ont montré qu’environ 50% des patients traités par imatinib pendant de nombreuses années et ayant ainsi atteint une RM4,5 stable pouvaient arrêter l’imatinib sans subir de rechute moléculaire (réaugmentation de la charge de BCR-ABL ou perte d’un RMM) [13–17].
Jusqu’à présent, les mécanismes sous-jacents d’un TFR sont peu compris. Il n’existe donc pas actuellement de stratégies thérapeutiques éprouvées pour augmenter le taux de TFR. Cependant, on pense qu’il existe un contrôle immunologique des cellules LMC résiduelles par les lymphocytes T et les cellules NK. Les facteurs associés à un taux de TFR significativement plus élevé sont la durée du prétraitement par imatinib (plus de 5,8 ans) et la durée d’un MR4 (plus de 3,1 ans). Le nombre de cellules dendritiques plasmacytoïdes matures (CD86+pDC) et de cellules NK matures est un marqueur biologique potentiel associé à un taux de TFR plus élevé [18,19].
Concepts d’amélioration du taux de TFR
L’obtention d’une rémission sans traitement chez le plus grand nombre de patients possible est l’objectif ambitieux des concepts actuels de traitement de première ligne de la LMC (CML-V, Tiger) et des études d’arrêt (NAUT, ENDURE, INCEPTION).
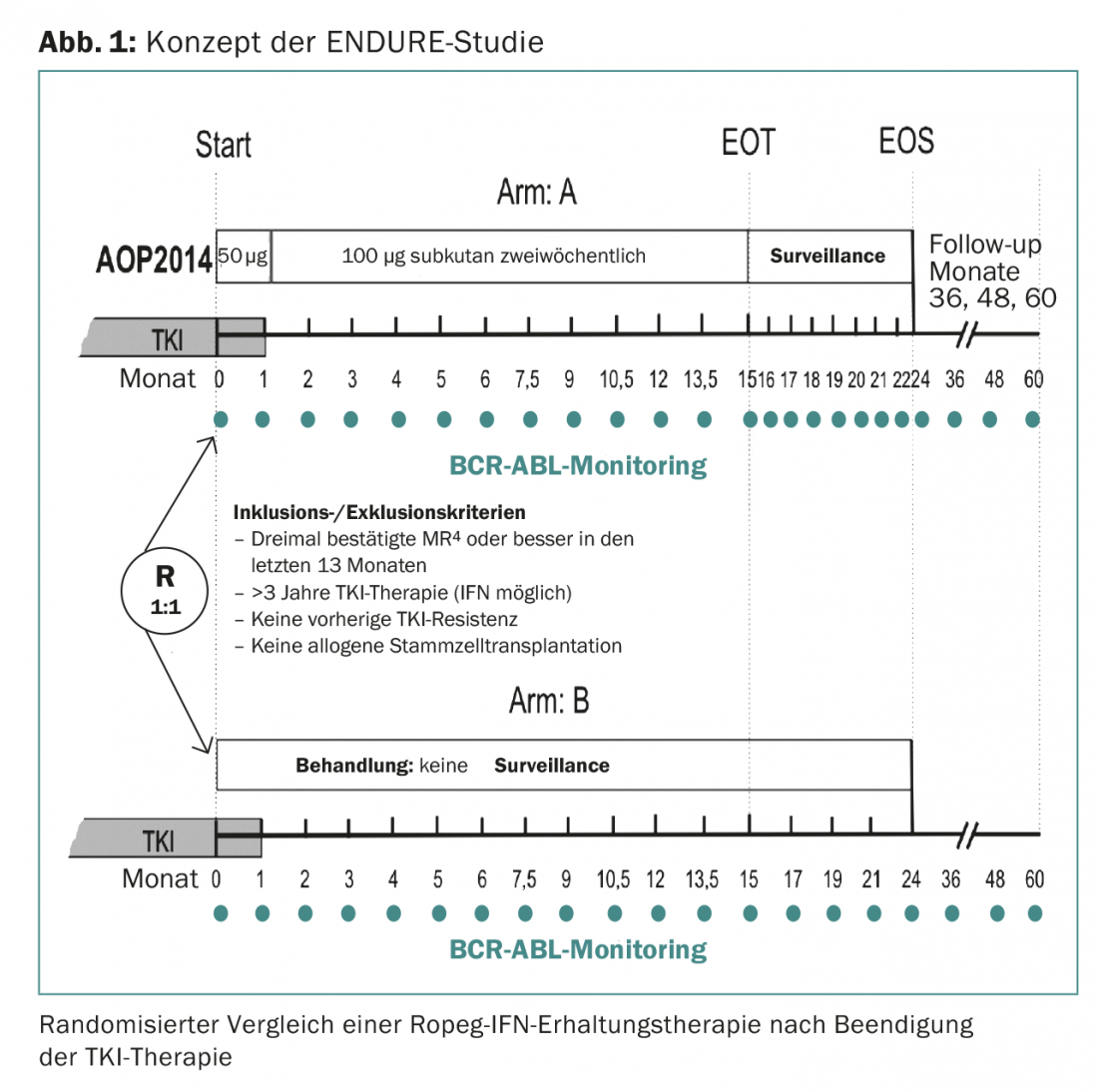
L’étude ENDURE, qui débutera prochainement dans 15 centres en Allemagne, testera chez 214 patients en RM profonde (au moins RM4) si un traitement d’entretien par IFN d’une durée de 15 mois peut réduire le taux de récidives moléculaires (figure 1). L’IFN utilisé est le Ropeg-IFN (AOP2014). Le Ropeg-IFN est un nouvel IFN dont la demi-vie est plus longue et qui est donc mieux toléré que les IFN pégylés disponibles jusqu’à présent. La préparation ne doit être injectée que tous les 14 jours.
Un autre concept thérapeutique innovant sera prochainement testé dans le cadre de l’étude INCEPTION. Dans ce cas, les patients sont randomisés pour recevoir les inhibiteurs de point de contrôle nivolumab et ipilimumab après l’arrêt des TKI – stratifiés selon le phénotype des cellules T exhaustives et le phénotype immunitaire pDC.
Perspectives
L’introduction des ITK comme traitement standard de la LMC a permis de normaliser la survie avec la LMC. L’objectif d’un futur traitement de la LMC est d’obtenir une RM profonde et une absence de traitement à long terme et sans danger pour le plus grand nombre de patients possible.
Littérature :
- Baccarani M, et al : European LeukemiaNet recommendations for the management of chronic myeloid leukemia : 2013. Blood 2013 ; 122 : 872-884.
- Cross NCP, et al : Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia. Leucémie 2015 ; 29 : 999-1003.
- Simonsson B, et al : Combination of pegylated IFN-α2b with imatinib increases molecular response rates in patients with low- or intermediate-risk chronic myeloid leukemia. Blood 2011 ; 118 : 3228-3235.
- Preudhomme C, et al : Imatinib plus peginterféron alfa-2a dans la leucémie myéloïde chronique. N Engl J Med 2010 ; 363 : 2511-2521.
- Nicolini FE, et al : Nilotinib et peginterféron alfa-2a pour la leucémie myéloïde chronique en phase chronique nouvellement diagnostiquée (NiloPeg) : une étude multicentrique, non randomisée, en phase 2, en ouvert. Lancet Haematology 2015 ; 2 : e37-e46.
- Burchert A, et al : Sustained molecular response with interferon alfa maintenance after induction therapy with imatinib plus interferon alfa in patients with chronic myeloid leukemia. J Clin Oncol 2010 ; 28 : 1429-1435.
- Burchert A, et al : L’interféron alpha 2 (IFN) maintenance therapy may enable high rates of treatment discontinuation in chronic myeloid leukemia (CML). Leukemia 2015 ; 29 : 1331-1335.
- Hehlmann R, et al : Deep Molecular Response Is Reached by the Majority of Patients Treated With Imatinib, Predicts Survival, and Is Achieved More Quickly by Optimized High-Dose Imatinib : Results From the Randomized CML-Study IV. J Clin Oncol 2014 Feb 10 ; 32(5) : 415-423.
- Hehlmann R, et al : Tolerability-adapted imatinib 800 mg/d versus 400 mg/d versus 400 mg/d plus interferon-α in newly diagnosed chronic myeloid leukemia. J Clin Oncol 2011 ; 29 : 1634-1642.
- Bower H, et al : Life Expectancy of Patients With Chronic Myeloid Leukemia Approaches the Life Expectancy of the General Population. J Clin Oncol 2016 ; 34 : 2851-2857.
- Graham SM, et al : Les cellules souches primitives, quiescentes, Philadelphia-positives de patients atteints de leucémie myéloïde chronique sont insensibles au STI571 in vitro. Blood 2002 ; 99 : 319-325.
- Jørgensen HG, et al : Le nilotinib exerce des effets antiprolifératifs équipotents à l’imatinib et n’induit pas d’apoptose dans les cellules CD34+ CML. Blood 2007 ; 109 : 4016-4019.
- Mahon FX, et al : Discontinuation of imatinib in patients with chronic myeloid leukaemia that have maintained complete molecular remission for at least 2 years : the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol 2010 ; 11 : 1029-1035.
- Rousselot P, et al : L’arrêt du mésylate d’imatinib chez les patients atteints de leucémie myélogène chronique en rémission moléculaire complète depuis plus de 2 ans. Blood 2007 ; 109 : 58-60.
- Rousselot P, et al : Perte de la réponse moléculaire majeure comme un déclencheur pour le redémarrage du traitement par inhibiteur de tyrosine kinase chez les patients atteints de leucémie myélogène chronique de phase chronique qui ont arrêté l’imatinib après une maladie indétectable durable. J Clin Oncol 2013 ; 32 : 424-430.
- Ross DM, et al. : Sécurité et efficacité de l’arrêt de l’imatinib pour les patients atteints de LMC avec une maladie résiduelle minimale stable et indétectable : résultats de l’étude TWISTER. Blood 2013 ; 122 : 515-522.
- Mahon FX, et al : Interim Analysis of a Pan European Stop Tyrosine Kinase Inhibitor Trial in Chronic Myeloid Leukemia : The EURO-SKI study. Blood 2014 ; 124 : 151.
- Ilander M, et al : Increased proportion of mature NK cells is associated with successful imatinib discontinuation in chronic myeloid leukemia. Leukemia 2016. DOI : 10.1038/leu.2016.360 [Epub ahead of print].
- Schütz C, et al : Expression of the CTLA-4 ligand CD86 on plasmacytoid dendritic cells (pDC) predicts risk of disease recurrence after treatment discontinuation in CML. Leukemia 2017. DOI : 10.1038/leu.2017.9 [Epub ahead of print].
InFo ONKOLOGIE & HÉMATOLOGIE 2017 ; 5(1) : 17-19