La stratégie de traitement est déterminée en fonction de l’âge et de l’état général du patient. Les patients plus jeunes et en bonne santé reçoivent un traitement intensif avec un traitement d’induction (au moins quatre cycles), suivi d’une chimiothérapie à haute dose/d’une transplantation autologue de cellules souches (planification précoce !) et, le cas échéant, d’un traitement de consolidation court ou d’un traitement d’entretien plus long. Les patients âgés reçoivent un traitement combiné incluant une nouvelle substance sur une période de 12 à 18 mois. En cas de récidive, de nouvelles substances peuvent être utilisées. Chez les jeunes patients, une nouvelle autogreffe ou, dans des cas sélectionnés, une allogreffe de cellules souches peut être discutée. Les patients doivent être surveillés pour les effets secondaires des médicaments et le traitement doit être adapté en temps utile.
Les recommandations du groupe de travail international sur le myélome (IMWG) concernant le diagnostic des maladies à cellules plasmatiques ont été modifiées l’année dernière [1].
Désormais, les patients présentant un myélome plasmocytaire à haut risque jusqu’à présent asymptomatique (évolution très probable vers un stade symptomatique dans un délai inférieur à deux ans) sont considérés comme nécessitant un traitement (tableau 1).

En pratique, cela signifie notamment qu’une IRM du corps entier est recommandée pour les patients sans lésion d’organe terminal (critères CRAB), mais avec 10-60% de plasmocytes et un quotient de chaînes légères de <100 (fig. 1). Il vaut la peine de demander au service de radiologie local si cet examen est possible. Comme on peut le voir sur l’illustration, les patients doivent être préparés de manière appropriée à l’examen.
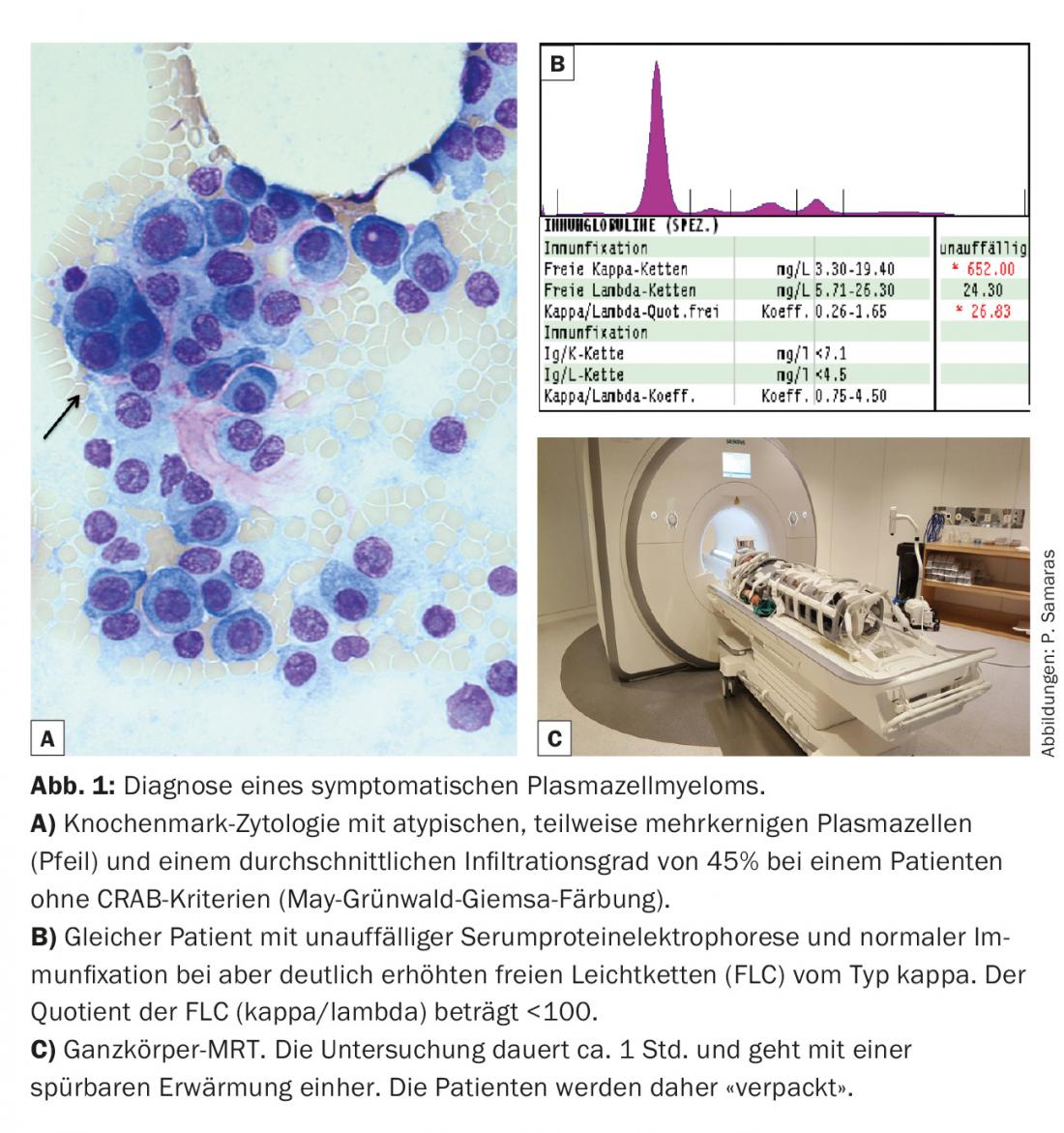
La valeur diagnostique de la concentration de chaînes légères libres (CLL) dans le sérum a également été renforcée (tableau 1). Dans les études, les FLC ont jusqu’à présent été mesurées exclusivement par le test FreeliteTM (The Binding Site). En ce qui concerne les critères CRAB, la restriction de la fonction rénale a été complétée par l’indication d’une clairance minimale de la créatinine. Formellement, seule l’altération de la fonction rénale due à la néphropathie de Cast définit le myélome, et non l’altération de la fonction rénale due, par exemple, à l’amylose AL ou à la maladie du dépôt de la chaîne légère (LCDD).
Le scanner et le PET-CT ont été ajoutés comme instruments de diagnostic possibles pour l’évaluation des ostéolyses. Le scanner est actuellement la méthode de choix pour le dépistage de l’ostéolyse.
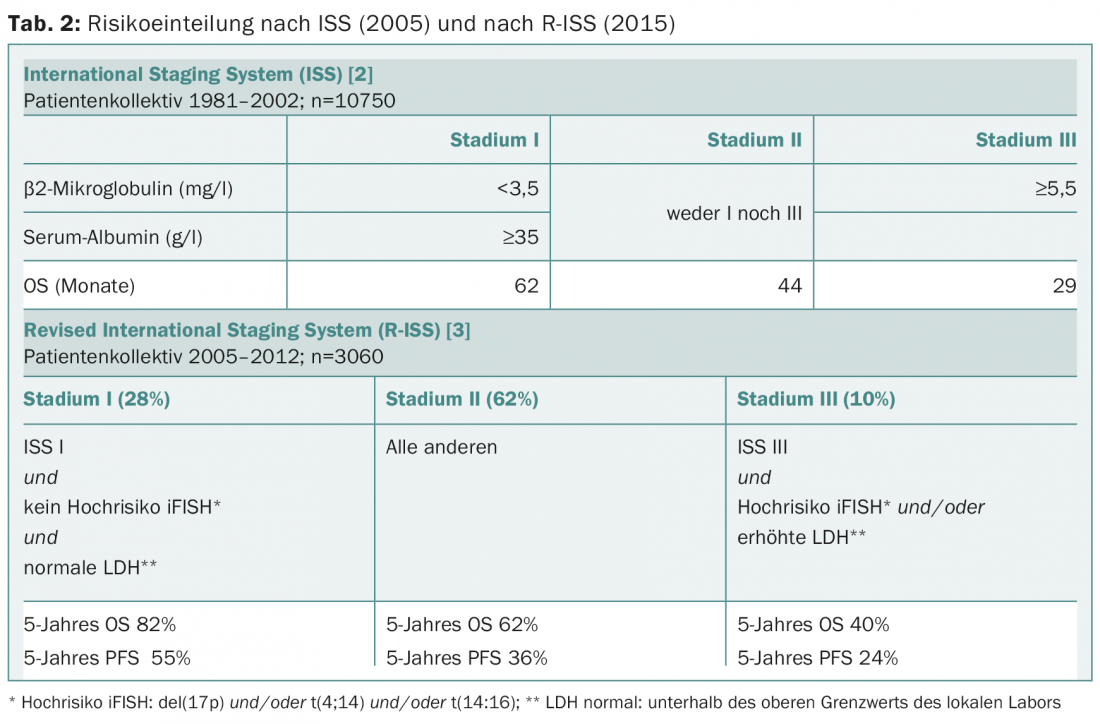
La stratification du risque a également été adaptée cette année, car la réponse au traitement s’est améliorée depuis la publication du score ISS il y a dix ans [2]. Le score ISS révisé (R-ISS) prend désormais en compte l’analyse iFISH et l’augmentation de la LDH (tableau 2) [3]. Le R-ISS est applicable à tous les patients, y compris les plus âgés (>65 ans) et ceux qui ne reçoivent pas de chimiothérapie à haute dose. Le R-ISS n’a pas encore été validé sur un collectif de patients supplémentaire, le suivi médian était d’un peu moins de quatre ans.
La fragilité est un facteur important pour l’évaluation de la capacité et de l’adaptation du traitement et du pronostic. Dans la pratique clinique quotidienne, nous utilisons généralement notre expérience clinique pour évaluer la fragilité, mais celle-ci peut également être évaluée de manière systématique, par exemple de manière analogue à la recommandation de l’IMW, à l’aide d’un outil en ligne (www.myelomafrailtyscorecalculator.net) [4]. Il existe également des recommandations sur la gestion du traitement en fonction de la condition physique, bien que cette approche soit basée sur des experts et n’ait pas encore fait l’objet d’études prospectives [5].
D’autres informations importantes sur le pronostic ne sont obtenues qu’au cours du traitement. Par exemple, l’obtention d’une réponse complète chez des patients de tous âges est associée à une amélioration de la survie globale et de la survie sans progression.
Traitement de première ligne par autogreffe de cellules souches
Si une indication thérapeutique existe, la première chose à faire est de déterminer si un traitement intensif par chimiothérapie à haute dose et transplantation de cellules souches autologues (HDCT/ASZT) est envisageable pour le patient.
Les patients éligibles pour cette stratégie de traitement intensif sont ceux qui ont moins de 65-75 ans et qui ne présentent pas de comorbidités graves. Pour évaluer l’éligibilité à la transplantation, il est possible de consulter, outre l’âge, différents scores de comorbidité orientés sur la clinique. Le traitement consiste généralement en un minimum de quatre à un maximum de six cycles de traitement d’induction, suivis d’une HDCT/ASZT, puis, en fonction de la réponse, d’un traitement de consolidation plus court et/ou d’un traitement d’entretien plus long.
L’induction doit inclure le bortézomib, un inhibiteur de protéase, et être composée de trois substances au total. Les combinaisons courantes en Europe sont bortézomib/cyclophosphamide/dexaméthasone (VCD) ou bortézomib/thalidomide/dexaméthasone (VTD) et aux États-Unis bortézomib/lénalidomide/dexaméthasone (VRD). S’il existe des contre-indications à l’utilisation du bortézomib, on peut utiliser à la place le lénalidomide, un immunomodulateur (IMiD) de 2e génération et une évolution du thalidomide, également en combinaison avec la dexaméthasone (Rd) et éventuellement en plus le cyclophosphamide comme troisième substance (RCD). Le lénalidomide n’étant pas encore autorisé en Suisse dans le cadre d’un traitement de première ligne, une demande de prise en charge par l’assurance maladie doit être faite au préalable. Il est important de prendre contact avec le centre de transplantation dès le début, juste avant ou juste après l’initiation du traitement d’induction, afin de pouvoir planifier à temps la collecte et la transplantation des cellules souches.
Depuis les années 90, la HDCT/ASZT est considérée comme le traitement standard pour les patients jeunes et en bonne santé [6]. La substance alkylante melphalan est alors administrée à une dose de 200 mg/m2 (MEL200). Chez les patients âgés de plus de 65 ans et/ou présentant des limitations physiques telles qu’un dysfonctionnement rénal, la dose est généralement réduite à 100 ou 140 mg/m2 (MEL100 ou MEL140). Comme le traitement est aujourd’hui principalement adapté à l’âge biologique plutôt qu’à l’âge calendaire, même les patients en bonne forme physique âgés de 65 à 70 ans peuvent encore recevoir une dose complète de MEL200, à condition qu’ils ne souffrent d’aucune limitation physique. En cas de réponse insuffisante après une HDCT/ASZT ou chez les patients présentant un profil de risque cytogénétique très défavorable (t(4;14), t(14;16) ou del(17p)), une nouvelle HDCT/ASZT avec du melphalan peut être réalisée à trois mois d’intervalle, dans le sens d’une transplantation dite en tandem, si la première a été bien tolérée par le patient.
Chez les patients qui n’ont pas obtenu une réponse complète après HDCT/ASZT, deux cycles de traitement supplémentaires peuvent être administrés en tant que traitement de consolidation. Dans ce cas, on utilise généralement la même combinaison de médicaments que pour l’induction, mais il est également possible d’utiliser une nouvelle classe de substances. L’indication d’un traitement d’entretien par un inhibiteur de protéase ou un IMiD pendant plusieurs années ou jusqu’à la progression doit être posée sur une base individuelle. En raison de l’agressivité de la maladie, les patients présentant une cytogénétique à haut risque se qualifient certainement pour cela. Actuellement, l’efficacité d’un inhibiteur oral de la préothéase de troisième génération, l’ixazomib, en tant que traitement d’entretien après ASZT est évaluée dans le cadre d’une grande étude internationale à laquelle participe également l’hôpital universitaire de Zurich (https://clinicaltrials.gov : NCT02181413).
Traitement de première ligne sans greffe de cellules souches
Chez les patients âgés qui ne sont pas éligibles pour une HDCT/ASZT, un traitement à base de bortézomib ou de lénalidomide en double ou triple combinaison doit être mis en place. Les combinaisons de médicaments courantes sont bortézomib/mélphalan/prednisone (VMP), lénalidomide/dexaméthasone (Rd) et bortézomib/dexaméthasone (Vd). La durée du traitement est déterminante pour obtenir une réponse profonde et donc durable. Elle doit être maintenue sur une période de 12 (VMP) à au moins 18 (Rd) mois. Il s’agit de surveiller de très près les effets secondaires limitant le traitement, tels que la polyneuropathie ou la fatigue, afin d’adapter à temps la dose de médicament ou de suspendre le traitement si nécessaire. En règle générale, le bortézomib ne doit être administré qu’une fois par semaine et par voie sous-cutanée, et la dose de dexaméthasone doit être limitée à un maximum de 10 mg par jour. 40 mg par semaine. De cette manière, il est possible d’éviter un arrêt précoce du traitement et d’augmenter ainsi l’efficacité du traitement [7].
Pour un aperçu des effets secondaires les plus fréquents, voir le tableau 3. Des indications sur l’adaptation de la dose chez les patients âgés sont disponibles dans la littérature [8].
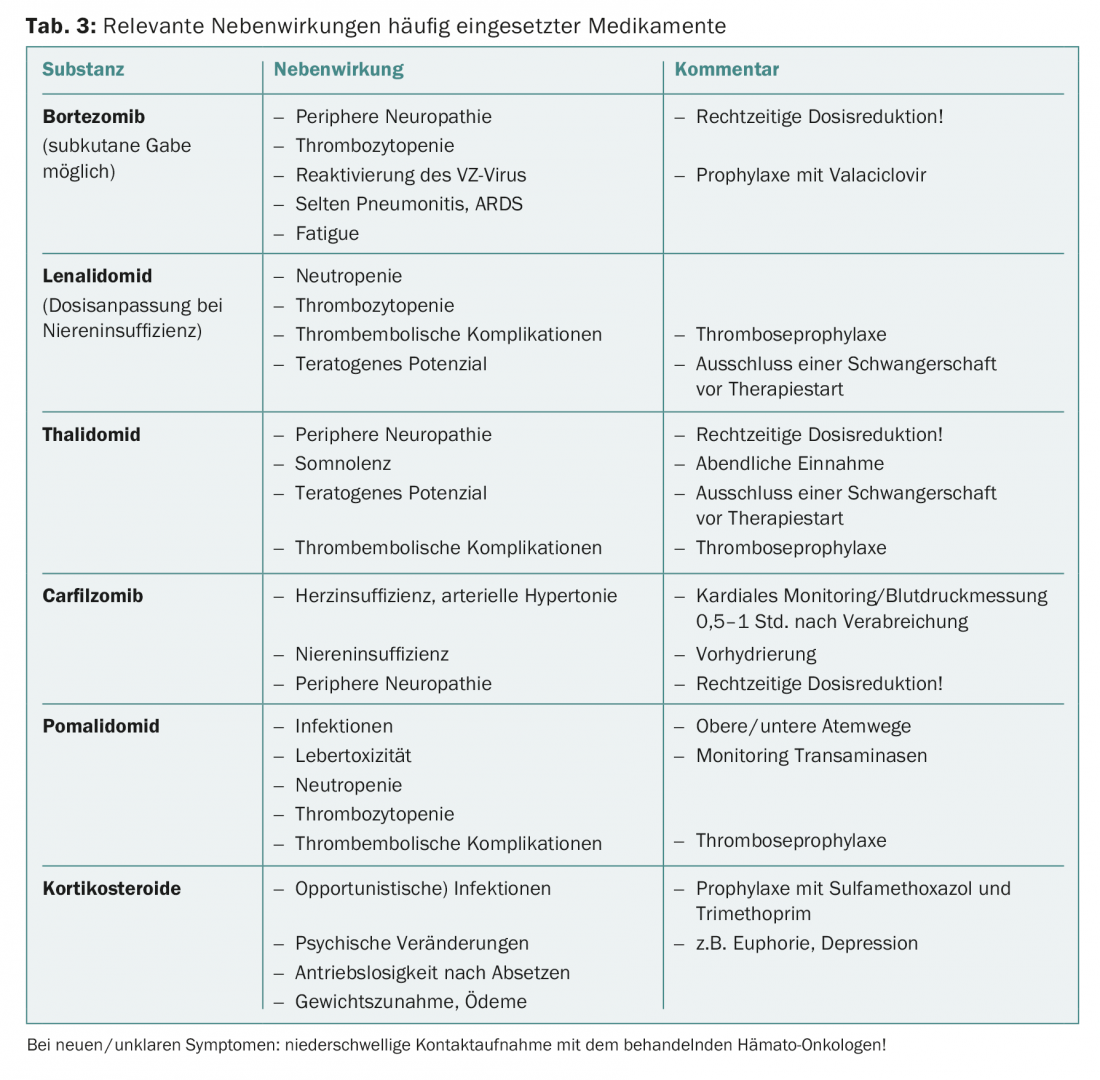
Tous les patients diagnostiqués avec un myélome plasmocytaire nécessitant un traitement devraient également recevoir un traitement antirésorptif à l’acide zolédronique, car cela a également permis de documenter une amélioration de la survie globale [9].
Deuxième et dernière ligne de traitement
En cas de progression symptomatique de la maladie, il s’agit à nouveau de la contrôler par un traitement efficace sur une période aussi longue que possible. Les patients plus jeunes éligibles à la transplantation qui n’ont pas reçu de HDCT/ASZT dans le cadre du traitement de première ligne devraient se la voir proposer en cas de récidive. Chez les patients qui n’ont pas progressé depuis au moins 18 mois après une HDCT/ASZT, une deuxième HDCT/ASZT peut être discutée comme traitement de rattrapage après un nouveau traitement d’induction. Un régime d’induction approprié est par exemple la triple combinaison bortézomib/doxorubicine/dexamathasone (PAD). Chez les jeunes patients présentant une récidive précoce après HDCT/ASZT (<18 mois) et/ou un profil de risque cytogénétique défavorable, la possibilité d’une transplantation de cellules souches allogéniques peut également être discutée avec le centre de transplantation en situation de récidive [10].
Chez les patients non transplantables, si la réponse au traitement de première ligne est bonne et que l’intervalle sans progression est long, les mêmes substances peuvent être utilisées dans le sens d’un “re-challenge”. Si l’intervalle sans progression est plus court, de nouvelles classes de substances doivent être utilisées, sinon une réponse tumorale durable ne peut être attendue. Les patients qui ont reçu initialement du bortézomib doivent être traités en deuxième ligne par le lénalidomide et vice versa. Pour les lignées ultérieures, d’autres substances nouvellement disponibles peuvent également être utilisées, par exemple la bendamustine, le pomalidomide (IMiD de troisième génération ) ou le carfilzomib (inhibiteur de protéase de deuxième génération ). Les résultats obtenus avec l’élotuzumab, le premier anticorps monoclonal disponible dans le commerce pour le traitement du myélome, en association avec le lénalidomide et la dexaméthasone, sont également prometteurs.
Des études expérimentales ont montré que le nelfinavir, un inhibiteur de la protéase du VIH, peut re-sensibiliser des cellules de myélome résistantes à des substances déjà administrées. Le Groupe suisse de recherche clinique sur le cancer (SAKK) teste actuellement cette approche dans deux études multicentriques chez des patients atteints de myélome plasmocytaire récidivant ou réfractaire. Le nelfinavir est associé au lénalidomide/dexaméthasone dans une étude (SAKK 39/10 ; https://clinicaltrials.gov : NCT01555281) et au bortézomib/dexaméthasone dans l’autre (SAKK 39/13 ; https://clinicaltrials.gov : NCT02188537). Pour plus de détails sur les résultats d’études disponibles et les recommandations thérapeutiques actuelles pour la Suisse, nous vous renvoyons également à une revue de la littérature récemment publiée [11].
Perspectives de nouveaux produits thérapeutiques
Ces derniers temps, il est de plus en plus souvent question, lors des congrès, de perspectives de guérison pour les patients atteints de myélome plasmocytaire. Les immunothérapies de différents types (IMiDe, thérapies par anticorps, inhibiteurs de points de contrôle, cellules CAR-T, “vaccins”, etc.) suscitent de l’espoir à cet égard. Aujourd’hui, le contrôle à long terme de la maladie est déjà une réalité, et de nombreux médicaments, dont certains ont de nouveaux mécanismes d’action, sont soit déjà approuvés par la FDA et l’EMA, soit au moins à un stade avancé d’essais cliniques. Cela vaut aussi bien pour le traitement de première ligne du myélome à cellules plasmatiques nouvellement diagnostiqué (NDMM) que pour le myélome à cellules plasmatiques récidivant ou réfractaire (RRMM) et le myélome à smoldering à haut risque.
Nouveaux inhibiteurs de protéase et IMiDe : quatre nouveaux inhibiteurs de protéase par voie intraveineuse et orale sont actuellement à l’étude dans les NDMM et RRMM. Parmi celles-ci, des données de phase III sont déjà disponibles pour le carfilzomib (i.v.) (ASPIRE), d’autres suivront, et des études de phase III sont également en cours pour l’ixazomib (p.o.) (TOURMALINE-MM1, -MM2, -MM3). Le pomalidomide est également à l’étude dans le cadre de nouvelles thérapies combinées efficaces.
les thérapies par anticorps : Les antigènes cibles les plus courants sont CD38, SLAMF7 (CS1), CD138 et BCMA. L’anticorps anti-CD38 daratumumab et surtout l’anticorps anti-CS1 elotuzumab ont déjà été très bien étudiés. Pour l’élotuzumab, qui doit être associé à d’autres médicaments pour être efficace, des données de phase III sont disponibles dans le RRMM (ELOQUENT-2). Les mêmes épitopes sur les plasmocytes peuvent également être utilisés pour les immunotoxines (conjugués anticorps-médicaments, par exemple l’indatuximab ravtansine) ou pour les cellules CAR-T. Les cellules CAR-T peuvent être utilisées pour le traitement de maladies infectieuses.
Autres classes de substances : Des données de phase III sont disponibles pour le panobinostat, un inhibiteur de HDAC, dans la RRMM (PANORAMA1). Des études sur des inhibiteurs spécifiques de HDAC6 (ricolinostat) sont en cours. Les inhibiteurs de points de contrôle (PD-1 et PD-L1) sont étudiés en combinaison avec d’autres immunothérapies stimulant les lymphocytes T, mais aucune efficacité n’a été constatée en monothérapie. En raison de la fréquence de la dérégulation du cyclineD dans le myélome, des substances qui interfèrent spécifiquement avec le cycle cellulaire sont à l’étude, comme les inhibiteurs de CDK (Seliciclib), les inhibiteurs du transport nucléo-cytoplasmique (inhibiteurs SINE, par exemple Selinexor) et les médicaments qui ciblent la protéine du fuseau kinésinique (par exemple Filanesib/Arry-520), pour ce dernier il existe également un biomarqueur (AAG). En outre, comme dans d’autres domaines de l’hématologie et de l’oncologie, il existe des approches visant à intervenir dans la transduction du signal (PI3K/AKT/mTOR, RAF/MEK/ERK, JAK/STAT, NFkB) et à inhiber les protéines anti-apoptotiques (Bcl-2, Bcl-xL) (par exemple au moyen d’ABT-199).
En raison de l’abondance des possibilités thérapeutiques, il sera surtout crucial à l’avenir de trouver la bonne combinaison et la bonne séquence de thérapies pour le bon patient.
Littérature :
- Rajkumar SV, et al : International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014 ; (12) : e538-548.
- Greipp PR, et al : Système international de staging pour le myélome multiple. J Clin Oncol 2005 ; 23(15) : 3412-3420.
- Palumbo A, et al : Système international de stadification révisé pour le myélome multiple : un rapport du groupe de travail international sur le myélome. J Clin Oncol 2015 ; 33(26) : 2863-2869.
- Palumbo A. et al : Geriatric assessment predicts survival and toxicities in elderly myeloma patients : An International Myeloma Working Group report. Blood 2015 ; 125(13) : 2068-2074.
- Larocca A, Palumbo A : Comment je traite les patients atteints de myélome fragile. Blood 2015.
- Attal M, et al : A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome. N Engl J Med 1996 ; 335(2) : 91-97.
- Palumbo A, et al : Autologous transplantation and maintenance therapy in multiple myeloma. N Engl J Med 2014 ; 371(10) : 895-905.
- Wildes TM, et al : Multiple myeloma in the older adult : better prospects, more challenges. J Clin Oncol 2014 ; 32(24) : 2531-2540.
- Terpos E, et al : International Myeloma Working Group recommendations for the treatment of multiple myeloma-related bone disease. J Clin Oncol 2013 ; 31(18) : 2347-2357.
- Giralt S, et al : American Society of Blood and Marrow Transplant, European Society of Blood and Marrow Transplantation, Blood and Marrow Transplant Clinical Trials Network et International Myeloma Working Group Consensus Conference on Salvage Hematopoietic Cell Transplantation in Patients with Relapsed Multiple Myeloma. Biol Blood Marrow Transplant 2015.
- Samaras P, et al : Statut actuel et recommandations mises à jour pour le diagnostic et le traitement du myélome à cellules plasmatiques en Suisse. Swiss Med Wkly 2015 : 145 : w14100.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(1) : 24-29