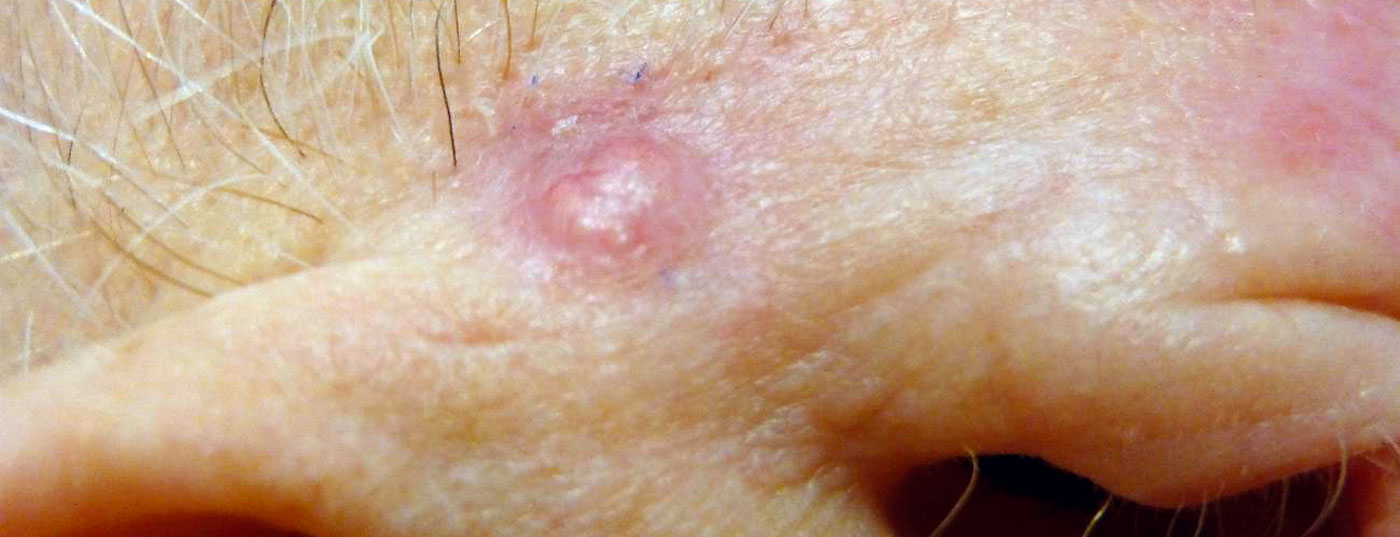
Un article de synthèse publié en 2024 dans la revue Cancer examine l’état actuel de la recherche sur les facteurs de risque des trois types de cancer de la peau les plus fréquents et présente des possibilités d’évaluation individualisée des risques. Outre une compilation des caractéristiques statistiques des mélanomes, des carcinomes basocellulaires et des carcinomes épidermoïdes, des scores de risque validés sont présentés.
Le cancer de la peau est la maladie maligne la plus fréquente dans le monde parmi les populations dont la peau est de type I-III (classification de Fitzpatrick). L’incidence du mélanome et du cancer de la peau non mélanocytaire (NMSC) a augmenté au cours des dernières décennies et continuera d’augmenter à l’avenir [1]. Le principal facteur de risque est l’exposition cumulée aux rayons ultraviolets (UV) [2]. Cependant, il est nécessaire de poursuivre les recherches afin de mieux comprendre les facteurs de risque individuels liés au cancer de la peau, comme base pour améliorer le dépistage et le traitement. Les preuves actuelles ne permettent pas de répondre clairement à la question de savoir si le dépistage du cancer de la peau sur le corps entier chez les personnes asymptomatiques est efficace au niveau de la population en termes de réduction de la morbidité et de la mortalité, selon les auteurs [1,3]. Ils proposent d’inclure le risque individuel des patients dans les recommandations de dépistage afin d’améliorer l’efficacité du diagnostic et du traitement du cancer de la peau [4].
Que sait la recherche épidémiologique ?
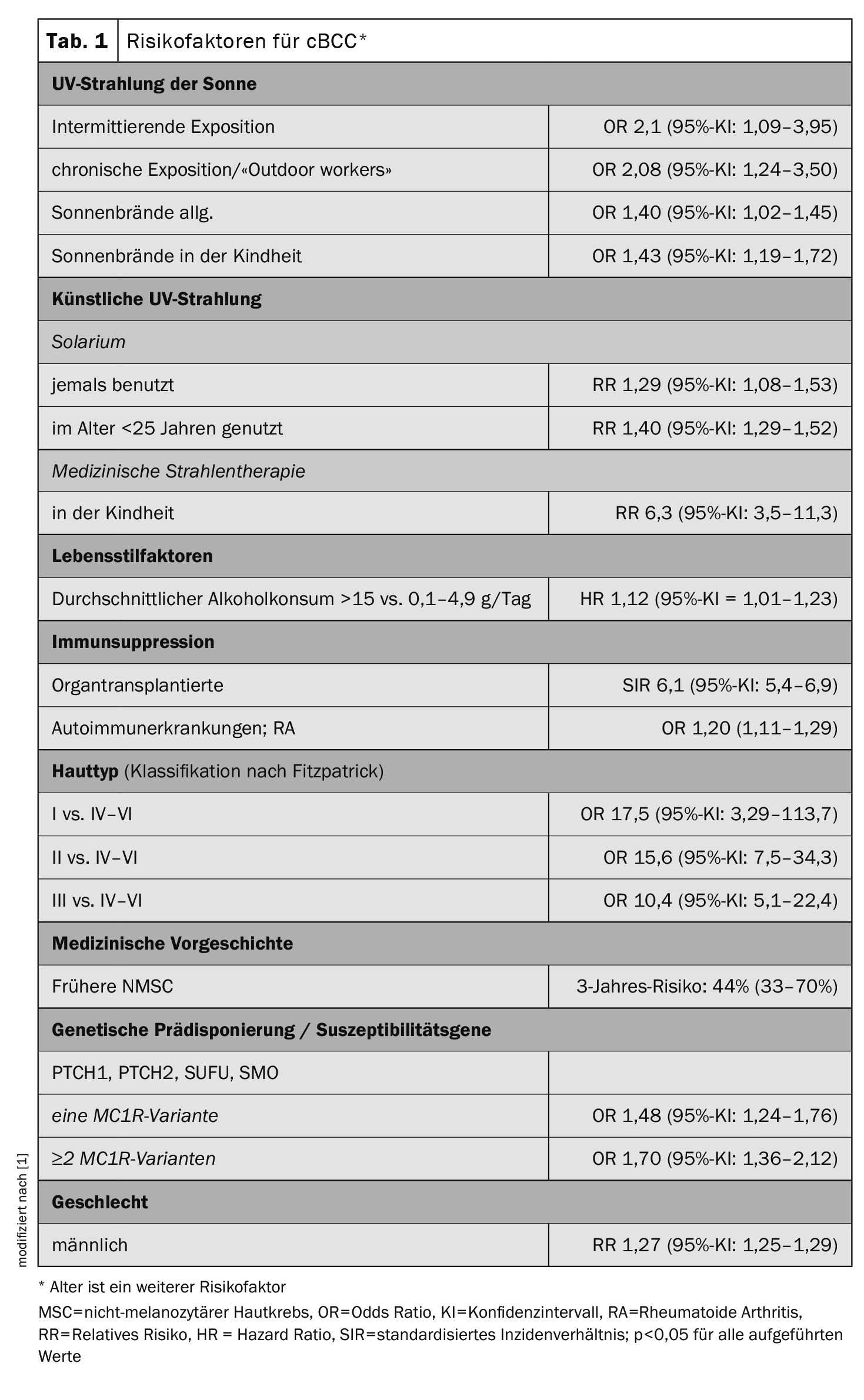
Les risques individuels de cancer de la peau sont liés à la fois à des facteurs environnementaux et comportementaux et à une prédisposition génétique. Les facteurs de risque spécifiques aux mélanomes, aux carcinomes basocellulaires cutanés ( cBCC) et aux carcinomes sp inocellulaires (c utaneous squamous cell carcinoma, cSCC) varient. Wunderlich et al. Dans leur article de synthèse, les auteurs abordent en détail les faits connus de la recherche épidémiologique et résument les principales conclusions pour ces trois formes les plus courantes de cancer de la peau [1]. Le titre complet de leur revue est “Risk Factors and Innovations in Risk Assessment for Melanoma, Basal Cell Carcinoma, and Squamous Cell Carcinoma”. La compilation des données basées sur des études épidémiologiques concernant l’odds ratio, le hazard ratio, le risque relatif et le rapport d’incidence standardisé pour les facteurs de risque de cBCC, présentée dans le tableau 1, est également disponible dans l’article original pour les deux autres types de cancer de la peau [1].
Les modèles de prédiction des risques comme base de la détection précoce ?
Les modèles de prédiction des risques visent à fournir une analyse complète qui prend en compte des facteurs tels que la prédisposition génétique, l’influence de l’environnement et les caractéristiques cliniques afin de déterminer plus précisément le risque de cancer de la peau. Plusieurs approches utilisent de vastes ensembles de données pour construire des modèles destinés à faciliter la détection précoce. Malheureusement, ces modèles ne sont souvent pas suffisamment validés et ne prennent pas en compte tous les facteurs de risque connus [5]. Certaines approches récentes tentent de surmonter ces problèmes.
Stratification du risque à l’aide de “23andMe” : Les auteurs du rapport d’incidence standardisé “23andMe” ont développé un score de risque de maladie validé sur la base d’un questionnaire et de données génétiques, qui pourrait être utilisé dans les programmes de dépistage. Le score de risque prend en compte 31 facteurs de risque. Ce score indépendant de l’âge prédit l’apparition de cancers de la peau (cBCC, cSCC, mélanomes) chez les personnes âgées de 30 ans et plus. Les participants du centile supérieur ont non seulement été diagnostiqués en moyenne 10 à 14 ans plus tôt que les participants ayant des scores moyens, mais ils présentaient également des formes plus graves et récurrentes de cancer de la peau. Le score obtenu et l’évolution du risque tout au long de la vie pourraient être utilisés dans les programmes de dépistage afin d’identifier les personnes asymptomatiques présentant un risque élevé de cancer de la peau et de prédire le moment où le risque de développer la maladie sera probablement le plus élevé [6].
Outil SUNTRAC : Les patients ayant subi une transplantation d’organe constituent un groupe de patients particulier. La NMSC est la maladie maligne la plus fréquente chez les receveurs de greffes d’organes solides et une cause majeure de morbidité et de mortalité [7,8]. Selon les auteurs, il est donc nécessaire de développer des scores de risque qui identifient les personnes particulièrement vulnérables. L’outil Skin and UV Neoplasia Transplant Risk Assessment Calculator (SUNTRAC) a été développé aux États-Unis pour faciliter l’identification des receveurs de greffes d’organes solides présentant un risque accru de cancer de la peau, en classant les patients en groupes de risque. Des scores pondérés ont été attribués aux facteurs de risque (ethnie blanche, antécédents de cancer de la peau, âge ≥50 ans, sexe masculin, transplantation thoracique), ce qui a permis d’obtenir un système à quatre niveaux. L’incidence cumulée sur 5 ans du développement d’un cancer de la peau était de 1,01%, 6,15%, 15,14% et 44,75% pour les catégories faible, moyenne, élevée et très élevée (SUNTRAC). L’instrument a fait l’objet d’une validation externe et a été testé pour son applicabilité dans des populations européennes, avec des résultats de discrimination pronostique similaires. Ce modèle pourrait contribuer à établir des priorités et à assurer un meilleur dépistage et un meilleur suivi pour ces patients, ainsi qu’à définir des directives de dépistage pour les transplantés d’organes [9,10].
En outre, l’utilité clinique de ces outils pour l’identification des personnes présentant un risque accru de cancer de la peau est actuellement évaluée de manière générale et les résultats ne sont pas encore disponibles.
ARN non codants (ARNnc) : les ARNnc sont des ARN qui ne sont pas transcrits en protéines. Seule la transcription de l’ADN a lieu, mais l’ARN continue à être traité. Il existe des preuves que les ARNnc régulent des voies tumorales importantes et jouent un rôle dans presque toutes les tumeurs humaines, y compris le cancer de la peau. Ces molécules d’ARN fonctionnelles, qui n’ont pas d’activité de codage des protéines, agissent au niveau transcriptionnel, post-transcriptionnel et épigénétique et sont impliquées dans la prolifération des cellules cancéreuses, l’angiogenèse, l’invasion et les métastases [11,12]. Il a été démontré que les ARNnc jouent un rôle crucial dans le diagnostic précoce, le pronostic et le traitement du mélanome [13,14].
Une méta-analyse récente a montré une sensibilité combinée des ARNnc longs dans le diagnostic du mélanome de 72,4%, avec une spécificité groupée de 81,2% et une aire sous la courbe (AUC) totale de 0,837. Dans les approches pronostiques, le HR pour la survie globale, la survie sans progression et la survie sans maladie était respectivement de 2,723 (IC à 95% : 2,259-3,283), 2,913 (IC à 95% : 2,050-4,138) et 2,760 (IC à 95% : 2,009-3,792) [14]. Ces résultats suggèrent que les ARNnc pourraient servir de biomarqueurs diagnostiques et pronostiques innovants qui pourraient améliorer le traitement des patients à l’avenir, selon les auteurs.
Littérature :
- Wunderlich K, et al.: Risk Factors and Innovations in Risk Assessment for Melanoma, Basal Cell Carcinoma, and Squamous Cell Carcinoma. Cancers (Basel). 2024 Feb 29; 16(5): 1016.
- Leiter U, Keim U, Garbe C: Epidemiology of Skin Cancer: Update 2019. Adv Exp Med Biol 2020; 1268: 123–139.
- Wolff T, Tai E, Miller T: Screening for skin cancer: An update of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2009; 150: 194–198.
- Navarrete-Dechent C, Lallas A: Overdiagnosis of Melanoma: Is It a Real Problem? Dermatol Pract Concept 2023; 13:e2023246.
- Usher-Smith JA, et al.: Risk prediction models for melanoma: A systematic review. Cancer Epidemiol Biomark Prev 2014; 23: 1450–1463.
- Fontanillas P, et al.: Disease risk scores for skin cancers. Nat Commun 2021; 12: 160. doi: 10.1038/s41467-020-20246-5.
- Friman TK, et al.: Cancer risk and mortality after solid organ transplantation: A population-based 30-year cohort study in Finland. Int J Cancer 2022; 150: 1779–1791.
- Garrett GL, et al.: Trends of skin cancer mortality after transplantation in the United States: 1987 to 2013. JAAD 2016; 75: 106–112.
- Jambusaria-Pahlajani A, et al.: Predicting skin cancer in organ transplant recipients: Development of the SUNTRAC screening tool using data from a multicenter cohort study. Transpl Int 2019; 32: 1259–1267.
- Gómez-Tomás Á, et al.: External Validation of the Skin and UV Neoplasia Transplant Risk Assessment Calculator (SUNTRAC) in a Large European Solid Organ Transplant Recipient Cohort. JAMA Dermatol 2023; 159: 29–36.
- Kaushik SB, Kaushik N: Non-coding RNAs in skin cancers: An update. Non-coding RNA Res 2016; 1: 83–86.
- Durante G, et al.: Non-coding RNA dysregulation in skin cancers. Essays Biochem. 2021; 65: 641–655.
- Hasan MN, et al.: Hypoxia-related Y RNA fragments as a novel potential biomarker for distinguishing metastatic oral melanoma from non-metastatic oral melanoma in dogs. Vet Q 2024; 44: 1–8.
- Masrour M, et al.: Long non-coding RNA as a potential diagnostic and prognostic biomarker in melanoma: A systematic review and meta-analysis. J Cell Mol Med 2024; 28:e18109. doi: 10.1111/jcmm.18109.
DERMATOLOGIE PRAXIS 2024; 34(3): 22–23