Actuellement, le rôle de l’imagerie dans le diagnostic de la maladie de Parkinson est principalement d’exclure les causes de parkinsonisme secondaire. Elle peut cependant, dans le contexte de la clinique, fournir des arguments en faveur de la présence de la maladie de Parkinson ou de syndromes parkinsoniens atypiques. Les développements récents visent à diagnostiquer correctement les patients individuels par imagerie dans un contexte clinique.
La maladie de Parkinson est le trouble moteur neurodégénératif le plus fréquent et la maladie neurodégénérative la plus fréquente après la maladie d’Alzheimer [1]. Il tient son nom du médecin anglais James Parkinson, qui a publié la première description détaillée de la maladie en 1817 [2].
Le diagnostic de la maladie de Parkinson est posé cliniquement, même s’il ne peut être définitivement confirmé qu’à l’histopathologie. En règle générale, il faut une combinaison de symptômes moteurs (rigidité, tremblements, bradykinésie) avec un début asymétrique des symptômes, une réponse à la L-dopa, une évolution progressive de plus de dix ans et l’exclusion d’autres causes de parkinsonisme [3, 4]. Cependant, dans les stades précoces, tous les symptômes ne sont souvent pas présents, et d’autres entités peuvent provoquer une symptomatologie chevauchante ; des études post-mortem ont montré qu’un pourcentage relativement élevé de diagnostics erronés de maladie de Parkinson était posé (76% de confirmation à l’autopsie [5]).
Les méthodes d’imagerie (à la fois morphologiques et fonctionnelles) ne peuvent pas aider à diagnostiquer la maladie de Parkinson par des signes spécifiques à la maladie, mais peuvent identifier d’autres causes de parkinsonisme ou étayer leur diagnostic. De nouvelles méthodes sont également utilisées pour tenter de diagnostiquer la maladie de Parkinson elle-même chez des patients individuels.
Imagerie en coupe
Le corrélat anatomo-pathologique de la maladie de Parkinson est la perte de cellules dopaminergiques dans la substantia nigra pars compacta (Fig. 1), qui ne se traduit toutefois que rarement par un rétrécissement de celle-ci à l’IRM. Le plus souvent, on ne constate qu’une atrophie non spécifique avec élargissement des espaces internes et externes du LCR. La valeur réelle de l’imagerie réside actuellement dans la possibilité d’exclure d’autres causes de la symptomatologie qui pourraient être traitées.
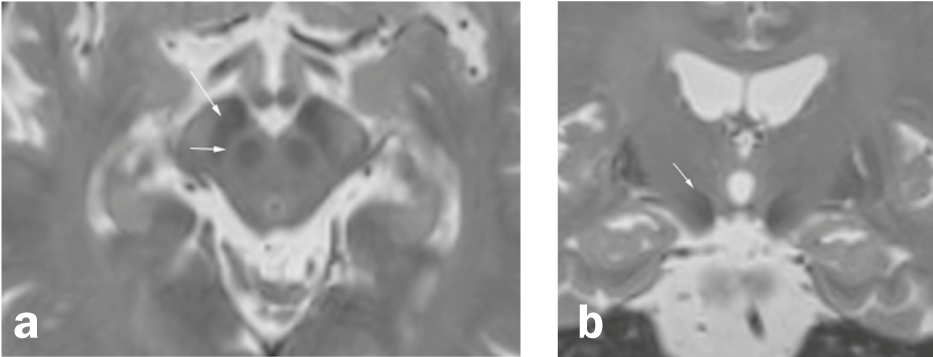
Fig. 1 Substantia nigra et ses environs
Axiale (a) et coronaire (b) Reconstruction d’une séquence pondérée en T2 3D haute résolution (IRM). a) La substance noire, située entre le nucleus ruber et les faisceaux de fibres du crus cerebri, est composée de deux couches, une zone hypo-intense dans la partie postérieure du crus cerebri (pars reticularis ; flèche longue) et une couche relativement hyper-intense (flèche courte) entre la pars reticularis et le nucleus ruber (mais les zones en pondération T2 ne correspondent pas exactement à la localisation anatomique). b) Le noyau sous-thalamique (flèche) est un noyau situé à la partie médiane de la capsule interne et à la partie supéro-latérale du nerf crânien. ruber et l’une des zones cibles de la stimulation cérébrale profonde dans la maladie de Parkinson.
Exclusion d’autres causes de parkinsonisme : les diagnostics différentiels d’une maladie de Parkinson incluent un syndrome parkinsonien secondaire d’étiologie toxique, métabolique ou vasculaire et un pseudo-parkinsonisme, par exemple en raison d’une hydrocéphalie à pression normale [6] ou d’un hématome sous-dural chronique, dont certains sont facilement détectables par scanner et/ou IRM (Fig. 2).
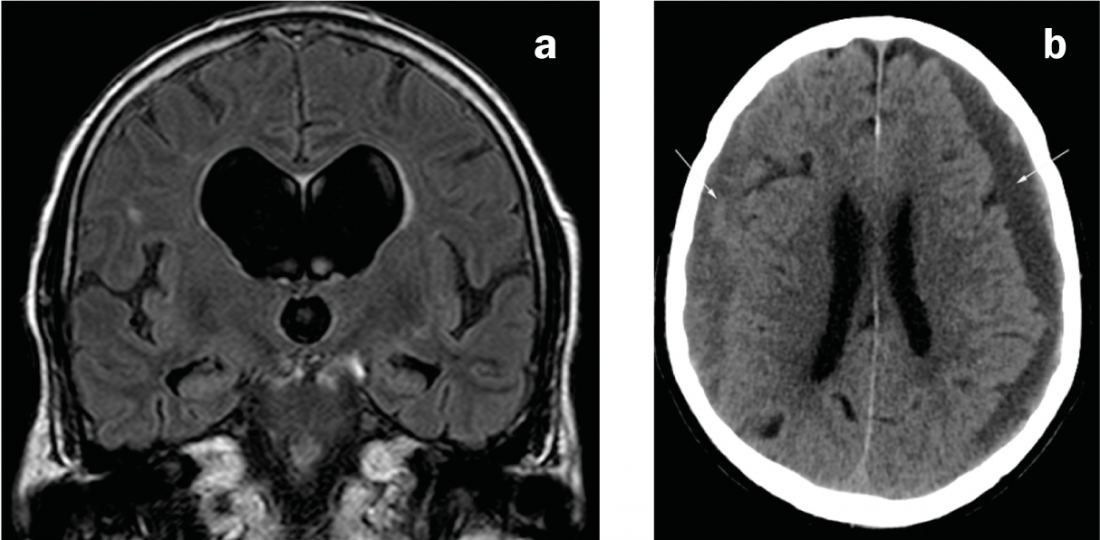
Fig. 2 : Causes du parkinsonisme secondaire
a) IRM coronaire en pondération FLAIR. Système ventriculaire disproportionnellement élargi par rapport aux espaces externes du LCR en cas d’hydrocéphalie à pression normale. b) CT axial. Hématomes sous-duraux bilatéraux d’âge mixte : à gauche principalement hypodense (c’est-à-dire chronique), à droite principalement isodense (c’est-à-dire subaiguë).
Exclusion d’un syndrome parkinsonien atypique : les syndromes parkinsoniens atypiques MSA (atrophie multisystémique), PSP (parésie visuelle supranucléaire progressive) et CBD (dégénérescence corticobasale ganglionnaire) font partie des diagnostics différentiels les plus difficiles à établir sur le plan clinique et radiologique. Les manifestations d’imagerie ne peuvent souvent être détectées qu’à des stades avancés.
Les signes de MSA-C (type cérébelleux) sont une atrophie du pons et du cervelet (y compris le brachium pontis) et le signal “hot cross bun” (hyperintensité cruciforme dans le pons sur les images axiales pondérées T2/FLAIR en raison de la dégénérescence des neurones pontiques et des connexions ponto cérébelleuses). (Fig. 3a et b). Le signe typique d’une MSA-P (type putaminal/parkinsonien, diagnostic différentiel avec la maladie de Parkinson en raison de la symptomatologie extrapyramidale) est une hypo-intensité du putamen dorsolatéral dans les séquences pondérées T2/T2* avec une bande hyper-intenses adjacente (“putaminal slit sign” en raison d’une perte de volume putaminal). (Fig. 3c). Les résultats décrits peuvent être observés dans tous les sous-types de MSA, mais les résultats infratentoriels sont plus fréquents dans le MSA-C que dans le MSA-P (et les résultats putaminaux sont à leur tour plus souvent décrits dans le MSA-P) [7].
La PSP se caractérise par une atrophie du mésencéphale (y compris les colliculi superiores) et du pédoncule cérébelleux supérieur, ce qui entraîne le signe du “pingouin” sur les images sagittales (le mésencéphale plat et l’arrondi préservé du pons sont censés entraîner une ressemblance avec la silhouette d’un pingouin avec une petite tête et un ventre rond). (Fig. 3d et e). Le gris périaquatique peut apparaître hyperintense en T2.
Les résultats de la DBC sont un rétrécissement du gyrus pré- et postcentral (Fig. 3f), une gliose sous-corticale avec une hyperintensité T2/FLAIR et une atrophie parasagittale saillante. L’atrophie des ganglions de la base peut être discrète.
Comme tous ces signes peuvent être très subtils et qu’il existe un certain chevauchement des résultats de toutes les pathologies mentionnées, on a essayé, à l’aide de différentes mesures (par ex. le diamètre et la surface du mésencéphale et du pons ou du pédoncule cérébelleux supérieur et médian) et d’indices, de définir des signes objectifs pour le diagnostic différentiel des différentes entités et de poser ainsi des diagnostics spécifiques au-delà des différences au niveau du groupe. Par exemple, le “MR-parkinsonian-index” [8] permet de distinguer une PSP possible ou probable de la maladie de Parkinson, de la MSA et des contrôles normaux.
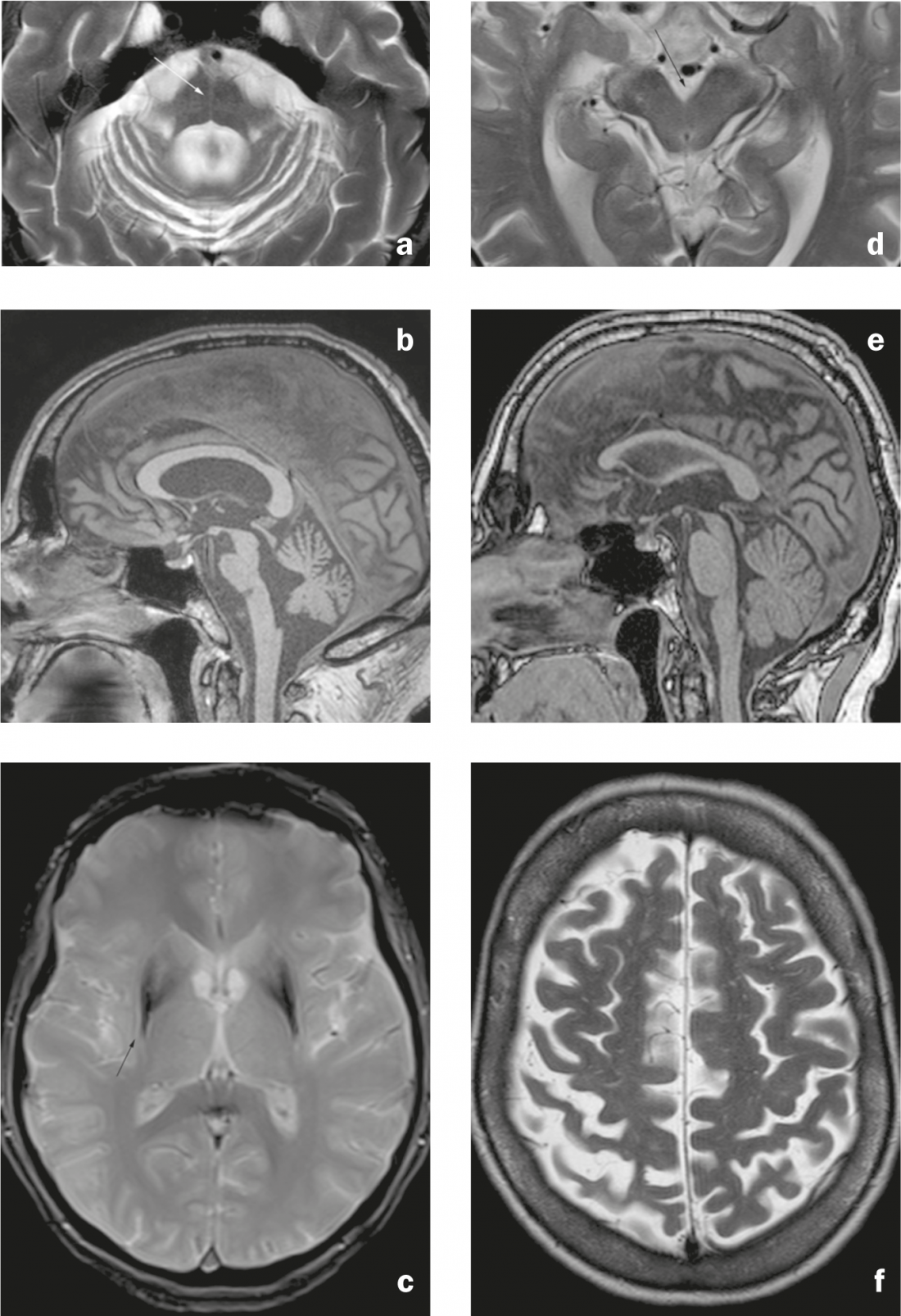
Fig. 3 : Syndromes parkinsoniens atypiques. MSA-C : a) Image axiale pondérée T2. Atrophie pontine et cérébelleuse avec signe “hot cross bun” (flèche), élargissement du quatrième ventricule et rétrécissement du brachium pontis. b) Image sagittale en pondération T1. Aplatissement du pons. MSA-P : c) Image axiale pondérée T2*. Hypo-intensité du putamen dorso-latéral avec hyper-intensité linéaire adjacente (flèche). PSP : d) Image axiale pondérée T2. Atrophie du mésencéphale avec élargissement de la citerne interpédonculaire. e) Image sagittale pondérée T1. Atrophie du mésencéphale, qui apparaît étroit par rapport au pons (signe du “pingouin” ou du “colibri”). CBD : f) Image axiale pondérée T2. Atrophie du gyrus précentral et du gyrus postcentral avec élargissement du sillon central (accentué à droite).
Nouveaux développements dans l’imagerie IRM : en plus de l’imagerie conventionnelle, des techniques IRM avancées telles que la “diffusion weighted imaging” (DWI), la “diffusion tensor imaging” (DTI) ou les séquences pondérées en fonction de la susceptibilité telles que T2* ou la “susceptibility weighted imaging” (SWI) sont étudiées en vue de différencier les patients atteints de la maladie de Parkinson des patients présentant des syndromes atypiques [9, 10]. De nouvelles séquences ou de nouvelles variantes de séquences existantes devraient permettre de détecter les modifications subtiles des très petites structures anatomiques affectées par la maladie de Parkinson à des stades plus précoces. Par exemple, la technique PADRE (“phase difference enhanced imaging” ; réalisée sur une IRM 3T) a permis de mettre en évidence un effacement de la frontière entre la substantia nigra et les faisceaux de fibres de la crus cerebri chez les patients atteints de la maladie de Parkinson [11], qui n’est pas détectable sur les séquences IRM conventionnelles.
De plus, à l’aide de techniques avancées d’analyse structurelle de la substance grise (“voxel based morphometry”, VBM) et de la substance blanche (“tract based spatial statistics”, TBSS) [12, 13], on essaie de mettre en évidence de faibles différences de signal à l’IRM, qui ne sont pas visibles par une analyse purement visuelle.
Imagerie préopératoire : outre l’exclusion des causes de parkinsonisme autres que la maladie de Parkinson, l’imagerie en coupe est utile pour la détermination préopératoire des cibles (globus pallidus et surtout nerf sous-thalamique) avant l’implantation d’électrodes pour une stimulation cérébrale profonde.
Méthodes de médecine nucléaire
Les méthodes de médecine nucléaire permettent de détecter un dysfonctionnement du système dopaminergique et sont utilisées dans la pratique clinique quotidienne comme test diagnostique supplémentaire dans les cas peu clairs. Ainsi, la disponibilité des transporteurs présynaptiques de la dopamine (DaT) ou l’activité de la dopa-décaroboxylase peuvent être étudiées au moyen de différents ligands en SPECT ou PET. En particulier, le “DaT-Scan” (le [123I]FP-CIT-SPECT) s’est répandu comme test pour les syndromes parkinsoniens peu clairs. Dans la maladie de Parkinson, on observe une diminution de la fixation des ligands(figure 4), ce qui permet de la distinguer du tremblement essentiel (mais pas avec certitude des syndromes parkinsoniens atypiques) [14].
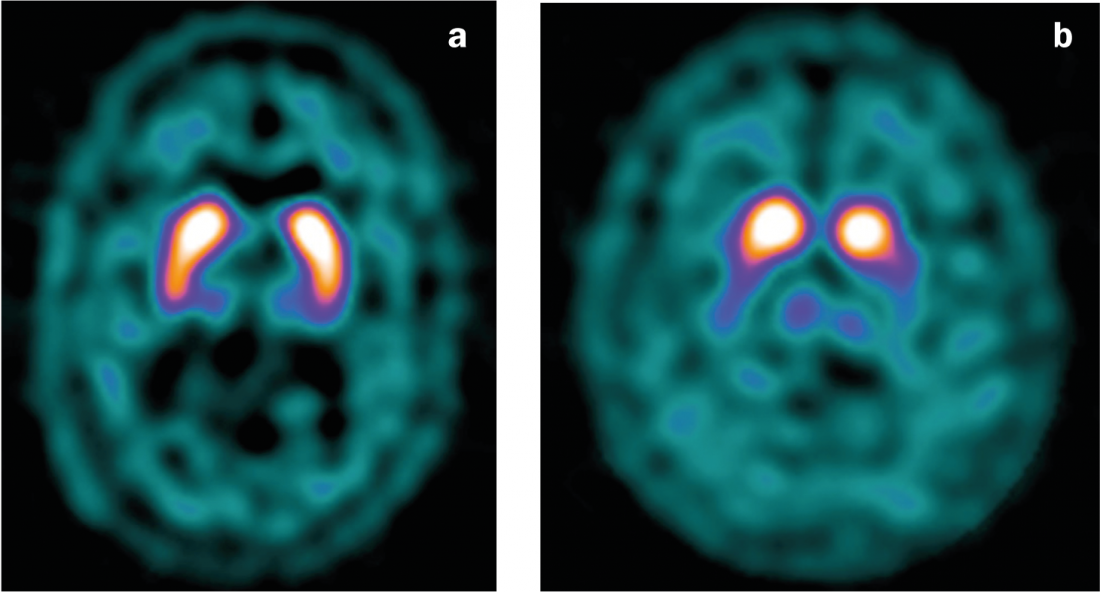
Fig. 4 : Balayage DaT
a) Résultat normal avec une liaison symétrique du ligand dans le striatum.
b) diminution de la fixation des ligands dans la maladie de Parkinson, en particulier du côté gauche (en cas de clinique essentiellement droite).
Méthodes de classification
Outre les analyses morphologiques décrites ci-dessus, de plus en plus d’analyses de classification sont entreprises pour améliorer le diagnostic chez les patients individuels. Celles-ci ne sont pas basées, comme les études de groupe, sur l’idée de comparer des groupes de patients à des sujets témoins sains afin de détecter les changements structurels liés à la maladie [15], dont les différences peuvent être significatives au niveau du groupe, mais pas assez prononcées au niveau individuel pour permettre un diagnostic dans la pratique clinique quotidienne. Ils ont plutôt pour objectif d’identifier ou de classer correctement les patients individuels. Les études de classification sont effectuées à l’aide d’analyses “support vector machine” de différentes données (par ex. séquences DTI ou SWI). Un classificateur “support vector machine” est une méthode d’analyse qui vise à classer les données en deux groupes ou plus (par ex. maladie de Parkinson/parkinsonisme atypique) sur la base de la reconnaissance de modèles. Pour ce faire, la première étape consiste à analyser des images traitées (c’est-à-dire transférées dans un espace standard, par exemple) à l’aide de différents algorithmes afin de déterminer les caractéristiques les plus discriminantes. Dans une deuxième étape, la sensibilité, la spécificité et la précision du classificateur obtenu sont testées sur un nouveau groupe de données [16]. Les résultats préliminaires de l’analyse des données DTI et SWI ont montré une précision de classification élevée pour les patients atteints de la maladie de Parkinson (vs. les patients présentant des symptômes atypiques de la maladie de Parkinson [12, 13]).
Bibliographie chez l’éditeur
Dr. med. Sven Haller
Dr. med. Isabelle Barnaure