Les mécanismes pathologiques de la dermatite atopique (DA) sont de mieux en mieux compris. Un déséquilibre immunologique d’origine génétique se caractérise par une réponse Th2 accrue et s’accompagne de la production de cytokines inflammatoires telles que l’interleukine (IL)-4 et l’IL-13. Il existe en outre d’autres molécules qui jouent un rôle important dans le processus inflammatoire. Le paysage thérapeutique est en pleine mutation. Actuellement, deux médicaments biologiques et trois inhibiteurs de Janus kinase sont autorisés dans le domaine d’indication de la MA en Suisse et d’autres sont en cours de développement.
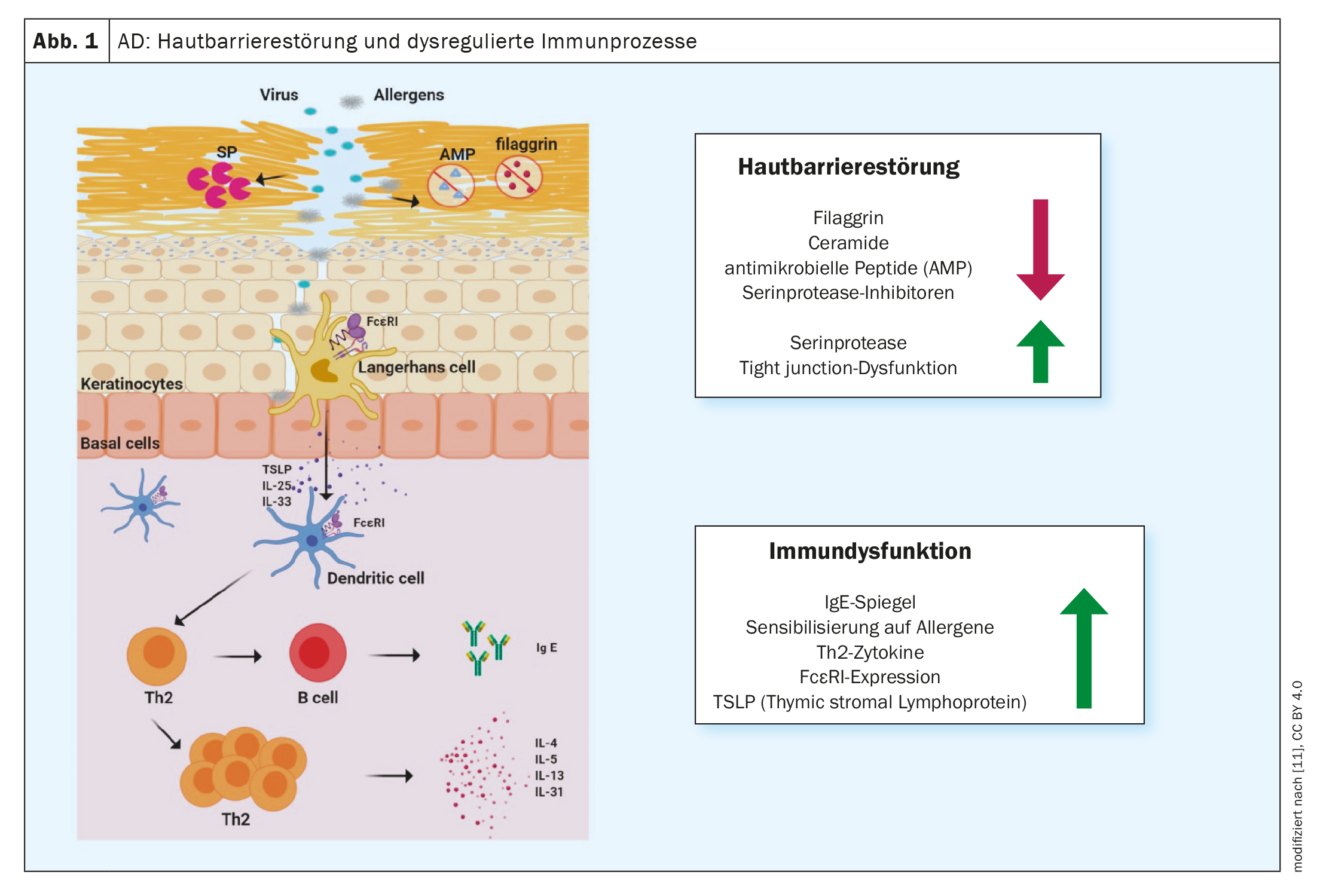
L’inflammation de type 2 est une cause commune à plusieurs maladies allergiques – outre la dermatite atopique (DA), l’asthme bronchique, la rhinosinusite chronique, l’œsophagite à éosinophiles et la rhinite allergique en font partie [1]. Des traitements de plus en plus efficaces sont développés pour lutter contre les maladies allergiques. Les anticorps monoclonaux et les inhibiteurs de la Januskinase (JAK) ont contribué de manière significative à l’amélioration des possibilités de traitement, a souligné le professeur Peter Schmid-Grendelmeier, expert en allergie, Clinique dermatologique, Hôpital universitaire de Zurich, dans le cadre du congrès annuel de la Société suisse d’allergologie et d’immunologie [2]. Cette évolution encourageante a été précédée d’une recherche intensive sur les processus physiopathologiques. Comme nous le savons aujourd’hui, une réponse immunitaire T-Helfer (TH)2 dominante est associée à la sécrétion de cytokines telles que l’interleukine (IL)-4, l’IL-5 et l’IL-13 (figure 1). Cet environnement inflammatoire favorise non seulement la génération, la maturation et l’activation des granulocytes éosinophiles et basophiles, mais également l’activation des mastocytes [3].
Bases moléculaires des réactions immunitaires de type 2
Dans certains cas, les maladies allergiques sont également comorbides – par exemple, certains patients souffrent d’asthme sévère ou de DA et ont également une rhinite allergique. De telles comorbidités peuvent encore alourdir la charge de morbidité. L’inflammation de type 2 est entretenue par TH2, les cellules lymphoïdes innées de type 2 (ILC2) et les médiateurs du système immunitaire inné et adaptatif [1]. Des études empiriques montrent que 58-79% des patients adultes atteints de la DA souffrent d’au moins une autre maladie atopique, indépendamment du degré de gravité [4–6].
Les réactions immunitaires de type 2 constituent le corrélat cellulaire de l’inflammation de la peau dans la MA et influencent également de manière significative la fonction de barrière et la dysbiose microbienne [7]. “Nous savons désormais beaucoup de choses sur la dermatite atopique”, a résumé le conférencier. Il y a quelques années, il s’agissait simplement d’un ‘nice to know’, mais aujourd’hui, la compréhension croissante des relations physiopathologiques a donné naissance à plusieurs options thérapeutiques immunomodulatrices innovantes. Contrairement aux médicaments biologiques, les inhibiteurs de Janus kinase (JAK) ne captent pas les signaux des cytokines dans l’espace extracellulaire, mais dans l’espace intracellulaire.
Les médicaments biologiques et les inhibiteurs JAK gagnent du terrain
En 2019, le premier médicament biologique approuvé dans l’indication de la MA a été le dupilumab (Dupixent®). Il s’agit d’un anticorps monoclonal dirigé contre la sous-unité α du récepteur de l’IL-4, qui bloque les signaux des médiateurs de l’inflammation IL-4 et IL-13 [8,9]. Cette approche thérapeutique s’est avérée très efficace, selon le professeur Schmid-Grendelmeier. Depuis 2022, un autre médicament biologique est disponible pour les patients atteints de la MA : le tralokinumab (Adtralza®), qui neutralise spécifiquement l’IL-13 [8]. Bien qu’à l’heure actuelle, les preuves dans le monde réel soient moins nombreuses que pour le dupilumab, les preuves d’efficacité ont été très convaincantes jusqu’à présent.
Les inhibiteurs de JAK constituent une autre approche thérapeutique prometteuse. En Suisse, trois inhibiteurs JAK, le baricitinib (Olumiant®), l’abrocitinib (Cibinqo®) et l’upadacitinib (Rinvoq®) ont récemment franchi l’obstacle de l’autorisation de mise sur le marché dans le domaine d’indication de la MA [8]. Les inhibiteurs de JAK agissent via le mécanisme intracellulaire JAK-STAT.
| Les agents biologiques, sous forme d’anticorps ou de protéines de fusion, bloquent une cytokine unique au niveau extracellulaire, ou un récepteur de cytokine ou une molécule de surface sur la cellule, alors que les JAK-i agissent au niveau intracellulaire et modulent différentes cytokines. Contrairement aux médicaments biologiques, l’objectif des JAK-i est de réduire de manière réversible l’activité d’une ou plusieurs isoformes de JAK, un peu comme si l’on baissait le thermostat. L’effet est donc plus large et moins spécifique. |
| vers [12] |
Décision thérapeutique basée sur des critères
“Un agent biologique s’adresse à une ou deux cytokines et les bloque plus ou moins complètement. Un JAK-i, en revanche, réduit plusieurs cytokines avec des affinités différentes. Il existe des pour et des contre pour les deux approches”, a expliqué le professeur Schmid-Grendelmeier [2]. Le choix de chaque option thérapeutique doit être adapté individuellement aux patients en tenant compte d’aspects tels que les maladies associées, le statut infectieux et l’âge. Des facteurs situationnels peuvent également entrer en ligne de compte ; par exemple, les JAK-i ont tendance à agir plus rapidement, mais nécessitent, contrairement aux médicaments biologiques, des examens de dépistage relativement étendus et un suivi en laboratoire parallèlement au traitement [10]. Une autre différence importante pour la vie quotidienne des patients concerne la forme d’administration : le baricitinib, l’abrocitinib et l’upadacitinib sont administrés par voie perorale sous forme de comprimés une fois par jour, tandis que les agents biologiques dupilumab et tralokinumab sont administrés sous forme d’injections à intervalles de quelques semaines ou mois. La version actualisée du guide S3 reflète désormais l’éventail élargi des traitements de la MA. Alors que le dupilumab était déjà inclus dans la version précédente de la ligne directrice, le tralokinumab, l’abrocitinib, le baricitinib et l’upadacitinib sont désormais également abordés [9].
Conclusion et perspectives
Selon le conférencier, les nouvelles possibilités de traitement représentent un grand progrès pour les patients présentant un degré de sévérité élevé de la MA [2]. Mais il y a encore beaucoup de recherches à faire, a-t-il ajouté. En Suisse, le dupilumab est à ce jour le seul représentant des groupes de médicaments systémiques récents (biologiques, JAK-i) à avoir obtenu une extension d’indication pour les patients AD pédiatriques âgés de 6 ans et plus. Le tralokinumab est autorisé en Suisse à partir de 18 ans et dans l’UE à partir de 12 ans. Pour les JAK-i, l’autorisation de mise sur le marché est jusqu’à présent limitée aux patients adultes. Mais cela pourrait changer dans un avenir pas trop lointain, d’autant plus que l’utilisation de plusieurs médicaments biologiques et JAK-i est actuellement à l’étude chez les patients AD pédiatriques.
En outre, d’autres substances actives avec de nouvelles cibles font actuellement l’objet de recherches. Le lébrikizumab, le némolizumab, le tezelumab et l’Ox-40-Ak se sont révélés être des candidats médicaments prometteurs jusqu’à présent [2]. Le lébrikizumab se lie spécifiquement à l’IL-13 circulant librement et le némolizumab bloque la sous-unité α du récepteur de l’IL-31. Le tezelumab est un anticorps dirigé contre la TSLP (Thymic stromal lymphoprotein) et l’Ox-40 est un récepteur costimulateur sur les cellules T activées.
Pour les patients atteints de MA modérée à sévère, l’élargissement des options de traitement offre de meilleures chances de guérison, à condition que l’accès aux thérapies soit possible. Les soins de base avec émollients et l’éducation des patients restent des piliers importants du traitement de la MA, quel que soit son degré de gravité [2]. Dans le cadre des formations sur la dermatite atopique, les patients reçoivent de nombreuses informations et conseils précieux pour la gestion de la maladie.
Congrès : Swiss Society for Allergology and Immunology (SSAI), Congrès annuel
Littérature :
- Klimek L, et al : Inflammation de type 2 : place de différents médicaments biologiques dans la pratique. Dtsch Arztebl 2021 ; 118(50) : [20]; DOI : 10.3238/PersPneumo.2021.12.17.05
- “Novel concepts in Allergy”, Prof. Peter Schmid-Grendelmeier, Congrès annuel de la SSAI, 24-25.08.2023.
- Kühn M, et al : Réponse immunitaire TH2 : importance et influence thérapeutique. Swiss Med Forum 2021 ; 21(0102) : 13-17.
- Weidinger S, et al : Dermatite atopique. Nat Rev Dis Primers 2018 ; 4(1) : 2.
- Chiesa Fuxench ZC, Ong P : Poster présenté à l’AAD 2018. Affiche 6236.
- Drucker AM, et al : The Burden of Atopic Dermatitis : Summary of a Report for the National Eczema Association. J Invest Dermatol 2017 ; 137(1) : 26-30.
- Lauffer F, Biedermann T : Eczéma atopique : feu perturbateur pour une relation triangulaire. Dtsch Arztebl 2021 ; 118(24) : [24]; DOI : 10.3238/PersDerma.2021.06.18.04
- Swissmedic : Information sur les médicaments, www.swissmedicinfo.ch,(dernière consultation 15.11.2023)
- S3-Leitlinie “Atopische Dermatitis”, AWMF-Register-Nr. : 013-027, Stand 17/06/2023.
- Worm M, et al : Traitement moderne de la dermatite atopique : médicaments biologiques et à petites molécules. JDDG 2020 ; 18(10) : 1085-1093.
- Yang G, et al : Anomalies de la barrière cutanée et dysfonctionnement immunitaire dans la dermatite atopique. International Journal of Molecular Sciences 2020 ; 21(8) : 2867.
www.mdpi.com/1422-0067/21/8/2867,(dernier appel 15.11.2023) - Choy EH : Signification clinique de la sélectivité de l’inhibiteur de la kinase Janus. Rhumatologie (Oxford) 2019 ; 58(6) : 953-962.
DERMATOLOGIE PRAXIS 2023 ; 33(6) : 22-23 (publié le 12.12.23, ahead of print)