Selon la classification actuelle, l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF) est caractérisée par une fraction d’éjection du ventricule gauche (FEVG) de l’ordre de ≤40%, l’insuffisance cardiaque à fraction d’éjection préservée (HFpEF) par une FEVG de l’ordre de ≥50%. Sur le plan thérapeutique, cette différenciation fait une grande différence !
L’insuffisance cardiaque (IC) ne constitue pas un diagnostic isolé, mais un syndrome clinique causé par l’incapacité du cœur à répondre aux besoins physiologiques des organes du corps. Cela se traduit soit par des systèmes de surcharge volumique, tels que la dyspnée, le gonflement des chevilles, la fatigue et les signes cliniques de surcharge volumique, soit par un faible débit cardiaque ou les deux, en raison d’une anomalie structurelle et/ou fonctionnelle du cœur. Les facteurs de risque incluent un mode de vie sédentaire, l’obésité, l’hypertension, le tabagisme, la consommation excessive d’alcool ainsi que la dyslipidémie, le diabète ou une maladie coronarienne (MC). Qui peuvent être modifiées par des changements de style de vie, un traitement médical optimal de l’hypertension, du diabète et de la dyslipidémie, ainsi que des vaccinations préventives.
L’hypertension est l’un des principaux facteurs de risque
L’hypertension artérielle, en particulier, est l’un des principaux facteurs de risque de développement de l’HF. Deux tiers des patients atteints d’HF en souffrent, et jusqu’à 90% des patients atteints d’HFpEF. Toutefois, l’hypertension non contrôlée chez les patients traités par un traitement médical optimal de la FC est plutôt rare en raison du chevauchement entre les médicaments de la FC et ceux de l’hypertension. Les objectifs tensionnels optimaux sont inconnus à ce jour, tant pour l’HFrEF que pour l’HFpEF, c’est pourquoi des objectifs individuels sont généralement pris en compte en tenant compte de l’âge et des maladies associées (diabète, maladies rénales, maladie coronarienne, valvulopathie, accident vasculaire cérébral). Néanmoins, la règle générale est la suivante : en cas d’HFrEF, il faut viser des valeurs cibles pour les médicaments fondés sur des preuves, malgré une légère hypotension ; inversement, en cas d’HFpEF avec hypertrophie ventriculaire gauche et réserve de précharge limitée, il faut éviter l’hypotension.
En outre, le diagnostic d’insuffisance cardiaque nécessite la présence de symptômes et/ou de signes de FC, ainsi que des preuves objectives d’un dysfonctionnement cardiaque, telles que l’essoufflement, la fatigue et le gonflement des chevilles. Si elles sont disponibles, les tests diagnostiques suivants sont recommandés pour l’évaluation des patients suspectés d’HF chronique : L’électrocardiogramme (ECG) peut révéler des anomalies telles que la fibrillation auriculaire, les ondes Q, l’hypertrophie du VG (HVG) et un complexe QRS élargi, qui augmentent la probabilité d’un diagnostic de FH et peuvent également guider le traitement. Si disponible, il est recommandé de mesurer les peptides natriurétiques (NP). Une concentration plasmatique du peptide natriurétique de type B (BNP) <35 pg/ml, du peptide natriurétique N-terminal de type Pro-B (NT-proBNP) <125 pg/ml ou du peptide natriurétique auriculaire de région moyenne (MR-proANP) <40 pmol/L68 rend le diagnostic d’ES peu probable. Des examens de base tels que l’urée et les électrolytes sériques, la créatinine, l’hémogramme complet et les tests de la fonction hépatique et thyroïdienne sont recommandés pour différencier l’HF d’autres maladies, pour fournir des informations pronostiques et pour orienter un éventuel traitement. L’échocardiographie est l’examen le plus important recommandé pour évaluer la fonction cardiaque. Outre la détermination de la FEVG, l’échocardiographie fournit également des informations sur d’autres paramètres tels que la taille des ventricules, l’HVG excentrique ou concentrique, les anomalies régionales des mouvements de la paroi (qui peuvent indiquer une maladie coronarienne sous-jacente, un syndrome de Takotsubo ou une myocardite), la fonction du VR, l’hypertension pulmonaire, la fonction valvulaire et les marqueurs de la fonction diastolique.
L’insuffisance cardiaque peut survenir indépendamment de la fraction d’éjection du VG
Les causes de l’HF peuvent être diverses, mais les cardiomyopathies ischémiques sont relativement fréquentes. L’HF ischémique est causée par des problèmes de circulation sanguine dans le cœur, par exemple à la suite d’une maladie coronarienne. La question cruciale lors du premier diagnostic d’HF est donc toujours de savoir s’il s’agit d’une maladie coronarienne non diagnostiquée auparavant. Pour répondre à cette question, un test d’ischémie non invasif, comme l’IRM de stress, est souvent utilisé. Il s’agit d’une méthode complète permettant d’évaluer la fonction globale et régionale, de déterminer s’il y a déjà eu une ischémie ou un infarctus du myocarde et de caractériser les tissus (œdème du myocarde, zone à risque, thrombus ventriculaire, cardiomyopathie). La sensibilité pour détecter un infarctus est de 94-99% ; la sensibilité pour l’ischémie est de 91% et la spécificité pour l’ischémie est de 83%. En présence d’une IRM de stress positive ou ambiguë, avec détection d’une ischémie pertinente (≥10%) ou de motifs de FC ischémiques, l’étape suivante est l’angiographie invasive. Le résultat confirme l’HF ischémique et nécessite une angioplastie coronarienne transluminale percutanée (ACTP) ou un pontage aorto-coronarien (PAC), ou démontre une coronaropathie de type Bystander. En cas d’IRM de stress non concluante, avec une ischémie limitée (<10%), nachweislich kleinen Infarkten oder sehr jungen Patienten, sollte ein Kalzium-Score (Ca-Score) und eventuell eine computertomografische Koronarangiografie (CTCA) durchgeführt werden. Bei fortgeschrittener HF und einem Ca-Score=0, kann eine ischämische HF ausgeschlossen werden; bei einem Ca-Score>0, une CTCA doit également être réalisée afin d’exclure ou de confirmer une coronaropathie sténotique et une HF ischémique. En cas de résultat positif, une angiographie invasive est à nouveau recommandée. Le résultat confirme la FC ischémique ou démontre une coronaropathie de type Bystander et nécessite les traitements appropriés.
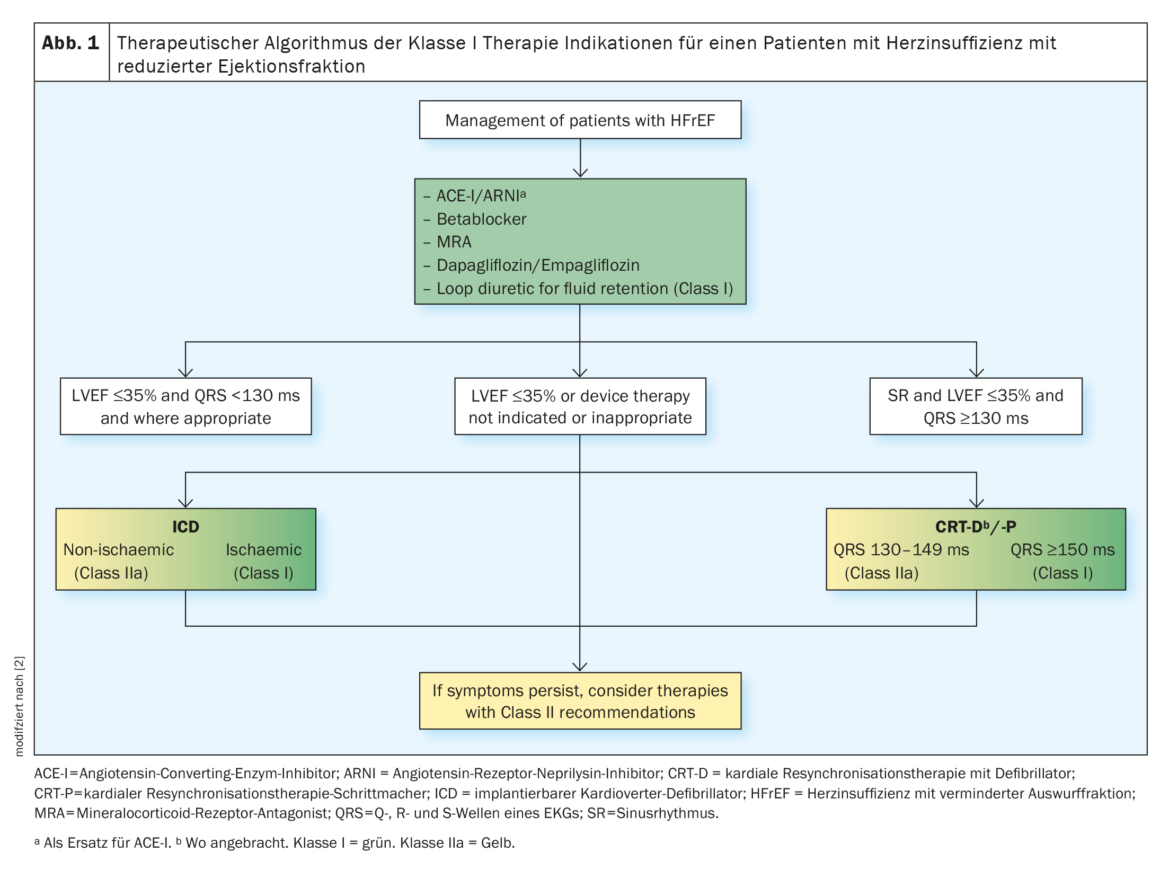
Bénéfice pronostique des médicaments HFrEF classiques
Actuellement, on distingue principalement deux groupes de patients sur la base de la fraction d’éjection du ventricule gauche : les patients dont la fonction de pompage (≤40%) du cœur est réduite et qui présentent une insuffisance cardiaque systolique (HFrEF) et les patients dont l’insuffisance cardiaque est due à une force de pompage (≥50%) du cœur préservée (HFpEF). Cette différenciation fait une grande différence sur le plan thérapeutique, car la recherche clinique a entre-temps développé un arsenal d’options thérapeutiques fondées sur des preuves pour réduire la morbidité et la mortalité des patients atteints d’HFrEF. En particulier, les “quatre fantastiques” (ARNI/ACE-I/ARB, BB, MRA, SGLT2-I) réduisent la morbidité et la mortalité dans les quatre semaines suivant le début du traitement.
Selon les directives de la Société européenne de cardiologie , le traitement standard courant de l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF) comprend d’abord l’utilisation d’un inhibiteur de l’enzyme de conversion de l’angiotensine (ECA) ou du récepteur de l’angiotensine II de type 1 (AT1) et d’un bêtabloquant (BB). Si la pression artérielle est adéquate et que le DFGe est ≥30 ml/min/m², le passage au Sacubtril/Valsartan est autorisé. Les inhibiteurs de l’ECA ou les bloqueurs AT1 doivent être arrêtés avant l’administration. Pour éviter un angio-œdème, un délai d’au moins 36 heures doit s’écouler entre la dernière administration d’un IEC et le début de l’administration d’un ARNI. En cas d’incompatibilité avec l’IEC ou l’ARNI, les ARBS/sartans peuvent être utilisés. Le RAAS-I, l’ARNI et le SGLT2-I peuvent tous les trois réduire temporairement le DFGe. Une augmentation de la créatinine <50% et une diminution du DFGe <10% de la valeur initiale sont acceptables, la fonction rénale se rétablit. Les SGLT2-I, en particulier, ont montré un avantage de survie indépendamment du statut du diabète/HbA1c.
Les patients atteints de FC ischémique ont en moyenne un risque plus élevé de mort subite d’origine cardiaque (MSC) que les patients atteints de FC non ischémique. En présence de facteurs de risque de MSC tels qu’une classification NYHA** II-III et une FEVG ≤35% malgré ≥3 mois de traitement médicamenteux optimal établi et une survie >1 an, il existe une indication CIM# de classe I pour les patients atteints d’HF ischémique et une indication de classe IIa pour tous les patients atteints d’HF non ischémique. Les patients avec une classification NYHA IV réfractaire au traitement pharmacologique (survie <1 an) reçoivent une indication de classe III. La thérapie de resynchronisation cardiaque (CRT) est recommandée pour les patients présentant une FC symptomatique, une FEVG ≤35% malgré un traitement médicamenteux optimal, un bloc de branche gauche (BBG) en rythme sinusal et une durée de QRS ≥150 ms (figure 1) [2].
** NYHA = New York Heart Association
# DAI = Défibrillateur cardioverteur implantable
Dépistage et traitement des maladies sous-jacentes
Chez les patients atteints d’HFpEF, les traitements améliorant le pronostic font défaut malgré de nombreuses études. Jusqu’à présent, aucun traitement n’a démontré une réduction de la mortalité et de la morbidité. Dans ce cas, il ne reste plus qu’à tenter empiriquement de soulager les symptômes des patients avec des diurétiques (de l’anse) et de les amener à adopter un mode de vie sain. L’absence de traitement général rend le dépistage et le traitement des maladies sous-jacentes telles que l’hypertension, le diabète, l’amylose, la maladie coronarienne et la valvulopathie d’autant plus importants chez les patients atteints de HFpEF, explique le PD Dr Philip Haaf, médecin cadre à l’Hôpital universitaire de Bâle [1]. La grande majorité des patients atteints d’HFpEF souffrent d’hypertension, et beaucoup d’entre eux ont également une maladie coronarienne sous-jacente. La recherche doit porter sur la fibrillation auriculaire, le diabète, la BPCO, les maladies rénales, les traitements oncologiques antérieurs, le statut du fer, les maladies des valves cardiaques, la cardiomyopathie hypertrophique et l’amylose cardiaque, poursuit M. Haaf.
Trop peu de fer est mauvais, mais trop de fer l’est aussi !
Une cardiomyopathie due à une surcharge en fer survient principalement chez les patients atteints d’hémochromatose primaire ou héréditaire, secondairement à de multiples transfusions sanguines. Une IRM cardiaque peut y remédier, en quantifiant la teneur en fer du cœur et du foie pour le diagnostic et le suivi du traitement par chélateurs du fer et de la saignée. Cependant, la carence en fer en cas d’insuffisance cardiaque est encore plus importante que la surcharge en fer. Pour les patients atteints d’HF, une carence en fer est présente lorsque la ferritine est <100 ng/ml ou lorsque la ferritine est <300 ng/ml avec une saturation de la transferrine (TSAT) <20%. La carence en fer peut se manifester indépendamment de l’anémie et touche 55% des patients atteints d’HF chronique et jusqu’à 80% des patients atteints d’HF aiguë. La cause exacte de la carence en fer chez HF reste inconnue.
Il est recommandé que tous les patients atteints d’HF et d’indication de classe I soient régulièrement évalués pour l’anémie et la carence en fer, par le biais d’un hémogramme complet, de la concentration sérique de ferritine et du TSAT. Une supplémentation en fer par voie intraveineuse avec du fer (III)-carboxymaltose doit être envisagée chez les patients FH symptomatiques récemment hospitalisés pour FH et présentant une FEVG ≤50% et une carence en fer, définie par une ferritine sérique <100 ng/ml ou une ferritine sérique 100-299 ng/ml avec TSAT <20%, afin de réduire le risque d’hospitalisation pour FH. Le traitement de l’anémie chez les HF par des agents stimulant l’érythropoïétine n’est pas recommandé en l’absence d’autres indications thérapeutiques.
Les problèmes de valvules sont fréquents
La sténose aortique provoque une surcharge du ventricule gauche, qui peut entraîner une hypertrophie cardiaque et une insuffisance cardiaque. On parle de sténose aortique sévère lorsque la surface d’ouverture de la valve est ≤1 cm² ou lorsque la pression moyenne est ≥40 mmHg. Cela entraîne une augmentation de la postcharge du VG et de l’hypertrophie et du remodelage du VG, ce qui détériore la fréquence cardiaque. Lors de l’utilisation de vasodilatateurs, il faut veiller à éviter l’hypotension. Un remplacement chirurgical est recommandé pour tous les patients <75 Jahren empfohlen, die zusätzlich ein geringes chirurgisches Risiko aufweisen. Die Transkatheter-Aortenklappen-Implantation (TAVI) wird bei Patienten>75 ans qui présentent un risque chirurgical élevé. En raison de la douceur de la procédure, le TAVI est également de plus en plus utilisé chez les patients plus jeunes.
L’insuffisance aortique peut également évoluer vers une insuffisance cardiaque au fil du temps. L’insuffisance aortique est considérée comme grave lorsqu’il existe un volume important de régurgitation et qu’un reflux se produit dans l’aorte. Cela entraîne une dilatation progressive du VG, puis un dysfonctionnement, ce qui aggrave à son tour la FC. Les bêtabloquants doivent être utilisés avec prudence, car ils peuvent prolonger la diastole et aggraver la régurgitation aortique. L’approche chirurgicale est considérée comme la norme en cas d’insuffisance aortique, mais le TAVI est également de plus en plus utilisé, notamment en cas de risque chirurgical élevé/prohibitif.
Une insuffisance mitrale (MR) sévère peut également provoquer une insuffisance cardiaque. Une intervention chirurgicale, de préférence une réparation, est recommandée chez les patients présentant une RM primaire sévère et des symptômes de RF. Si une intervention chirurgicale est contre-indiquée ou considérée comme à haut risque, une réparation percutanée peut être envisagée. Une chirurgie de la valve mitrale et un pontage aorto-coronarien doivent être envisagés chez les patients présentant une RM secondaire sévère et une HFrEF nécessitant une revascularisation. Une chirurgie isolée de la valve mitrale peut être envisagée chez les patients symptomatiques présentant une RM secondaire sévère, malgré un traitement optimal et un risque opératoire faible.
La régurgitation tricuspide (TR) peut être causée par un dysfonctionnement du VR et une HF ou en être la conséquence. Le traitement de l’HF avec TR comprend un traitement médicamenteux (diurétiques, antagonistes neurohormonaux). Dans des cas sélectionnés, une thérapie transcatheter et une intervention chirurgicale peuvent être envisagées. La chirurgie de la valve tricuspide est recommandée chez les patients atteints de TR sévère nécessitant une chirurgie cardiaque du côté gauche. Elle doit également être envisagée chez les patients présentant un TR modéré et une dilatation de la valve tricuspide nécessitant une chirurgie cardiaque du côté gauche, ainsi que chez les patients symptomatiques présentant un TR sévère isolé. Les techniques transcathéter se sont récemment révélées être des options de traitement potentielles pour la TR. Les résultats préliminaires montrent une amélioration de la sévérité et des symptômes de la TR avec de faibles taux de complications.

L’amylose cardiaque reste une cause sous-diagnostiquée
En règle générale, un patient sur six présentant une hypertrophie inexpliquée du ventricule gauche et/ou une FHPF souffre d’amylose cardiaque (AC). Les deux formes les plus courantes sont l’amylose à immunoglobuline à chaîne légère (AL) et l’amylose à transthyrétine (ATTR). Un âge >65 ans et une FH, associés à une épaisseur de la paroi du VG >12 mm à l’échocardiographie, sont les principaux critères de suspicion de CA. L’imagerie cardiaque et la biopsie endomyocardique (EMB) ou extracardiaque sont nécessaires pour diagnostiquer l’AL-CA chez les patients présentant des tests hématologiques anormaux. La scintigraphie au 99mTc-PYP## ou DPD$ ou HMDP& marquée au technétium avec imagerie planaire et SPECT*** a une spécificité et une valeur prédictive positive pour l’ATTR-CA pouvant atteindre 100%. En revanche, le CMR£ a une sensibilité et une spécificité de 85% et 92% respectivement. Cependant, l’EMB reste l’étalon-or pour le diagnostic de l’ATTR-CA, avec une sensibilité et une spécificité proches de 100%.
## mTc-PYP=pyrophosphate de 99mTcmarqué au technétium
$ DPD=Acide 3,3-diphosphono-1,2-propanedicarboxylique
& HMDP=hydroxyméthylène diphosphonate
*** SPECT = tomographie par ordinateur à émission de photons uniques
£ CMR = résonance magnétique cardiaque
Littérature :
- PD Dr. med. Philip Haaf: Herzinsuffizienz mit reduzierter und erhaltener EF. Forum Medizin Fortbildung (FomF), Update Refresher 2023, Kardiologie I, 24.01.2023.
- McDonagh TA, et al : 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal, Volume 42, Issue 36, 21 septembre 2021, Pages 3599-3726, https://doi.org/10.1093/eurheartj/ehab368.
Littérature complémentaire :
- Zeppenfeld K, et al.: 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. European Heart Journal, Volume 43, Issue 40, 21 October 2022, Pages 3997–4126, https://doi.org/10.1093/eurheartj/ehac262.
HAUSARZT PRAXIS 2023; 18(2): 20–21
CARDIOVASC 2023; 22(1): 26–28











