La carence en fer est non seulement fréquente dans les maladies malignes, mais elle constitue également un facteur de risque pour une efficacité limitée du traitement antitumoral. Il convient donc de surveiller la saturation de la transferrine et de commencer à temps une substitution en fer.
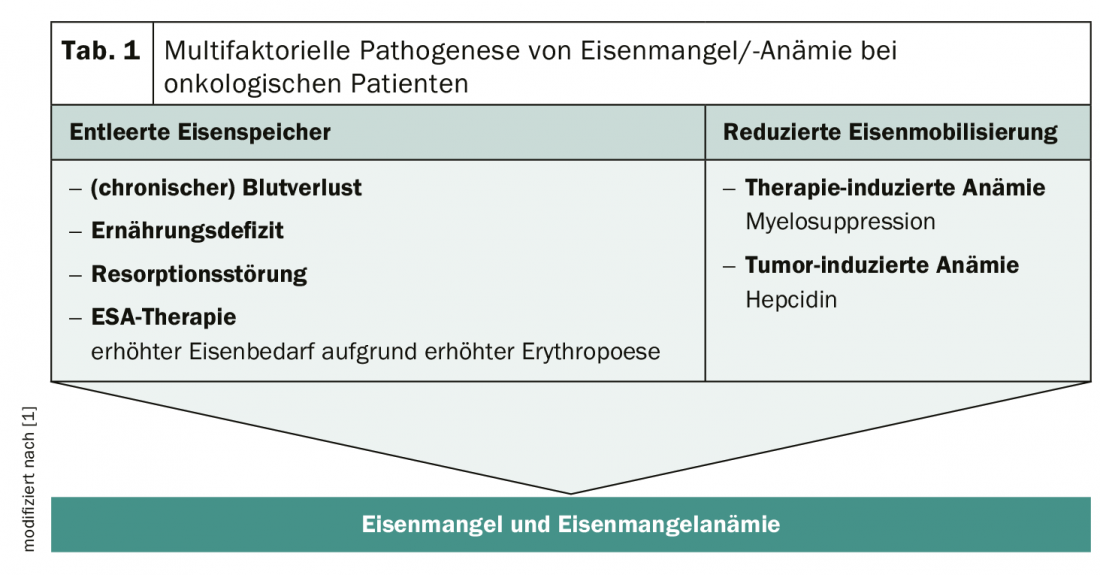
Les réserves de fer de l’organisme sont littéralement vidées par les maladies tumorales et leur traitement par chimiothérapie intensive. L’inflammation chronique entraîne une augmentation de la sécrétion de cytokines pro-inflammatoires telles que l’IL-6. En conséquence, le foie produit davantage d’hepcidine, qui freine l’absorption du fer dans l’intestin tout en réduisant la mobilisation du fer. Il en résulte une carence en fer liée à l’inflammation qui, selon sa gravité, peut déboucher sur une anémie. De plus, les patients oncologiques souffrent d’un épuisement de leurs réserves de fer (tableau 1). D’une manière générale, plus la tumeur est de haut grade, plus le risque d’anémie est important pour les personnes concernées. Mais les patients anémiques ont trois fois plus de risques de subir des réductions de dose et des interruptions de traitement, ce qui limite l’efficacité du traitement anti-tumoral. Cela augmente également le risque de récidive et diminue le taux de survie global. De plus, des symptômes tels que la fatigue, l’altération du système immunitaire et les dysfonctionnements cognitifs constituent une charge supplémentaire pour les personnes concernées. Plus la carence en fer est élevée, plus la qualité de vie des personnes sous traitement est faible.
Agir à un stade précoce
Des études montrent qu’une augmentation du taux d’hémoglobine est associée à une amélioration de la qualité de vie. En général, un taux d’Hb compris entre 11 et 13 g/dl est considéré comme optimal pour obtenir un niveau de qualité de vie suffisamment bon. En conséquence, la carence en fer doit être détectée et traitée à temps, avant que le taux d’Hb ne baisse trop. Un marqueur important de la saturation en fer est la saturation de la transferrine (TSAT). Chez les patients oncologiques, les valeurs de référence selon les lignes directrices de l’ESMO pour la carence en fer fonctionnelle sont TSAT <20% et des valeurs de ferritine sérique >100 μg /ml. A partir d’une Hb <12 g/dl (femmes) ou 13 g/dl (hommes), d’un TSAT <20% et de valeurs de ferrine sérique <100 μg/ml, on parle d’anémie ferriprive avec une carence absolue en fer. Les lignes directrices S3 actuelles sur le traitement de soutien préconisent également un contrôle étroit du statut en fer. Elle recommande un dosage de la saturation de la transferrine (TSAT) avant le début de la chimiothérapie.
Compenser efficacement les déficits
Il existe plusieurs moyens de combler rapidement et efficacement cette carence. En cas de soins aigus, une transfusion sanguine peut être nécessaire. Cependant, elle ne doit être utilisée que dans des cas exceptionnels, car elle augmente la mortalité et le risque d’infections et de complications thromboemboliques. L’administration d’agents stimulant l’érythropoïèse (ESA) est une autre option à laquelle une grande partie des patients répondent bien. Cependant, le risque de thrombose augmente. Une substitution en fer est également efficace, qu’elle soit administrée par voie orale ou i.v. et qu’elle soit également associée à l’ASE. L’administration orale requiert toutefois certaines conditions cliniques, car la capacité d’absorption intestinale peut être significativement réduite par l’inflammation.
Source : 34e Congrès allemand sur le cancer (DKK)
Littérature :
- Aapro M, et al : Prévalence et prise en charge de l’anémie liée au cancer, de la carence en fer et du rôle spécifique du fer i.v. Ann Oncol 2012 ; 23 : 1954-1962.
InFo ONKOLOGIE & HÄMATOLOGIE 2020 ; 32 (publié le 24.4.20, ahead of print)