La résistance aux substances antibiotiques est en augmentation dans le monde entier. Cela entraîne une perte progressive de l’efficacité de nombreux antibiotiques et rend plus difficile le traitement de nombreuses infections. La résistance aux antibiotiques β-lactamines chez les bactéries gram-négatives est souvent liée à la production de β-lactamases. Certains des efforts visant à surmonter ce mécanisme de résistance courant ont été couronnés de succès. Outre les substances déjà approuvées, plusieurs substances sont actuellement étudiées dans le cadre d’essais cliniques.
La résistance croissante des agents pathogènes bactériens aux antibiotiques constitue un problème majeur. Cela concerne aussi bien les soins hospitaliers que les soins ambulatoires, d’autant plus que près de 80% des antibiotiques sont prescrits dans le cadre d’un traitement ambulatoire [1,2]. Les stratégies de lutte contre la résistance aux antibiotiques peuvent être mises en œuvre dans le cadre de programmes d’intendance des antibiotiques ou indépendamment de ceux-ci. La Société Suisse d’Infectiologie publie des directives sur différents types d’infections et de nombreux projets ont été lancés sur le thème de la résistance aux antibiotiques (encadré) [3]. “Dr. med. Sarah Tschudin Sutter, Clinique d’infectiologie et d’hygiène hospitalière de l’Hôpital universitaire de Bâle [4]. Acinetobacter baumannii résistant aux carbapénèmes, Pseudomonas aeruginosa résistant aux carbapénèmes et les agents pathogènes résistants aux céphalosporines de troisième génération ont été classés par l’OMS comme “pathogènes de premier rang” dans la liste des priorités pour le développement de nouveaux antibiotiques.
|
Le Centre suisse pour la résistance aux antibiotiques (ANRESIS), un système national de surveillance et une unité de recherche sur la résistance aux antibiotiques et la consommation d’antibiotiques, propose notamment une présentation interactive des données les plus récentes sur la résistance aux antibiotiques à l’adresse [15]. Le Département de l’intérieur et le Département de l’économie, de la formation et de la recherche sont responsables de la mise en œuvre de la Stratégie nationale contre la résistance aux antibiotiques (StAR) [17]. StAR a pour objectif de préserver l’efficacité des antibiotiques à long terme pour les humains et les animaux. Il contient également des recommandations concrètes sur les mesures d’hygiène à prendre pour améliorer l’hygiène en cuisine et éviter la transmission de bactéries résistantes aux antibiotiques par les aliments d’origine végétale ou animale. Cela va dans le sens de l’approche “One Health” définie par l’Organisation mondiale de la santé (OMS) pour lutter contre les bactéries résistantes aux antibiotiques [18]. Un “Surveillance ATLAS of Infectious Diseases” est proposé par le European Center for Disease Control (ECDC) sur son site Internet. Cet outil permet d’avoir une vue d’ensemble de la résistance aux antibiotiques dans différents pays pour de nombreux agents pathogènes bactériens importants [16]. De nombreux projets d’étude sont menés dans le monde entier sur les mécanismes de résistance et l’exploitation de nouveaux antibiotiques. |
Les principaux mécanismes de résistance et les “besoins non satisfaits
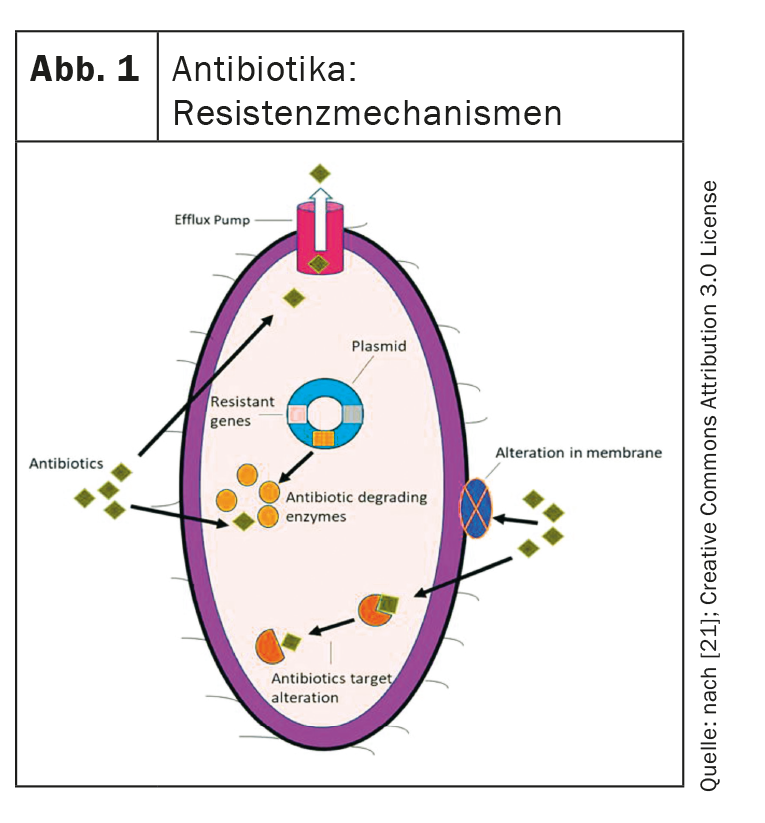
Il s’agit des quatre principaux mécanismes de résistance que les bactéries peuvent exprimer et que les nouveaux antibiotiques doivent surmonter (Fig. 1) [4,21,22]:
- Perte de porine : des mutations dans les gènes de porine entraînent une perte de porine et donc une diminution de la perméabilité de la membrane cellulaire bactérienne. Cela empêche l’absorption des antibiotiques.
- Pompes à efflux : les pompes à efflux sont également un facteur important. Ceux-ci transportent les antibiotiques vers l’extracellulaire et peuvent être hautement régulés.
- Modification de la cible : le site de liaison des antibiotiques peut être modifié de manière à ce que les antibiotiques ne puissent plus exercer leur action.
- Enzymes hydrolysantes : elles peuvent dégrader les antibiotiques par voie enzymatique.
Les substances antibiotiques actuellement disponibles sont pour la plupart des substances produites par les champignons et les bactéries eux-mêmes, il n’y a que peu de substances synthétiques. Au cours des 10 à 15 dernières années, peu de nouveaux antibiotiques ont été mis sur le marché. Dans le contexte de l’émergence de la résistance aux antibiotiques, il est urgent de développer de nouveaux agents antibiotiques [5].
Résistance aux β-lactamases : un problème mondial
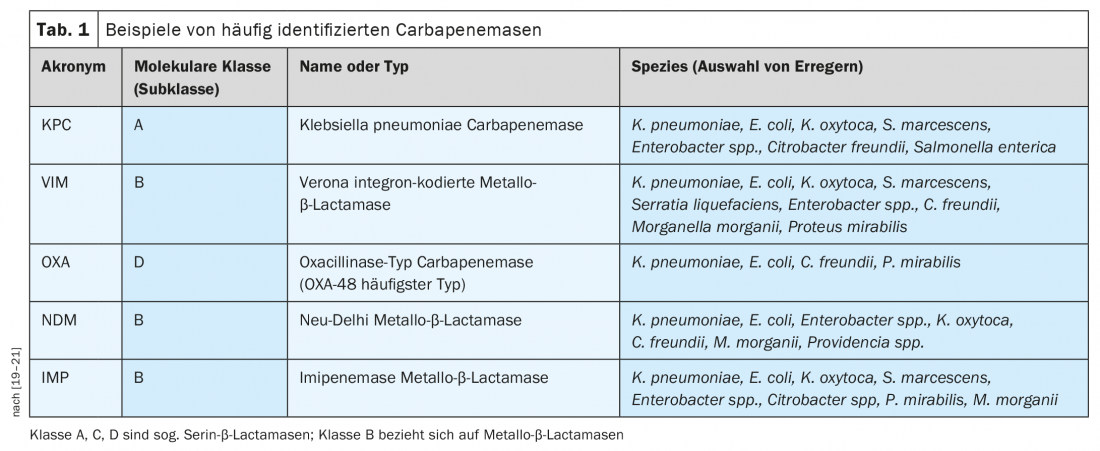
L’Organisation mondiale de la santé (OMS) a publié un avis sur la priorité à accorder au développement des antibiotiques [6]. Il en ressort qu’il existe notamment un besoin important d’antibiotiques efficaces sur les agents pathogènes à Gram négatif pour lutter contre la résistance aux carbapénèmes [6]. La résistance aux antibiotiques β-lactamines chez les bactéries à Gram négatif est souvent associée à la production de β-lactamases, y compris les β-lactamases à spectre étendu (ESBL) et les carbapénémases (tableau 1), qui appartiennent à différentes classes de molécules [7]. Les carbapénèmases sont des enzymes bactériennes dont le développement de la résistance aux antibiotiques constitue une menace existante ou potentielle pour la santé publique [8]. Le groupe des BLSE est homogène, c’est-à-dire qu’ils ont les mêmes substrats, ce qui est un avantage en termes de traitement. En revanche, les carbapénèmases constituent un groupe d’enzymes très hétérogène, avec des propriétés chimiques et des substrats différents. “En conséquence, il n’est guère possible de trouver des substances qui soient efficaces pour toutes les différentes classes de carbapénèmases”, a déclaré l’intervenante [4]. Les différentes carbapénèmases sont largement répandues dans le monde, y compris en Europe. En particulier, Pseudomonas aeruginosa résistant aux carbapénèmes (CRPA) et Acinetobacter baumannii résistant aux carbapénèmes (CRAB) peuvent exprimer simultanément différents mécanismes de résistance.
Quelles sont les stratégies de résolution ?
De nombreuses substances apparues sur le marché ces dernières années sont des modifications d’antibiotiques déjà disponibles ou des combinaisons de β-lactamines avec des inhibiteurs de β-lactamase. Malheureusement, il n’existe pas de nouvelle classe d’antibiotiques, a déclaré le professeur Tschudin Sutter. En ce qui concerne les β-lactamines, citons le cefiderocol – une céphalosporine dotée d’un nouveau mécanisme d’action, qui a été approuvée par l’Agence européenne des médicaments (EMA) en 2020 pour le traitement des infections dues à des agents pathogènes aérobies à Gram négatif chez les adultes. [9]. Le cefiderocol est structurellement une céphalosporine à laquelle une chaîne latérale a été couplée avec une structure de catéchol. Les chaînes latérales dans la molécule augmentent la stabilité contre les β-lactamases. La céphalosporine dite sidérophore, le cefiderocol, se caractérise par sa capacité à fixer le fer trivalent. Les bactéries aérobies à Gram négatif ont besoin de fer et ont un système de transport actif des sidérophores chargés de fer pour répondre à leurs besoins. Le cefiderocol en profite pour traverser la membrane cellulaire externe puis détruire la cellule en perturbant la synthèse de la paroi cellulaire [10]. Le cefiderocol présente une grande stabilité à l’hydrolyse vis-à-vis de presque toutes les β-lactamases, y compris les bêta-lactamases à spectre étendu (ESBL), les enzymes AmpC et les sérine et métallocarbapénémases.
Des résultats prometteurs sont également disponibles pour l’antibiotique oral tebipenem. Dans une étude de phase III publiée dans le New England Journal of Medicine , le tébipénème (oral) s’est révélé non inférieur à l’ertapénème (i.v.) dans le traitement des infections urinaires compliquées et a présenté un profil d’effets secondaires comparable [11].
De nouvelles options thérapeutiques capables de surmonter les résistances sont également nécessaires contre l’agent pathogène à Gram négatif Pseudomonas aeruginosa. Les mécanismes de résistance aux antibiotiques β-lactames les plus courants chez P. aeruginosa sont l’augmentation de l’expression des β-lactamases intrinsèques, l’acquisition de nouvelles β-lactamases, l’augmentation de l’excrétion au moyen de pompes d’efflux et la perte ou la diminution de l’expression des porines dans la membrane cellulaire, ce qui diminue ou empêche l’absorption des antibiotiques [12]. Entre autres, les patients atteints de fibrose kystique ont besoin d’une antibiothérapie efficace contre les infections chroniques à P. aeruginosa. La lévofloxacine inhalée a montré une tendance à l’amélioration de la fonction pulmonaire et un intervalle de temps plus long avant l’apparition d’une exacerbation dans cette population de patients par rapport à la tobramycine [13].
La délafloxacine est également une quinolone et a été autorisée en Suisse en 2020 comme antibiotique de réserve pour le traitement des infections bactériennes aiguës de la peau et de la structure cutanée (ABSSSI) [14] Les effets sont basés sur l’inhibition de la topoisomérase IV bactérienne et de l’ADN gyrase. La fluoroquinolone a des propriétés bactéricides contre les bactéries gram-positives et gram-négatives et agit également sur les germes problématiques tels que Klebsiella pneumoniae, SARM, Pseudomonas aeruginosa. la délafloxacine a un caractère anionique à pH neutre et se trouve principalement sous forme non chargée à pH légèrement acide, ce qui la distingue des autres fluoroquinolones qui se présentent sous forme de cations à pH acide et principalement sous forme d’hermaphrodites à des valeurs plus élevées, et dont l’activité diminue en milieu acide [23].
Congrès : medArt
Littérature :
- Weber R, Chmiel C : Infectiologie – Recommandations thérapeutiques, mis à jour le : 12/2021, www.medix.ch/media/gl_infektiologie_therapieempfehlungen_06.2021_23.6.21_mh_1.pdf, (dernière consultation 31.08.2022)
- OFSP : Comment les antibiotiques sont-ils prescrits aujourd’hui en Suisse ? www.bag.admin.ch/bag/de/home/krankheiten/infektionskrankheiten-bekaempfen/antibiotikaresistenzen/wie-werden-heute-in-der-schweiz-antibiotika-verschrieben.html, (dernier appel 31.08.2022)
- Société Suisse d’Infectiologie, www.ssi.guidelines.ch, (dernière consultation 31.08.2022)
- “Nouveaux antibiotiques”, Prof. Dr méd. Sarah Tschudin Sutter, medArt 20-24.06.2022
- OFSP : Conditions générales dans le domaine des antibiotiques, www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/strategie-antibiotikaresistenzen-schweiz/rahmenbedingungen-im-bereich-der-antibiotika.html, (dernière consultation 31.08.2022)
- Tacconelli E, et al : Découverte, recherche et développement de nouveaux antibiotiques : la liste prioritaire de l’OMS des bactéries résistantes aux antibiotiques et de la tuberculose. Lancet Infect Dis 2018 ; 18 : 318-327.
- Bush K, Bradford PA : Interaction entre les β-lactamases et les nouveaux inhibiteurs de β-lactamase. Nat Rev Microbiol 2019 ; 17(5) : 295-306.
- OFSP : Entérobactéries productrices de carbapénémases (CPE), www.bag.admin.ch/bag/de/home/krankheiten/krankheiten-im-ueberblick/antibiotikaresistente-bakterien.html, (dernière consultation 31.08.2022)
- Information sur les médicaments, www.ema.europa.eu/en/documents/product-information/fetcroja-epar-product-information_de.pdf, (dernière consultation 31.08.2022)
- Rössler A : “Cefiderocol : un nouvel antibiotique pour vaincre les résistances”, Pharmazeutische Zeitung, 19.01.2021
- Eckburg PB, et al : Le bromhydrate de pivoxil de tébipénème oral dans les infections urinaires compliquées. N Engl J Med 2022 ; 386(14) : 1327-1338.
- Poole K : Pseudomonas aeruginosa : Résistance au max. Front Microbiol 2011(2) : 1-13.
- Elborn JS, et al : A phase 3, open-label, randomized trial to evaluate the safety and efficacy of levofloxacin inhalation solution (APT-1026) versus tobramycin inhalation solution in stable cystic fibrosis patients. J Cyst Fibros 2015 ; 14(4) : 507-514.
- Information sur les médicaments, www.swissmedicinfo.ch/default.aspx, (dernière consultation 31.08.2022)
- ANRESIS, www.anresis.ch/de, (dernier appel 31.08.2022)
- Centre européen de prévention et de contrôle des maladies (ECDC), www.ecdc.europa.eu/en/surveillance-and-disease-data, (dernière consultation 31.08.2022)
- Stratégie de lutte contre la résistance aux antibiotiques en Suisse (StAR), https://www.blv.admin.ch/blv/de/home/das-blv/strategien/nationale-strategie-antibiotikaresistenzen.html, (dernière consultation 31.08.2022)
- Walsh TR : A one-health approach to antimicrobial resistance. Nat Microbiol. 2018 ; 3 : 854-855.
- Magiorakos AP, et al : Infection Prevention and Control Measures and Tools for the Prevention of Entry of Carbapenem-Resistant. Antimicrob Resist Infect Control 2017 ; 6 : 113. https://dx.doi.org/10.1186/s13756-017-0259-z.
- Tzouvelekis LS, et al : Carbapenemases in Klebsiella Pneumoniae and Other Enterobacteriaceae : An Evolving Crisis of Global Dimensions. Clin Microbiol Rev 2012 ; 25(4) : 682-707. https://dx.doi.org/10.1128/CMR.05035-11.
- Swissnoso, www.swissnoso.ch/fileadmin/swissnoso/Dokumente/5_Forschung_und_Entwicklung/8_Swissnoso_Publikationen/211115_StAR_Teil_II_DE_MDRO-non-outbreak_FINAL.pdf, (dernière consultation 31.08.2022)
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(9) : 20-21