Les patients asthmatiques peuvent aujourd’hui être bien traités, même dans les formes sévères, s’ils suivent le traitement le mieux adapté à leur cas. L’utilisation à long terme de corticostéroïdes oraux (OCS) est problématique en raison des risques et des effets secondaires qui y sont associés. L’utilisation de produits biologiques comme traitement d’appoint est une stratégie pertinente pour réduire les OCS et améliorer la qualité de vie. Pour choisir le traitement par anticorps le mieux adapté à chaque individu, il est utile de déterminer le phénotype de l’asthme.
L’asthme et la BPCO sont les maladies obstructives des voies respiratoires les plus courantes et jouent un rôle important dans les soins ambulatoires des patients. Environ 4 à 7% de la population suisse souffre d’asthme. Les manifestations cliniques typiques sont des symptômes respiratoires tels que la dyspnée, l’oppression thoracique, la toux ainsi que des sifflements et des gargouillis. Les symptômes varient au fil du temps, notamment en fonction de la saisonnalité et des infections virales. Une gestion interdisciplinaire est nécessaire, en particulier pour les formes graves. A l’occasion du congrès médical de Davos, le professeur Jörg D. Leuppi, médecin-chef de l’hôpital cantonal de Bâle-Campagne, a donné un aperçu actuel du traitement de l’asthme à l’ère des médicaments biologiques [1]. Environ 5 à 10% des personnes asthmatiques souffrent d’un asthme sévère ou difficile à traiter, qui est généralement traité en collaboration avec un pneumologue ou un allergologue [2,3]. On parle d’asthme sévère lorsque, malgré une adhérence optimale au traitement et un traitement maximal par corticostéroïdes inhalés (CSI) à la dose maximale plus au moins un autre médicament à long terme et, le cas échéant, l’administration de stéroïdes oraux (SOC), la fonction pulmonaire reste mauvaise, les exacerbations nécessitant des stéroïdes ou conduisant à une hospitalisation sont fréquentes et les critères d’un asthme partiellement contrôlé ou non contrôlé sont présents. [1,4]. Le risque d’exacerbations graves est plus élevé chez les patients souffrant d’asthme non contrôlé, ce qui entraîne un risque d’hospitalisation et de mortalité. Environ un quart des patients souffrant d’asthme sévère rapportent quatre exacerbations ou plus par an [12].
Le niveau d’éosinophilie est en corrélation avec le résultat de l’asthme
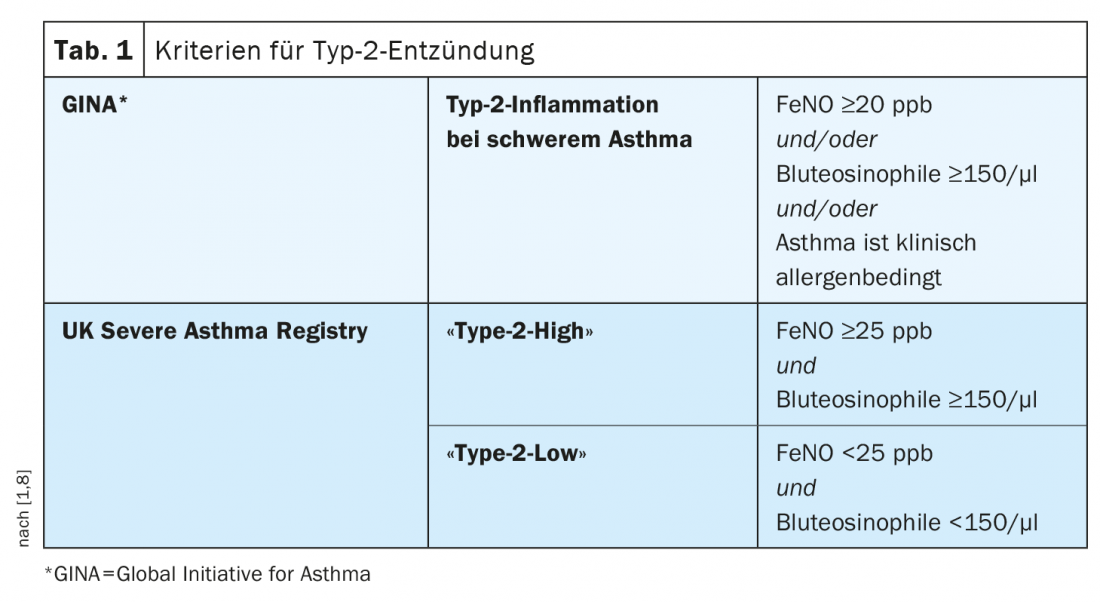
L’asthme sévère comprend différents phénotypes qui diffèrent en termes de manifestations cliniques, de mécanismes physiopathologiques et de réponse au traitement [5]. Les deux phénotypes cliniques les plus fréquents sont caractérisés par une inflammation à éosinophiles et sont appelés respectivement asthme allergique primaire “early-onset” et asthme à éosinophiles “adult-onset”. La physiopathologie complexe est dominée par une réponse immunitaire Th2 (tableau 1) [1,6,8]. “Le niveau d’éosinophilie est un facteur de risque d’augmentation de la fréquence des exacerbations et de la sévérité de l’asthme, en fonction d’autres co-facteurs”, explique le professeur Leuppi. Ceci est en corrélation avec un moins bon contrôle de l’asthme. Dans une étude épidémiologique publiée dansle Lancet Respiratory Medicine par Price et al. cette corrélation a été statistiquement démontrée [9]. Les biomarqueurs cliniques de l’asthme à éosinophiles sont le nombre d’éosinophiles dans le sang et dans les expectorations, ainsi que des taux élevés de monoxyde d’azote exhalé fractionné (FeNO) [7]. L’augmentation de l’activation et du recrutement des éosinophiles a un effet pro-inflammatoire. Sous l’influence des chimiokines, les éosinophiles migrent de la moelle osseuse vers les parois des bronches. Ils s’y accumulent et activent des médiateurs, ce qui contribue à endommager les voies respiratoires. Selon les données de la Global Initiative for Asthma (GINA), environ la moitié des cas d’asthme sévère présentent un phénotype éosinophile [8].
Le terme “Type 2 Low Asthma” désigne un phénotype qui n’a pas encore été entièrement caractérisé et pour lequel il n’existe aucune preuve d’allergie, aucune preuve d’un nombre élevé de granulocytes éosinophiles dans les poumons ou dans le sang et aucune preuve d’une inflammation induite par Th2. (Tab.1). L’asthme “non de type 2” est relativement rare, résume le professeur Leuppi, qui conseille de procéder à un diagnostic différentiel si un patient souffrant d’asthme sévère présente des marqueurs de type 2 bas [1].
Réduction des stéroïdes systémiques grâce à l’utilisation de produits biologiques
Le traitement de l’asthme est basé sur un cycle de traitement dans lequel le traitement est régulièrement évalué, adapté et la réponse est ensuite contrôlée [10]. Le schéma thérapeutique proposé par la “Global Initiative for Asthma” prévoit cinq niveaux de traitement de l’asthme. Au niveau 5, un traitement add-on avec un agent biologique spécifique au phénotype est aujourd’hui recommandé comme traitement d’entretien en complément des ICS-LABA (tableau 2). Les objectifs à long terme de la prise en charge de l’asthme sont un bon contrôle des symptômes et la minimisation du risque d’exacerbation et des effets secondaires des médicaments. L’utilisation à long terme de stéroïdes oraux systémiques (SOC) augmente la mortalité et les taux de complications, comme le montrent les données de plusieurs études prospectives et rétrospectives, explique le professeur Leuppi. En cas d’asthme sévère (escalade du niveau 4 au niveau 5 selon le GINA), il convient donc d’envisager l’introduction d’un traitement par anticorps après avoir contrôlé la technique d’inhalation et les facteurs de risque pour les patients présentant des biomarqueurs éosinophiles ou allergiques. Cela permet de réduire l’utilisation à long terme des OCS. Les directives actuelles du GINA ne prévoient les OCS dans l’asthme sévère que dans des cas exceptionnels, lorsque même de fortes doses de glucocorticoïdes inhalés combinées à des bronchodilatateurs à longue durée d’action (LABA et/ou LAMA) et à l’administration d’un médicament biologique ne permettent pas d’obtenir un contrôle suffisant [11].

Choisir un médicament biologique en fonction des caractéristiques du patient
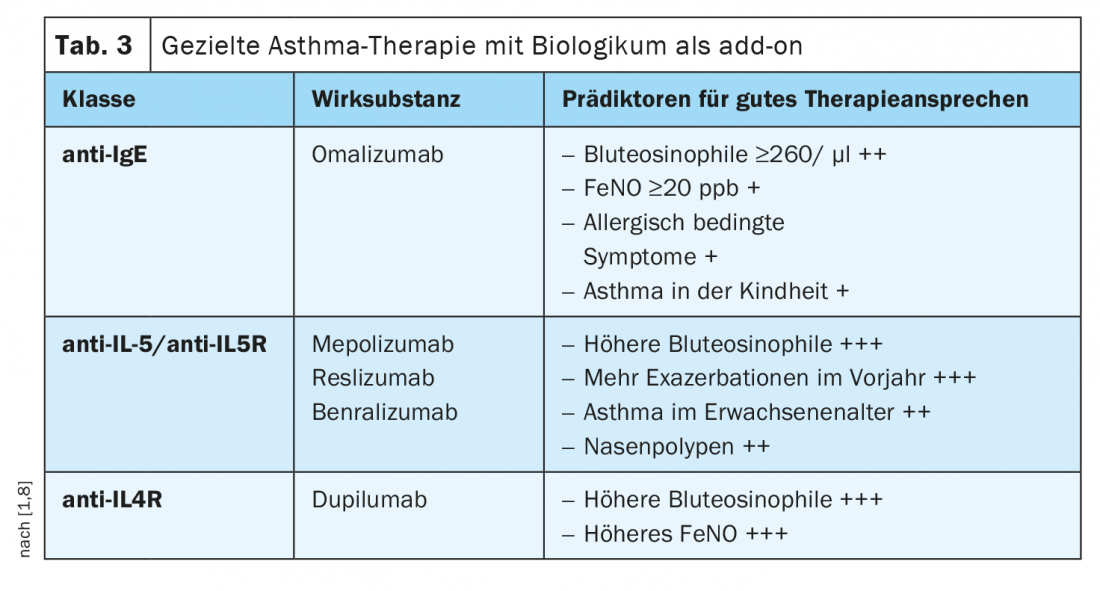
La détermination de biomarqueurs ou de phénotypes corrélés permet de prédire la réponse à un traitement par anticorps donné (tableau 3) [1,8]. En cas d’allergie perannuelle et de concentration d’IgE nettement élevée, il est judicieux d’utiliser un anticorps anti-IgE. En cas d’éosinophilie sanguine nettement élevée (>300 cellules/µl), les anticorps monoclonaux dirigés contre l’interleukine-5 (IL-5) ou les anticorps anti-récepteur de l’IL-5 sont plus adaptés, et en cas d’asthme éosinophile avec une éosinophilie de >150 cellules/µl et une fraction FeNO élevée dans l’air expiré, un traitement avec un anticorps anti-récepteur de l’interleukine-4 est envisageable. Si une telle stratégie de traitement personnalisé est appliquée, le contrôle de l’asthme peut être considérablement amélioré dans de nombreux cas, ce qui peut également se traduire par une réduction significative des stéroïdes systémiques. [1]. Le seul anticorps monoclonal humanisé contre les IgE autorisé à ce jour pour l’asthme est l’omalizumab. Ce produit biologique agit en fixant les anticorps IgE libres, ce qui entraîne une baisse des taux d’anticorps libres et, secondairement, une down-régulation du FcεRI sur les basophiles et les mastocytes. Pour les traitements ciblant l’IL-5, il existe le mépolizumab, le reslizumab et le benralizumab, un anticorps dirigé contre les récepteurs de l’IL-5. Alors que le mépolizumab et le reslizumab bloquent la voie de signalisation de la cytokine en se liant de manière hautement spécifique à l’IL-5, réduisant ainsi la formation et la survie des éosinophiles, le benralizumab interagit à la fois avec les récepteurs IL-5Rα et FcγRIII sur les cellules effectrices de l’immunité. La voie de signalisation de l’IL-4 peut être inhibée par le dupilumab, un anticorps monoclonal humanisé IgG4 qui se lie aux récepteurs IL-4Rα et au récepteur alpha de l’IL-13 (IL-13Rα).
L’intervenant souligne que les recommandations du GINA s’appliquent également pendant la pandémie de coronavirus et qu’il est très important de prendre régulièrement les médicaments contre l’asthme conformément à la prescription [3]. Parallèlement au traitement médicamenteux, il convient d’identifier les éventuelles comorbidités et les facteurs de risque ou déclencheurs modifiables (par ex. exposition aux allergènes, tabagisme) et de les adapter si nécessaire.
Congrès : Congrès médical de Davos
Littérature :
- Leuppi JD : Comment les médicaments biologiques ont changé le traitement de l’asthme. Jörg D. Leuppi, Congrès médical de Davos, 11.02.2022.
- Leuppi JD, et al. : Benralizumab : le récepteur IL-5 comme cible dans l’asthme éosinophile sévère. Praxis (Berne 1994) 2019 ; 108 (7) : 469-476.
- Leuppi J : Nouveautés dans les soins de base de l’asthme : Praxis 2021 ; 110(16). DOI:10.1024/1661–8157/a003760.
- BÄK/KBV/AWMF : Ligne directrice nationale de soins pour l’asthme – 4e édition, version 1, 2020 ; DOI : 10.6101/ÄZQ/000469
- Bakakos A, Loukides S, Bakakos P : Asthme grave à éosinophilie. J Clin Med 2019 ; 8(9) : 1375.
- Kühn M, Dimitriou F, Steiner UC, et al : Réponse immunitaire TH2 : importance et influence thérapeutique. Swiss Med Forum 2021 ; 21(0102) : 13-17.
- Pavlidis S, et al : “T2-high” in severe asthma related to blood eosinophil, exhaled nitric oxide and serum periostin. Eur Respir J 2019 ; 53(1) : 1800938.
- Initiative mondiale pour l’asthme : stratégie mondiale pour la gestion et la prévention de l’asthme. Mis à jour en 2020. https:// ginasthma.org, (dernière consultation 2202.2022)
- Price DB, et al : Blood eosinophil count and prospective annual asthma disease burden : a UK cohort study. Lancet Respirator Med 2015 ; 3(11) : 849-858.
- Steurer-Stey C : Asthme. medix Guideline, mis à jour : 11/2021, www.medix.ch (dernière consultation 22.02.2022)
- Asthme sévère : les glucocorticoïdes oraux sont relégués au second plan. Allergo J 2020 ; 29 : 74, https://doi.org/10.1007/s15007-020-2557-7
- Wang E, et al. : Caractérisation de l’asthme sévère dans le monde : données du Registre international de l’asthme sévère (ISAR). Chest 2020 ; 157 : 790-804.
- Initiative mondiale pour l’asthme : stratégie mondiale pour la gestion et la prévention de l’asthme. Mis à jour en 2021. https://ginasthma.org, (dernier appel 2202.2022)
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(3) : 26-27