L’insuffisance rénale nécessitant une dialyse peut être la conséquence d’une maladie glomérulaire diagnostiquée trop tard, qui s’accompagne généralement de symptômes et de signes non spécifiques. Le dépistage des pathologies rénales comprend donc, outre la mesure de la pression artérielle, une détermination de la créatinine sérique, un hémogramme et un examen des urines par le médecin généraliste. En cas de résultats pathologiques, les investigations complémentaires doivent être menées par un spécialiste. Le traitement de la maladie sous-jacente comprend toujours un bon contrôle de la pression artérielle et l’évitement de substances néphrotoxiques telles que les AINS et les produits de contraste radiographiques.
Si les éléments filtrants des reins, les glomérules, s’enflamment, nous parlons de glomérulonéphrites (GN). Ils ne provoquent que des symptômes et des signes non spécifiques, mais la localisation et la gravité des lésions glomérulaires s’accompagnent de modèles de lésions cliniques caractéristiques qui permettent souvent d’établir un diagnostic différentiel avec la maladie glomérulaire sous-jacente. Une biopsie rénale aide à déterminer la maladie rénale spécifique, ce qui permet à son tour de déterminer si la maladie est limitée au rein ou si elle est systémique. Alors que les examens et les interventions spécifiques aux reins sont effectués par le spécialiste, le dépistage des pathologies rénales constitue le domaine du médecin généraliste. La détection, le traitement et le suivi de l’atteinte glomérulaire suivent quelques principes généraux qui peuvent être appliqués à la plupart des GN.
Modèles de lésions cliniques dans les glomérulonéphrites
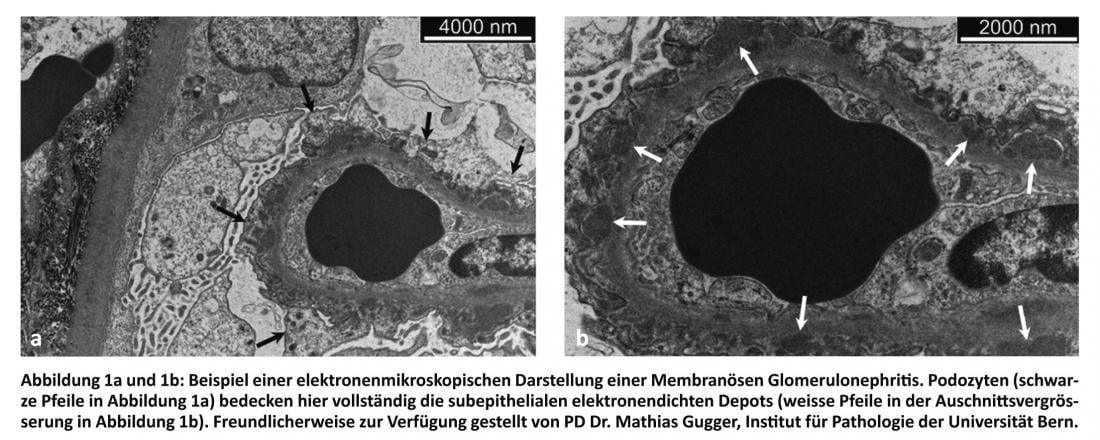
Dans un glomérule, différents types de cellules et de structures peuvent être pathologiquement altérés. Beaucoup de ces changements peuvent être attribués à une maladie du complexe immunitaire. Une lésion de la membrane basale et/ou des podocytes adjacents à l’extérieur entraîne souvent une augmentation de la perméabilité du filtre glomérulaire et, par conséquent, une protéinurie (PU). Une lésion de l’endothélium avec rupture de la paroi capillaire ou une prolifération des cellules mésangiales s’accompagne généralement d’une microhématurie. L’infiltration par des cellules inflammatoires peut se traduire par la formation de foyers de nécrose avec formation d’un croissant glomérulaire associé à une GN à progression rapide avec insuffisance rénale aiguë.
Une PU inférieure à 2 g par jour est généralement asymptomatique. Une PU sévère de plus de 3 g par jour entraîne le schéma lésionnel du syndrome néphrotique qui, outre la PU, se caractérise cliniquement par des œdèmes des parties dépendantes et, en laboratoire, par une hypoalbuminémie et une hyperlipidémie. Cette maladie est souvent accompagnée d’une hypercoagulabilité avec un risque accru de thrombose des veines des jambes et des reins, avec des embolies pulmonaires consécutives. Les causes les plus fréquentes du syndrome néphrotique chez l’adulte sont la néphropathie diabétique, la glomérulosclérose segmentaire focale (FSGS) et la néphropathie membraneuse.
Le schéma lésionnel du syndrome néphritique se caractérise par une hématurie, une oligurie, une hypertension artérielle et une insuffisance rénale. Les maladies pouvant être associées à un syndrome néphritique sont les néphropathies à IgA, les GN infectieuses et post-infectieuses, les néphrites lupiques et les vascularites des petits vaisseaux ANCA positives et négatives. Les GN associées aux ANCA avec croissants ou les GN associées aux membranes basales anti-glomérulaires peuvent entraîner une perte rapidement progressive de la fonction rénale.
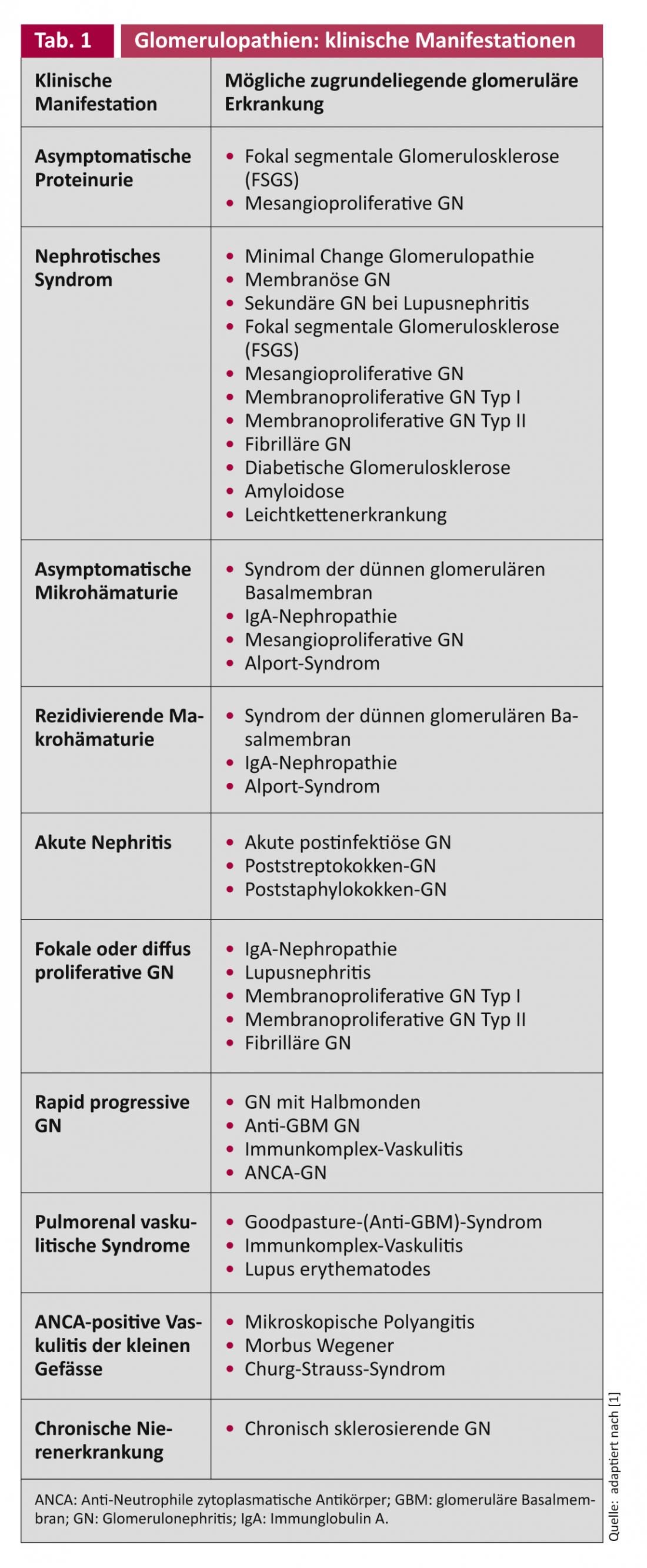
Même si les GN présentent à la fois les caractéristiques du syndrome néphrotique et du syndrome néphritique à des degrés divers, il existe souvent un schéma de lésion dominant. Cependant, étant donné que la même maladie glomérulaire peut se manifester différemment sur le plan clinique et que, d’autre part, la même clinique peut être causée par différentes maladies glomérulaires (tableau 1), seule une biopsie rénale permet souvent d’élucider la pathologie glomérulaire spécifique chez l’adulte. Si une maladie glomérulaire n’est pas diagnostiquée et donc non traitée, elle peut évoluer vers une GN chronique avec des glomérules sclérosés, une fibrose interstitielle et une artériosclérose rénale avec une insuffisance rénale légèrement limitée à prédialytique. Lors de l’évaluation de la biopsie rénale, il est donc important de savoir s’il s’agit d’une lésion active qui répond encore potentiellement à un traitement spécifique ou si la lésion est déjà chronique et donc irréversible et non traitable [1].
Dépistage des pathologies glomérulaires
Les patients souffrant d’une atteinte glomérulaire se présentent généralement chez leur médecin généraliste avec des symptômes et des signes non spécifiques tels que des maux de tête, de la fatigue, des nausées, des difficultés respiratoires ou un gonflement des jambes. En plus de l’anamnèse et de l’examen physique, la pression artérielle doit toujours être mesurée, car l’hypertension artérielle est souvent un signe clinique précoce de la maladie glomérulaire. Les examens de laboratoire aident au dépistage précoce, à la vérification et à la classification sommaire d’une maladie rénale. Pour ce faire, la créatinine, l’urée, le sodium, le potassium, le calcium, le phosphate, l’acide urique et les protéines totales sont dosés dans le sérum. Il faut également une numération sanguine et une analyse d’urine par bandelette urinaire et, si possible, une simple évaluation microscopique du sédiment (“biopsie du petit homme”). Toutefois, en cas de forte suspicion, il ne faut pas retarder les résultats de laboratoire qui ne sont pas disponibles rapidement, car il peut s’agir d’une forme rapidement progressive de maladie rénale. Il faut souligner ici la valeur d’un examen d’orientation par bandelette urinaire, disponible immédiatement.
Une augmentation significative de la créatinine sérique sur une période de quelques jours à quelques semaines, accompagnée d’une perte significative de la fonction rénale, est caractéristique d’une GN à progression rapide. Une fois qu’une cause post-rénale a pu être exclue par l’échographie, il faut toujours s’efforcer ici d’obtenir une prise en charge néphrologique rapide afin de réaliser des examens et des interventions spécifiques aux reins et de préserver ou de récupérer autant que possible la fonction rénale.
La détection et la quantification d’une PU sont très importantes pour la reconnaissance et l’évaluation d’une GN. En cas de résultat pathologique, une analyse d’urine par bandelette réactive doit être complétée par un dosage quantitatif des protéines et de la créatinine dans une urine de spot avec détermination du rapport protéine/créatinine (= protéine totale). [g/l]) / Créatinine [mmol/l]; Norme : <0,030 g/mmol), qui peut être facilement réalisée dans n’importe quel cabinet de médecine générale et qui n’est pas influencée par le niveau d’hydratation ou la quantité d’urine. Si le test à la bandelette est positif mais que la détection quantitative d’une PU est normale, une différence de concentration urinaire peut avoir entraîné une valeur inférieure à la limite de détection et doit être contrôlée. Cependant, si le test urinaire est négatif et qu’il y a une détection de protéines dans les protéines totales, il faut penser à l’excrétion de chaînes légères monoclonales dans l’urine (PU de Bence-Jones). Chez les patients atteints de diabète sucré, la détection d’une microalbuminurie dans les urines du matin (norme : <20 mg/l) est le paramètre de dépistage le plus sensible pour la présence d’une néphropathie diabétique. Il est parfois difficile de différencier une microalbuminurie, expression d’un dysfonctionnement endothélial, qui indique un risque cardiovasculaire accru, d’une maladie glomérulaire débutante. Par conséquent, en cas de détection d’une microalbuminurie, tous les signes cliniques disponibles doivent être utilisés pour établir un diagnostic différentiel.
La PU est soumise à des variations au cours de la journée, notamment en raison de l’activité physique et de la position du corps. Néanmoins, il a été démontré qu’une mesure matinale de la protéine et de la créatinine dans la spoturine était équivalente à une collecte de 24 heures pour déterminer la PU [2].
Une hématurie asymptomatique détectée pour la première fois, sans autre signe de syndrome néphritique ou néphrotique, doit être contrôlée dans un premier temps. Les hématuries asymptomatiques récurrentes ne sont dues à une glomérulopathie que dans environ 10 % des cas ; l’hématurie est beaucoup plus souvent due à une pathologie post-rénale des voies urinaires. Les érythrocytes d’origine glomérulaire sont probablement présents lorsque la proportion de formes dysmorphiques est égale ou supérieure à un tiers à l’examen microscopique des urines. En présence d’une érythrocyturie glomérulaire ou pour l’exclure, ainsi qu’en cas d’hématurie récidivante inexpliquée, il convient de procéder à un suivi néphrologique conjoint, car diverses glomérulopathies non inflammatoires peuvent également être présentes, comme le syndrome de la membrane basale glomérulaire mince, généralement bénin, ou encore le syndrome d’Alport, un défaut congénital de la chaîne α du collagène de type IV des membranes basales de l’oreille interne et du rein. Ce dernier se manifeste cliniquement dans l’enfance ou à l’âge adulte par une microhématurie ou une macrohématurie ainsi que par une surdité bilatérale de l’oreille interne, et une grande partie des personnes atteintes développent une PU jusqu’au stade néphrotique et une insuffisance rénale progressive.
Recommandations thérapeutiques
Un traitement peut être attribué à une thérapie différentielle sur la base de l’histologie pour les formes de GN sans déclencheur secondaire identifiable. La situation est plus complexe dans les formes secondaires, où, de manière pondérée, d’une part la maladie déclenchante doit être contrôlée, et d’autre part, dans certaines situations, un traitement anti-inflammatoire suffisant doit contrôler le processus inflammatoire secondaire afin de préserver la fonction rénale. Le traitement de la maladie sous-jacente, si elle est connue et peut être traitée, est toujours important, comme par exemple un contrôle adéquat de la glycémie en cas de néphropathie diabétique par le médecin généraliste ou le traitement de l’hépatite C en cas de GN membranoproliférative par l’hépatologue.
En outre, quelle que soit la maladie sous-jacente, il convient de toujours veiller à un bon contrôle de la pression artérielle afin de minimiser la progression des lésions glomérulaires à long terme. Sur la base des études disponibles, on peut actuellement recommander une pression artérielle cible de 120-140/70-90 mmHg. On ne sait pas actuellement si les patients atteints de maladies glomérulaires et ne souffrant pas de maladies coronariennes bénéficieraient de valeurs cibles de pression artérielle <120/70 mmHg en raison du peu de données disponibles [3]. Il est recommandé de laisser les patients contrôler et documenter leur pression artérielle à domicile, notamment parce que cela élimine la composante d’hypertension du cabinet. Les valeurs de pression artérielle mesurées à domicile qui se situent dans la plage cible doivent être objectivées par une mesure de la pression artérielle sur 24 heures, car c’est la seule façon d’exclure l’absence de baisse jour-nuit et l’absence de dipping.
Il existe des preuves qu’une réduction de la microalbuminurie et de la PU au moyen d’inhibiteurs de l’ECA peut être utilisée comme marqueur de substitution d’une néphroprotection supplémentaire. En cas d’intolérance aux inhibiteurs de l’ECA, les antagonistes des récepteurs de l’angiotensine (ARA) peuvent être utilisés comme alternative. La double inhibition du système rénine-angiotensine-aldostérone par les IEC et les ARA doit être réservée à la PU la plus sévère et peut entraîner une perte accélérée de la fonction rénale [4]. Il en va de même pour l’association de l’aliskiren, un inhibiteur de la rénine, avec un IEC ou un ARA, qui peut être utilisée chez les patients diabétiques ou présentant une fonction rénale réduite avec un taux de filtration glomérulaire <60ml/min/1,73 m² est contre-indiqué, car les études font craindre un risque accru de développer des hypotensions, des syncopes, des accidents vasculaires cérébraux, des hyperkaliémies et une détérioration de la fonction rénale, y compris une insuffisance rénale aiguë. Pour d’autres groupes de patients, des conséquences négatives d’un traitement combiné correspondant ne peuvent pas être exclues.
Les œdèmes néphrotiques sont traités par diurèse, mais il faut faire attention au risque accru de thrombose. S’il existe un apport excessif en sel de cuisine ou si les œdèmes restent réfractaires au traitement, une restriction sodée doit être mise en place. La “résistance aux diurétiques” peut être surmontée en associant les diurétiques de l’anse aux diurétiques thiazidiques, voire à la spironolactone.
En présence d’une hyperlipidémie prolongée, comme c’est souvent le cas chez les patients souffrant d’un syndrome néphrotique, l’utilisation d’une statine doit être envisagée. Une hypoalbuminémie de <25 g/l est considérée comme un marqueur de substitution d’un risque thrombogène accru en cas de PU néphrotique, de sorte qu’une anticoagulation devrait être instaurée. Il existe des directives néphrologiques, appelées “KDIGO Guidelines”, auxquelles il convient de se référer pour adapter précisément le traitement anticoagulant [5]. L’évaluation et la mise en place d’un traitement en cas d’hyperparathyroïdie secondaire due à une fonction rénale déjà nettement diminuée, ainsi qu’en cas d’anémie rénale, doivent être effectuées par le néphrologue.
Conclusion pour la pratique
- Le syndrome néphrotique se caractérise par une protéinurie (PU) sévère de >3 g/24 h et est associé à des œdèmes, une hypoalbuminémie, une hyperlipidémie et un risque thromboembolique accru.
- Le syndrome néphritique se caractérise par une hématurie, une oligurie, une hypertension artérielle ainsi qu’une insuffisance rénale et peut caractériser une GN rapidement progressive.
- Les lésions glomérulaires s’accompagnent de symptômes et de signes non spécifiques. Le dépistage des pathologies rénales par le médecin généraliste comprend donc toujours une mesure de la pression artérielle ainsi que des examens de la chimie du sang, de l’hémogramme et de l’urine.
- L’orientation vers un néphrologue doit se faire, entre autres, pour l’évaluation d’une insuffisance rénale, d’une hématurie récurrente ainsi que de la PU et en cas de suspicion de la présence d’une hypertension rénale.
- En cas d’augmentation rapide de la créatinine sérique, signe d’une perte de la fonction rénale, et si l’échographie exclut une cause postrénale, la fonction rénale doit être préservée ou récupérée par un diagnostic et un traitement néphrologiques rapides.
- Indépendamment de la maladie de base, le traitement d’une maladie glomérulaire comprend toujours le réglage de la pression artérielle autour de 120-140/70-90 mmHg selon les études actuelles et l’objectivation de la pression artérielle par une mesure de la pression artérielle sur 24 heures.
Dr. med. Nasser Dhayat
Prof. Markus Mohaupt, docteur en médecine
Littérature :
- Kidney Disease : Improving Global Outcomes (KDIGO) Groupe de travail sur la glomérulonéphrite. Guide de pratique clinique KDIGO pour la glomérulonéphrite. Chapitre 2 : Principes généraux de la prise en charge de la maladie glomérulaire. Kidney inter Suppl 2012;2:139-274.
- Price CP, et al : Use of protein:creatinine ratio measurements on random urine samples for prediction of significant proteinuria : a systematic review. Clin Chem 2005;51:1577-1586.
- Lignes directrices actuelles sur le traitement de l’hypertension artérielle de la Deutsche Hochdruckliga e.V. DHL, mise à jour 2011, dernière modification : 16.11.2011. www.hochdruckliga.de/tl_files/content/dhl/downloads/DHL-Leitlinien-2011.pdf
- Volpe M, et al : Inhibition of the renin-angiotensin-aldosterone system : is there a room for dual blockade in the cardiorenal continuum ? J Hypertens 2012;30:647-54.
- Jenette JC, Falk RJ : Syndromes clinicopathologiques glomérulaires. In : Greenberg A (ed.) : Abécédaire sur les maladies du rein. Philadelphie : Elsevier Saunders, 2009:149.
CARDIOVASC 2012 ; No. 5 ; 6-10