Le traitement du lymphome primaire du SNC a beaucoup évolué ces dernières années. L’espérance de vie des patients a augmenté. Le méthotrexate reste la base de tous les traitements d’induction. Dans la consolidation, la situation est un peu plus floue.
Les lymphomes primaires du SNC (LPNSC) sont des variantes extranodales des lymphomes non hodgkiniens qui se développent de manière limitée dans le cerveau, la moelle épinière, les leptoméninges ou les yeux et qui ne présentent pas d’atteinte systémique. Les PZNSL sont très agressives. Ils répondent généralement à la chimiothérapie et à la radiothérapie, avec une bonne chance de rémission. Toutefois, le risque de récidive est élevé et le pronostic est dans ce cas mauvais. Les PZNSL peuvent survenir dans un contexte d’immunosuppression (VIH/SIDA, congénital, après une transplantation d’organe) ou chez des patients immunocompétents. Ce résumé s’intéresse à ces derniers patients.
Épidémiologie et pronostic
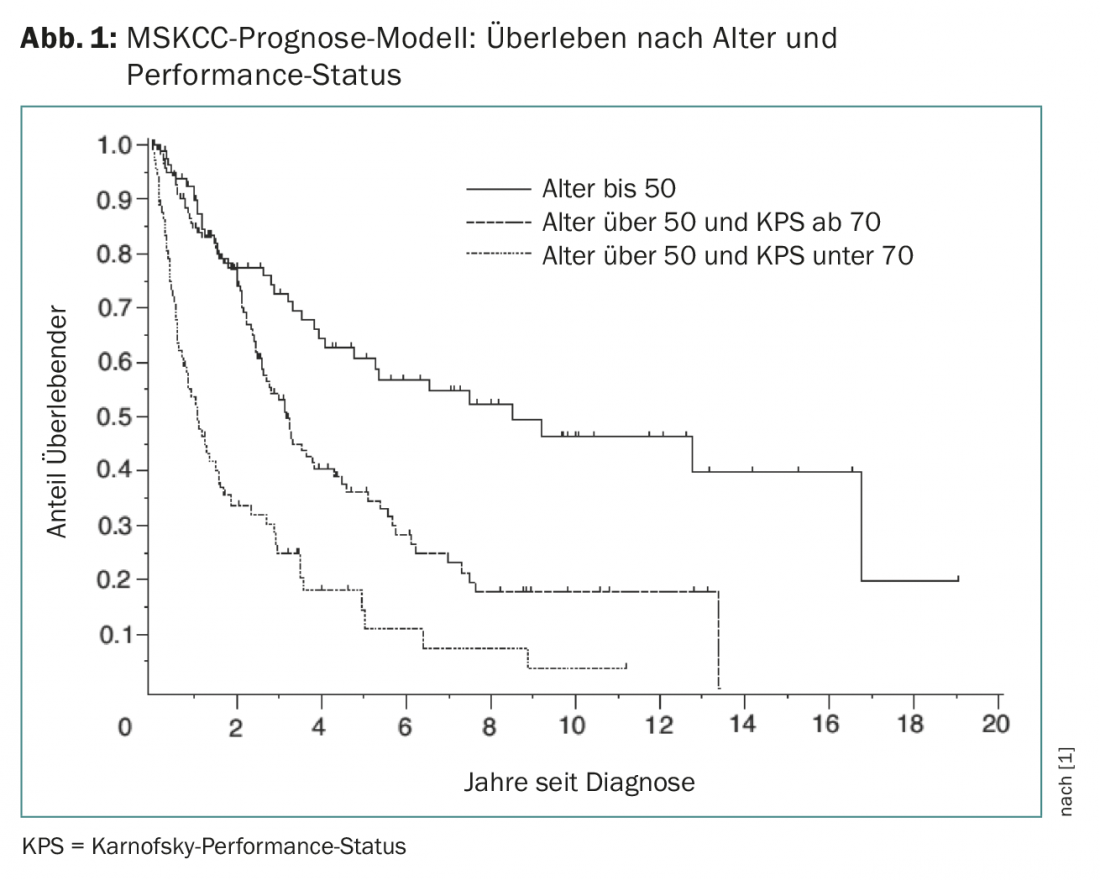
Le PZNSL est une maladie rare dont l’incidence est de 0,4 à 0,5 pour 100 000 par an. Il représente environ 4% de toutes les tumeurs cérébrales diagnostiquées et 4 à 6% de tous les lymphomes extranodaux et peut survenir dans tous les groupes d’âge. L’âge médian au moment du diagnostic est de 65 ans. Le modèle MSKCC (Memorial Sloan Kettering Cancer Center) peut prédire le résultat en fonction du statut de performance de Karnofsky et de l’âge (Fig. 1) [1].
Clinique
La clinique peut varier extrêmement en fonction du patient et de la localisation de l’atteinte dans le cerveau. Des déficits neurologiques focaux sont observés chez jusqu’à 70% des patients. Jusqu’à 43% des patients présentent des anomalies psychiatriques ou des troubles du comportement. Les signes d’une augmentation de la pression intracrânienne sont également fréquents. En cas d’atteinte des yeux (infiltration du vitré), les patients se plaignent dans 20 à 25% des cas d’une vision floue ou d’un manque de clarté.
Diagnostic et staging
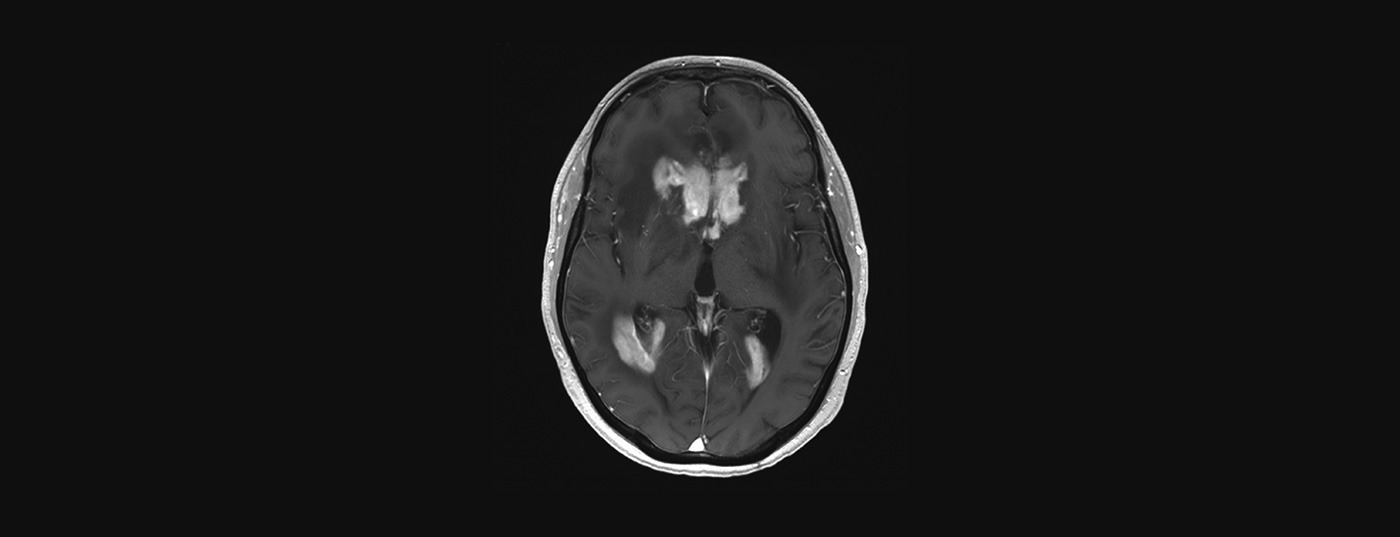
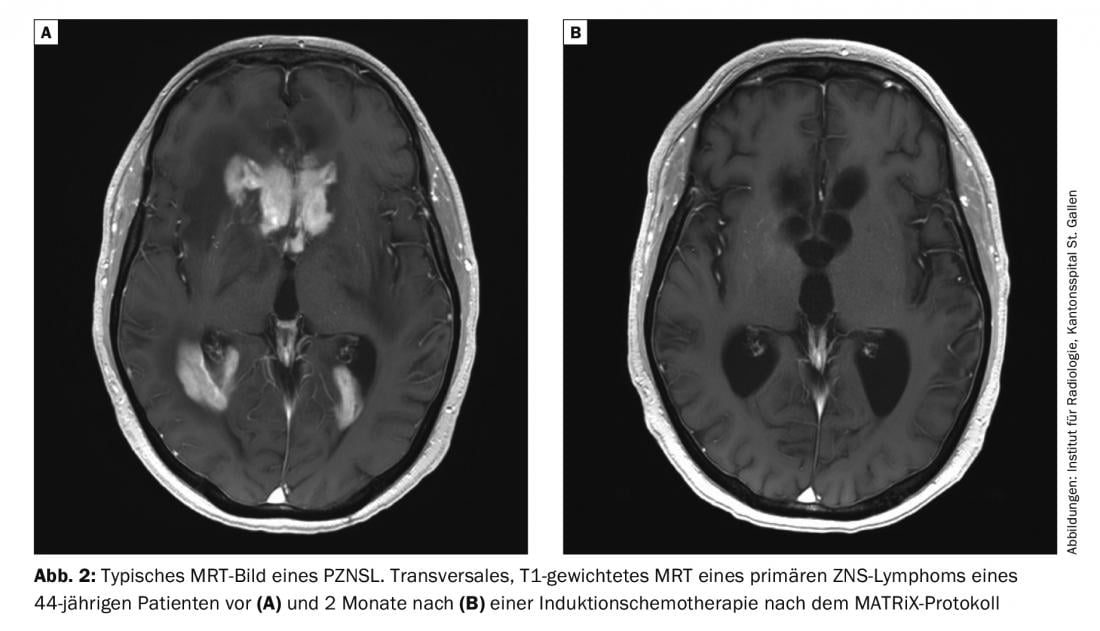
L’IRM avec ou sans contraste est l’examen de choix en cas de suspicion de PZNSL. Les lésions solitaires ou multifocales périventriculaires situées au centre sont typiques et apparaissent hyperintenses sur les images pondérées en T2 avec une prise de contraste homogène et une restriction de la diffusion (Fig. 2). Malgré le tableau clinique typique et l’imagerie IRM, le diagnostic final doit être confirmé par une biopsie cérébrale. Les stéroïdes sont lymphotoxiques et leur administration avant la biopsie peut conduire à un diagnostic faussement négatif. L’atteinte leptoméningée peut être présente dans jusqu’à 20% des cas et une ponction lombaire doit être réalisée, sauf contre-indication (pression intracrânienne), afin de déterminer le nombre de cellules, le taux de protéines, le glucose, la cytologie, la cytométrie en flux et le “réarrangement immunoglobulinique” clonal. Un examen des yeux à la lampe à fente fait également partie du bilan (même chez les patients sans troubles de la vision). Si le PZNSL est confirmé histologiquement, un staging doit être effectué avec une TEP corps entier. Toutefois, il faut au minimum exiger un scanner des poumons, du cou et de l’abdomen, ainsi qu’une échographie testiculaire si la TEP ne peut pas être réalisée. Une biopsie de la moelle osseuse doit également être effectuée. Un hémogramme, y compris un hémogramme différentiel, une LDH sérique et un dépistage du VIH font également partie du staging.
PZNSL nouvellement diagnostiqué
Le traitement moderne d’un PZNSL dépend de son âge, de ses antécédents médicaux et de son état général. En général, on commence par un traitement d’induction afin d’obtenir une rémission complète. Il est suivi d’un traitement de consolidation qui vise à éliminer la maladie microscopique résiduelle et à assurer une rémission de longue durée. En raison de l’absence d’études de phase III comparant les différents schémas thérapeutiques, différentes thérapies d’induction et d’entretien sont utilisées dans le monde entier. Tous ont cependant en commun la part obligatoire de méthotrexate (MTX). Les autres agents chimiothérapeutiques ainsi que le rôle et le moment de la radiothérapie sont parfois très controversés. Le MTX administré à des doses >1,5 g/m2 et en un temps de perfusion court franchit également la barrière hémato-encéphalique intacte (MTX à haute dose ; HD-MTX). Comme ces doses sont très toxiques pour les autres organes, la leucovorine doit impérativement être appliquée en même temps. La leucovorine inactive le MTX au niveau systémique, mais ne peut pas franchir la barrière hémato-encéphalique, assurant ainsi une concentration élevée de MTX dans le SNC. Le MTX en monothérapie (8 g/m2) présente des taux de réponse (“overall response rate”, ORR) de 74% [2]. L’utilité de la polychimiothérapie a été démontrée par Ferreri et al. dans une étude randomisée où l’utilisation de la cytarabine en plus du MTX a permis d’obtenir une survie sans progression (SSP) plus longue de 18 mois contre trois mois et un TRO de 69% contre 40% par rapport au bras standard [3].
Il est courant d’intégrer l’anticorps anti-CD20 rituximab dans une polychimiothérapie au MTX, même si cette grande molécule d’anticorps ne peut probablement franchir que la barrière hémato-encéphalique perturbée dans les lésions prenant le contraste et y exercer son effet de déplétion des cellules B. Une étude randomisée de 227 patients (IELSG32) a montré que le meilleur ROR peut être observé lorsque les patients sont traités par rituximab/thiotépa/HD-MTX/cytarabine (schéma MATRiX ; ROR 86%). A titre de comparaison, les combinaisons rituximab/HD-MTX/cytarabine ou HD-MTX/cytarabine ont atteint un TRO de 73% et 53% respectivement [4].
Le choix du traitement d’induction varie selon les régions et les médecins. Les traitements typiques consistent en rituximab/HD-MTX/procarbazine/vincristine (R-MVP), rituximab/HD-MTX, témozolomide/HD-MTX, MATRiX (voir ci-dessus) et rituximab/HD-MTX/téniposide/carmustine/méthylprednisolone (R-MVBP).
Ces schémas thérapeutiques sont généralement bien tolérés et même les patients âgés peuvent être traités avec ces traitements, tant que la fonction rénale est bien préservée. L’hépatite, l’insuffisance de la moelle osseuse et l’insuffisance rénale sont des effets secondaires possibles. La toxicité neurologique du MTX est décrite, notamment sous forme d’encéphalopathies aiguës ou subaiguës et de leuco-encéphalopathies multifocales qui se développent plusieurs mois ou années après l’administration du MTX.
Le rôle de la radiothérapie du cerveau entier (WBRT) reste controversé : une étude de phase III a montré qu’une WBRT de consolidation prolongeait la PFS de 12 à 18 mois, mais sans améliorer la survie (32,4 vs. 37 mois). Cependant, une neurotoxicité accrue a également été observée suite à l’irradiation [5]. Néanmoins, plusieurs groupes de travail continuent à travailler sur des schémas thérapeutiques impliquant une WBRT modifiée et surtout à dose réduite. La WBRT est de plus en plus remplacée par des schémas de consolidation avec chimiothérapie, dans la mesure où les fonctions organiques et l’état général du patient le permettent, en raison de sa neurotoxicité connue et irréversible. Une étude multicentrique portant sur 202 patients a montré des taux de réussite similaires pour les patients traités par étoposide/cytarabine à haute dose après un traitement d’induction R-MTX par rapport à une WBRT [6]. Des chimiothérapies myéloablatives plus agressives avec autogreffe de cellules souches (HCD-ASCT) peuvent être administrées à des patients plus jeunes et en bon état général. Deux études utilisant soit R-MVP soit HD-MTX/Thiotepa/Cytarabine comme schémas d’induction ont montré des taux de réponse élevés (>90%) et une SSP de >74 mois avec HCD-ASCT [7,8].
Plusieurs études rétrospectives n’ont pas montré d’avantage pour l’ajout d’une chimiothérapie intrathécale [9]. On estime que les doses de MTX >3 g/m2 atteignent déjà des concentrations de LCR cytotoxiques qui rendent l’administration intrathécale superflue et ne justifient plus l’effort plus important du traitement par des ponctions lombaires répétées et le risque d’infection qui en résulte.
Surveillance après le traitement
Comme le risque de récidive est élevé après un traitement de première ligne, les patients doivent être suivis régulièrement au cours de leur évolution. Outre un examen clinique et neurologique, une imagerie cérébrale par IRM doit être réalisée tous les trois mois pendant les deux premières années, puis tous les six mois. Après cinq ans, les contrôles peuvent avoir lieu chaque année.
Patients âgés
La prise en charge optimale des patients âgés atteints de PZNSL reste controversée. Ces patients présentent des problèmes spécifiques, généralement en raison de leurs comorbidités, d’un état général moins bon, de taux de complications plus élevés et du fait qu’ils répondent typiquement moins bien aux traitements. Une étude française a comparé deux méthodes de traitement chez des patients de plus de 70 ans. Cette étude a montré que le HD-MTX/procarbazine/vincristine/cytarabine était aussi bien toléré qu’un traitement moins agressif par HD-MTX et temozolomide. Cependant, l’ORR (82% vs. 71%) et la survie globale (31 vs. 14 mois) étaient meilleurs dans le premier groupe [10].
Traitement du PZNSL récidivant ou réfractaire
Bien que les taux de réponse après traitement d’induction soient tout à fait remarquables, 10 à 15% des patients restent réfractaires au traitement d’induction. En outre, 50% des patients qui ont répondu au traitement initial développent une récidive au cours de l’évolution. Le délai médian avant la récidive est de 10 à 18 mois [11]. En cas de récidive, le pronostic ultérieur est très mauvais. Au moment de la récidive, il convient de procéder à un nouveau staging clinique avec imagerie de l’ensemble de l’axe du SNC, à un examen ophtalmologique et à une TEP corps entier. Il convient de noter que jusqu’à 10% des patients atteints de PZNSL présentent une récidive systémique.
Il n’existe à ce jour aucun traitement standard pour cette situation. Le choix du traitement repose sur l’âge du patient, le statut de performance, la prise en compte des traitements précédents et de leur réponse, ainsi que la prise en compte des comorbidités. La réexposition au MTX peut être une option raisonnable, en particulier chez les patients qui ont montré une réponse initiale à long terme à un schéma d’induction contenant du MTX. Ce traitement a permis d’obtenir des TRO de 85 à 91% et des durées de survie médianes de 41 à 62 mois [12,13]. Des études prospectives avec d’autres agents chimiothérapeutiques, y compris le témozolomide, le pemetrexed, le topotecan ou le rituximab, ont montré des taux de réponse de 31-55% avec des taux médians de PFS de 1,6-5,7 mois. Chez les patients plus jeunes et en bon état général, la TCA-HCD peut être une option [14]. La WBRT reste une alternative pour les patients qui ne peuvent pas recevoir une chimiothérapie à haute dose ou qui sont en très mauvais état général. Des études rétrospectives avec WBRT montrent des taux de réponse de 74-79% et des durées de survie médianes de 10-16 mois [15]. Cependant, le symptôme principal des déficits cognitifs est souvent aggravé, de sorte qu’il convient d’évaluer très soigneusement les avantages et les risques de la WBRT. Il convient également d’envisager une abstention thérapeutique raisonnable chez les patients souffrant de lésions cérébrales graves.
De nouvelles stratégies thérapeutiques apparaissent également. Le ligand PD-1 (“programmed cell death” ; PDL-1) est dérégulé et surexprimé dans >50% des PZNSL. Les traitements avec des anticorps monoclonaux contre PD-1 ou PDL-1, comme le nivolumab ou le pembrolizumab, sont donc prometteurs. Une petite série de quatre patients atteints de PZNSL récidivant ou réfractaire a montré une PFS de 14 à 17 mois [16]. Des études prospectives sont actuellement en phase de recrutement. Le lénalidomide, un dérivé de la thalidomide, associé au rituximab, a montré des résultats positifs lors d’une présentation à l’ASCO Meeting 2016 par Rubenstein et al. également un ORR prometteur de 67%.
L’ibrutinib est un inhibiteur de la tyrosine kinase de Bruton, une partie centrale de la voie de signalisation des récepteurs des cellules B, qui présente souvent des mutations dans les PZNSL. L’ibrutinib traverse la barrière hémato-encéphalique et peut être mesuré dans le LCR à des doses thérapeutiques. Dans une petite série de PZNSL récidivantes, l’ibrutinib a montré un ORR de 77% avec un taux de PFS de 7,4 mois [17]. Une étude de phase I a combiné un traitement initial par ibrutinib avec une consolidation composée de temozolomide, d’étoposide, de doxorubicine liposomale, de dexaméthasone et de rituximab. Les patients de cette étude ont montré un ROR de 94% après ibrutinib, et 86% des patients ont ensuite atteint une rémission complète [18]. Cependant, l’ibrutinib entraîne un risque élevé d’aspergillose pulmonaire et cérébrale.
Littérature :
- Abrey LE, et al : Lymphome primaire du système nerveux central : le modèle pronostique du Memorial Sloan-Kettering Cancer Center. J Clin Oncol 2006 ; 24(36) : 5711-5715.
- Batchelor T, et al : Treatment of primary CNS lymphoma with methotrexate and deferred radiotherapy : a report of NABTT 96-07. J Clin Oncol 2003 ; 21(6) : 1044-1049.
- Ferreri AJ, et al : cytarabine à haute dose plus méthotrexate à haute dose versus méthotrexate à haute dose seul chez les patients atteints de lymphome primaire du SNC : un essai randomisé de phase 2. Lancet 2009 ; 374(9700) : 1512-1520.
- Ferreri AJ, et al : Chimio-immunothérapie avec méthotrexate, cytarabine, thiotépa, et rituximab (régime MATRix) chez les patients atteints de lymphome primaire du SNC : résultats de la première randomisation de l’International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol 2016 ; 3(5) : e217-227.
- Korfel A, et al : Étude randomisée de phase III de la radiothérapie du cerveau entier pour le lymphome primaire du SNC. Neurology 2015 ; 84(12) : 1242-1248.
- Rubenstein JL, et al : Chimiothérapie et immunothérapie intensives chez les patients atteints d’un lymphome primaire du SNC nouvellement diagnostiqué : CALGB 50202 (Alliance 50202). J Clin Oncol 2013 ; 31(25) : 3061-3068
- Omuro A, et al : R-MPV suivi d’une chimiothérapie à haute dose avec TBC et greffe de cellules souches autologues pour un lymphome primaire du SNC nouvellement diagnostiqué. Blood 2015 ; 125(9) : 1403-1410.
- Illerhaus G, et al : Chimiothérapie à haute dose avec transplantation autologue de cellules souches hémopoïétiques pour un lymphome primaire du SNC nouvellement diagnostiqué : un essai de phase 2, prospective et à bras unique. Lancet Haematol 2016 ; 3(8) : e388-397.
- Sierra Del Rio M, et al : Chimiothérapie intrathécale prophylactique dans le lymphome primaire du SNC. J Neurooncol 2012 ; 106(1) : 143-146.
- Omuro A, et al : Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population : an intergroup ANOCEF-GOELAMS randomised phase 2 trial. Lancet Haematol 2015 ; 2(6) : e251-259.
- Jahnke K, et al : Relapse of primary central nervous system lymphoma : clinical features, outcome and prognostic factors. J Neurooncol 2006 ; 80(2) : 159-165.
- Pentsova E, Deangelis LM, Omuro A : Methotrexate re-challenge for recurrent primary central nervous system lymphoma. J Neurooncol 2014 ; 117(1) : 161-165.
- Plotkin SR, et al : Treatment of relapsed central nervous system lymphoma with high-dose methotrexate. Clin Cancer Res 2004 ; 10(17) : 5643-5646.
- Soussain C, et al : Chimiothérapie intensive suivie d’un sauvetage de cellules souches hématopoïétiques pour lymphome primaire réfractaire et récidivant du SNC et intraoculaire : J Clin Oncol 2008 ; 26(15) : 2512-2518.
- Hottinger AF, et al : Salvage whole brain radiotherapy for recurrent or refractory primary CNS lymphoma. Neurology 2007 ; 69(11) : 1178-1182.
- Nayak L, et al : Blocage du PD-1 par le nivolumab dans les lymphomes primaires du système nerveux central et testiculaires en rechute/réfractaires. Blood 2017 ; 129(23) : 3071-3073.
- Grommes C, et al : Ibrutinib Unmasks Critical Role of Bruton Tyrosine Kinase in Primary CNS Lymphoma. Cancer Discov 2017 ; 7(9) : 1018-1029.
- Lionakis MS, et al : Inhibition de la signalisation du récepteur des cellules B par l’ibrutinib dans le lymphome primaire du SNC. Cancer Cell 2017 ; 31(6) : 833-843.e5.
InFo ONKOLOGIE & HÄMATOLOGIE 2018 ; 6(3) : 34-38