Le microbiome cutané des patients atteints de dermatite atopique (DA) présente une diversité bactérienne réduite. L’agent pathogène Staphylococcus aureus (S. aureus) est souvent dominant. Cette bactérie gram-positif renforce les processus inflammatoires et est associée aux poussées aiguës de la MA. Une étude de Clowry et al. publiée en 2024 dans JCI Insight. offre un aperçu des signatures immunitaires systémiques et cutanées associées à la MA pédiatrique infectée par S. aureus.
Pour l’étude de Clowry et al. 93 patients AD âgés de 0 à 16 ans ont été recrutés [6]. Parmi eux, 12 présentaient une infection cutanée à S. aureusconfirmée par des critères cliniques (“ADS.aureus”) [7]. Les critères cliniques comprenaient des suintements, des pustules, des abcès et/ou des croûtes, ainsi que des résultats d’écouvillonnage bactérien positifs. Les 46 autres patients atteints de DA ne remplissaient pas les critères cliniques pour le diagnostic d’une infection cutanée à S. aureus(groupe de contrôle DA). Le groupe de contrôle à la peau saine comprenait 35 participants qui ne présentaient pas d’infection cutanéeactive à S. aureusni d’antécédents d’atopie.
L’infection cutanée à S. aureusétait associée à une sévérité accrue de la MA
Des profils immunologiques systémiques ont été établis pour les 93 patients, ainsi que des profils immunologiques locaux de la peau pour un sous-groupe (n=69) [6]. Ce sous-groupe comprenait 9 patients “ADS.aureus”, 32 patients du groupe de contrôle AD et 28 témoins à la peau saine. “Les patients atteints d’ADS.aureus présentaient une sévérité plus élevée de la MA (score EASI moyen de 29,4-32 contre 14,8-15) par rapport au groupe témoin de la MA. En outre, un plus grand nombre de patients du groupe “ADS.aureus” présentaient un niveau élevé de colonisation par S. aureus, tant au niveau de la peau lésionnelle (67% et 37% respectivement) que de la peau non lésionnelle (30% et 5% respectivement). Tous les patients du groupe “ADS.aureus” présentaient des niveaux modérés ou élevés de S. aureus sur la peau lésionnelle, 60% avaient une colonisation de la peau non lésionnelle et 66% une colonisation nasale. En revanche, le groupe de contrôle AD ne présentait aucun signe clinique d’infection à S. aureus. Chez 51% de ces patients, S. aureus a été identifié sur la peau lésionnelle de la MA, chez 30% sur la peau non lésionnelle de la MA et 48% avaient une colonisation nasale. Les patients “ADS.aureus” étaient moins susceptibles de prendre des traitements systémiques immunomodulateurs (8-11% contre 41-46% dans le groupe témoin AD).
| La recherche sur le microbiome ajoute un niveau important à la connaissance des processus pathogéniques de la DA. Comme on le sait maintenant, le microbiote cutané peut influencer et moduler les réactions immunitaires dans la peau, et S. aureus semble jouer un rôle essentiel [1]. Alors que S. aureus n’est détecté sur une peau saine que dans <5% de tous les prélèvements, il est présent dans >90% des cas chez les enfants atteints de la MA [2]. La fonction de barrière de la peau, déjà affaiblie dans la DA, peut être encore plus affectée par S. aureus , car la bactérie possède des protéases qui réduisent encore l’intégrité de la barrière [3]. En effet, l’activité des protéases lui permet de pénétrer dans l’épiderme, ce qui entraîne une stimulation des cytokines Th2, de sorte que S. aureus peut être trouvé non seulement dans l’épiderme, mais également dans le derme des lésions de la DA [4]. De plus, S. aureus exprime une toxine α – une protéine porogène qui endommage la membrane cellulaire des kératinocytes [5]. |
Profils immunologiques des “ADS.aureus” vs. groupe témoin AD ?
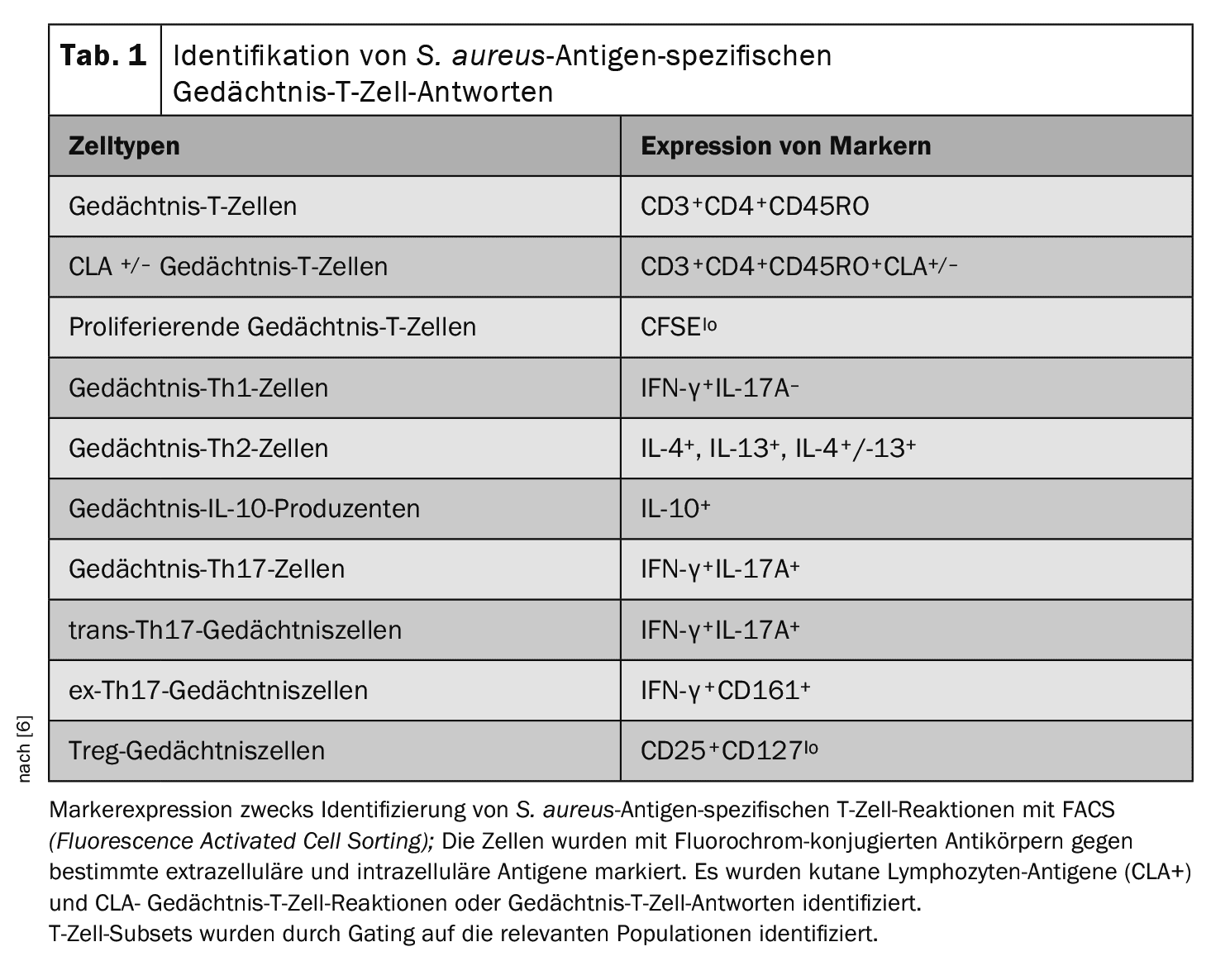
L’analyse initiale s’est concentrée sur l’ensemble des réponses des cellules T mémoires spécifiques de l’antigène “ADS.aureus” [6]. Le “homing” cutané sélectif des lymphocytes T mémoires et effecteurs est un processus immunologique important dans la physiopathologie de la MA. L’antigène associé aux lymphocytes cutanés (CLA) est un récepteur de “skin homing” qui définit un sous-groupe de cellules T mémoires circulantes Afin de mieux comprendre les réactions des cellules T mémoires spécifiques de l’antigène “ADS.aureus” dirigées vers la peau, le panel de coloration a été étendu pour inclure le CLA [8].
Caractérisation des lymphocytes T circulants et des réponses des lymphocytes T spécifiques à l’antigène S. aureusen relation avec les poussées infectées par S. aureus: Afin de déterminer si les différents phénotypes de lymphocytes T circulants et les réponses deslymphocytes T spécifiques à S. aureus sont différents, les chercheurs de l’étude “ADS” ontanalysé les réponses des lymphocytes T circulants . aureus“, le groupe témoin AD et les témoins à la peau saine, des cellules mononucléaires du sang périphérique (PBMC) ont été prélevées sur les 93 patients recrutés [6]. Les populations de leucocytes circulants ont été analysées afin d’évaluer la proportion de certains sous-ensembles de cellules T par coloration cytométrique de flux. Pour évaluer les réponses systémiques spécifiques à l’antigène S. aureus, l’ensemble des PMBC a été marqué avec de l’ester succinimidylique de carboxyfluorescéine (CFSE) et cultivé in vitro en présence de S. aureus (souche AD08) inactivé par la chaleur. Les cellules stimulées uniquement par le milieu ou par l’entérotoxine staphylococcique A (SEA) constituaient respectivement des témoins négatifs et positifs. Au jour 8, les cellules ont été collectées et colorées avec une série d’anticorps conjugués au fluorochrome contre des marqueurs de surface et intracellulaires (tableau 1). Le tri cellulaire activé par fluorescence (FACS) a été utilisé pour identifier les sous-ensembles de cellules T spécifiés.
Les proportions des sous-groupes de lymphocytes T systémiques circulants et des sous-ensembles de lymphocytes T mémoires spécifiques de l’antigène S. aureusidentifiés dans les trois groupes ont été introduites dans un modèle bayésien multinomial.
- Résultats de l’analyse : La caractéristique la plus susceptible de distinguer les “ADS.aureus” des témoins AD était les cellules T mémoires productrices d’IL-10, avec une probabilité moyenne de plus de 80%, suivies des cellules Th1 circulantes avec une probabilité moyenne de 75% et des cellules Vδ2+ circulantes avec une probabilité moyenne de 63%. Les autres caractéristiques distinctives étaient les cellules circulantes CD8+, CD4+, Vδ1+ et Th2, ainsi que les cellules mémoires ex-Th17 (un sous-groupe fonctionnellement différent de cellules Th17 qui ne produisent plus d’IL-17, mais de l’IFN-γ), dont la probabilité moyenne de distinction était comprise entre 50% et 60%.
- Afin de déterminer le caractère directionnel des caractéristiques les plus susceptibles d’être associées au TDA (>50%), des tracés circulaires ont été utilisés pour comparer les niveaux des huit variables les plus importantes chez le TDA par rapport aux témoins AD. Les IL-10+ mémorielles et les cellules Th1 circulantes étaient supprimées dans le groupe ADS.aureus par rapport au groupe témoin AD, tandis que les cellules Vδ2+ circulantes étaient augmentées dans le groupe ADS.aureus par rapport au groupe témoin AD. En outre, les cellules mémoires circulantes CD8+, CD4+ et ex-Th17 étaient également supprimées chez l’ADS.aureus, tandis que les cellules Th2 et Vδ1+ circulantes étaient augmentées.
Caractérisation des réponses des cellules T spécifiques à l’antigène de S. aureus dans la peau et des marqueurs locaux d’inflammation en relation avec les “flares” infectés par S. aureus: En ajoutant l’ALC au panel de coloration, les cellules T à mémoire spécifiques à l’antigène de S. aureusont pu être identifiées dans la peau [8]. CLA est une molécule d’adhésion spécifique à la peau et représente une modification post-traductionnelle du ligand 1 de la sélectine P (PSGL-1) [9]. L’épitope CLA se lie spécifiquement à la sélectine E sur l’endothélium des veinules post-capillaires et permet la migration sélective des lymphocytes T de la circulation périphérique vers le derme [10].
| Résumé |
| Dans la cohorte étudiée par Clowry et al. Dans la cohorte pédiatrique de la MA, l’infection cutanée à S. aureusétait le plus fortement associée à une augmentation des chimiokines cutanées IP10 et TARC, qui dirigent préférentiellement les cellules Th1 et Th2 vers la peau [6]. Les cellules T CD4+ et CD8+ systémiques, à l’exception des cellules Th2, ont été supprimées lors d’une infection cutanée à S. aureus, en particulier les cellules Th1 circulantes, les cellules T mémoires IL-10+ et les cellules mémoires Th17 résidant dans la peau. En outre, une expansion systémique des cellules T γδ a été observée chez les patients atteints d’une infection cutanée à S. aureus. |
| L’augmentation à la fois des cellules Th2 circulantes dans l’analyse du système pur et de la réponse mémoire IL-4+IL-13+ (Th2) spécifique de l’antigène S. aureusdans l’analyse combinée reflète la signature Th2 caractéristique de la MA [12] et renforcée par S. aureus [13,14]. |
| La réponse mémoire Th2 spécifique de l’antigèneCLA-IL-4+IL-13+ S. aureusavait une plus grande probabilité d’association avec “ADS.aureus”. Cela pourrait être dû au “homing” par la population CLA+IL-4+IL-13+. Il est intéressant de noter que seuls les lymphocytes T doubles producteurs d’IL-4 et d’IL-13 étaient constamment plus élevés chez le “ADS.aureus” par rapport au contrôle de la MA. |
| Les résultats de ce travail indiquent que l’augmentation des sous-ensembles protecteurs de cellules T est une stratégie thérapeutique potentielle pour réduire la dominance de S. aureusdans la MA. |
Des profils de cytokines de bandes de stratum corneum non lésionnelles ont également été établis pour identifier les réactions inflammatoires locales dans la peau [11]. Des profils de cytokines cutanées associés à des réactions antigéniques de S. aureusspécifiques à la peau étaient disponibles pour un sous-groupe de 69 patients et ont été analysés avec les profils de cellules T circulantes systémiques associés pour ces patients en utilisant le modèle multinomial bayésien.
- Résultats d’analyse : Comme précédemment, les résultats ont identifié à la fois des réactions immunitaires systémiques et cutanées médiées par les cellules T, qui ont permis de distinguer avec le plus haut degré de discrimination les “ADS.aureus”, les témoins AD et les témoins à la peau saine. L’ajout de réactions cutanées systémiques et de marqueurs de réponse inflammatoire cutanée a fait passer de 8 à 30 le nombre de caractéristiques qui distinguent avec une probabilité supérieure à 50% les ADS.aureus, les témoins AD et les témoins sains. Cela indique que l’ajout de ces caractéristiques supplémentaires permet de mieux comprendre les profils immunitaires locaux associés aux ADS.aureus.
Littérature :
- Lee HJ, Kim M : Fonction de la barrière cutanée et le microbiome. Int J Mol Sci 2022 Oct 28 ; 23(21) : 13071. doi : 10.3390/ijms232113071.
- Schöfer H, et al. : S2k + IDA Leitlinie : Diagnostik und Therapie Staphylococcus aureusbedingte Infektionen der Haut und Schleimhäute. 2011. https://dgpi.de/wp-content/uploads/2013/04/013-038l_S2k_
Staphyococcus_aureus_2011-09.pdf, (dernière consultation 02.08.2024). - Fölster-Holst R : Le rôle du microbiome cutané dans la dermatite atopique – liens et conséquences. JDDG 2022 ; 20(5) : 571-578.
- Nakatsuji T, et al : Staphylococcus aureus exploite les défauts de la barrière épidermique dans la dermatite atopique pour déclencher l’expression de cytokines. J Invest Dermatol 2016 ; 136 : 2192-2200.
- Brauweiler AM, Goleva E, Leung DYM : Th2 cytokines increase Staphylococcus aureus alpha toxin-induced keratinocyte death through the signal transducer and activator of transcription 6 (STAT6). J Invest Dermatol 2014 ; 134 : 2114-2121.
- 6. Clowry J, et al : Distinct T cell signatures are associated with Staphylococcus aureus skin infection in pediatric atopic dermatitis. JCI Insight 2024 avr 11 ; 9(9) : e178789.
- Alexander H, et al : The role of bacterial skin infections in atopic dermatitis : expert statement and review from the International Eczema Council Skin Infection Group. Br J Dermatol 2020 ; 182(6) : 1331-1342.
- de Jesús-Gil C, et al : The translational relevance of human circulating memory cutaneous lymphocyte-associated antigen positive T cells in inflammatory skin disorders. Front Immunol. 2021 ; 12 : 652613. doi : 10.3389/fimmu.2021.652613.
- Fuhlbrigge RC, et al : L’antigène lymphocytaire cutané est une forme spécialisée de PSGL-1 exprimée sur les cellules T de la peau. Nature 1997 ; 389(6654) : 978-981.
- Czarnowicki T, et al. Cellules T CLA+ circulantes dans la dermatite atopique et leur rôle possible en tant que biomarqueurs périphériques. Allergy 2017 ; 72(3) : 366-372.
- Andersson AM, et al : Assessment of biomarkers in pediatric atopic dermatitis by tape strips and skin biopsies. Allergy 2022;77(5):1499-1509.
- Czarnowicki T, et al : Atopic dermatitis endotypes and implications for targeted therapeutics. JACI 2019 ; 143(1) : 1-11.
- Karauzum H, Datta SK : Immunité adaptative contre le staphylocoque doré. Curr Top Microbiol Immunol 2017 ; 409 : 419-439.
- Geoghegan JA, et al : Staphylococcus aureus et la dermatite atopique : une relation complexe et évolutive. Trends Microbiol 2018 ; 26(6) : 484-497.
DERMATOLOGIE PRATIQUE 2024 ; 34(4) : 26-27