Les médicaments à faible marge thérapeutique, tels que ceux utilisés en oncologie, nécessitent des connaissances de base sur les interactions possibles avec d’autres produits. La pharmacodynamie et la pharmacocinétique ne devraient pas être des mots étrangers.
L’utilisation sûre des médicaments implique la connaissance des interactions médicamenteuses potentiellement graves. En oncologie notamment, on utilise souvent des substances à faible marge thérapeutique. Les concentrations infra-thérapeutiques, qui présentent un risque d’échec du traitement, et les concentrations supra-thérapeutiques, qui présentent des effets indésirables potentiels, doivent être soigneusement évitées. Une connaissance de base de la pharmacodynamique et de la pharmacocinétique des médicaments fréquemment utilisés – notamment en relation avec les traitements oncologiques oraux administrés quotidiennement tels que les inhibiteurs de tyrosine kinase ou de checkpoint – est une condition préalable pour anticiper ou reconnaître les interactions cliniquement importantes et indésirables. La gestion des interactions médicamenteuses implique, en fonction de l’évaluation du rapport bénéfice/risque, une réduction de la dose, une administration différée ou l’arrêt d’au moins un des partenaires de l’interaction. Cet article de formation continue présente une vue d’ensemble des interactions médicamenteuses pertinentes, illustrée par des cas cliniques sélectionnés et un accent particulier sur les substances oncologiques.
Contexte pharmacologique
L’utilisation sûre des médicaments implique la connaissance des interactions médicamenteuses potentiellement graves. En oncologie notamment, les substances utilisées ont souvent un profil pharmacologique complexe, une courbe dose-réponse/toxicité abrupte, des différences pharmacocinétiques et pharmacodynamiques en fonction de la population (variabilité inter-patients) et une faible marge thérapeutique. Tout cela signifie que la marge entre les concentrations thérapeutiques et les niveaux d’agents potentiellement toxiques est souvent faible.
Un “trop” peut déjà entraîner des effets indésirables graves. Les effets sont les mêmes que ceux d’une intoxication. Ce n’est pas la dose qui fait le poison, mais la concentration dans le corps ! Tous les processus qui conduisent à une augmentation correspondante peuvent ainsi avoir pour conséquence des symptômes de l’effet renforcé – de manière analogue à l’intoxication. Des interactions indésirables peuvent même avoir des conséquences fatales, comme l’ont montré par exemple les associations d’antiviraux comme la sorivudine avec des analogues du fluorouracile par voie orale (par exemple la capécitabine).
Un “trop peu peut” signifier une perte d’activité, ce qui peut être associé à un moins bon pronostic. C’est précisément dans ce cas que les facteurs d’influence sont difficiles à saisir cliniquement – diagnostic différentiel : non-répondeur ! Un patient décède plus tôt de sa maladie oncologique que la moyenne statistique. Cependant, un inducteur administré entraîne également une réduction des effets secondaires associés à la chimiothérapie, qui sont principalement liés à la dose.
Les patients multimorbides et polypharmaciens présentent déjà une vulnérabilité accrue aux interactions médicamenteuses. D’autres facteurs de risque sont les dysfonctionnements d’organes, en particulier l’insuffisance rénale, l’utilisation d’inducteurs ou d’inhibiteurs enzymatiques et les constellations à risque avec de nombreux médecins impliqués. Le groupe des patients gériatriques est particulièrement vulnérable aux interactions en raison de certaines particularités, en termes de pharmacocinétique (modification de la biodisponibilité, diminution de la clairance et des fonctions organiques, hypalbuminémie, réduction du volume extracellulaire, augmentation de la proportion de tissu adipeux), de polypharmacie et d’observance des médicaments. Chez les patients âgés en particulier, la fonction rénale peut sembler meilleure qu’elle ne l’est en raison du débit de filtration glomérulaire (DFGe) calculé, si l’immobilité et la masse musculaire réduite entraînent de faibles concentrations de créatinine dans le sang. Il est alors recommandé de réduire la dose, en particulier pour les substances éliminées par voie rénale.
Les interactions médicamenteuses peuvent en principe être classées en interactions pharmacocinétiques ou pharmacodynamiques.
La pharmacocinétique décrit l’effet du corps sur la substance – en termes d’absorption, de distribution, de métabolisation et d’excrétion d’un médicament.
Les interactions pharmacocinétiques peuvent se produire à n’importe quel niveau de l’ADME (absorption, distribution, métabolisme, élimination), par exemple
Absorption : interférence de substances dans le tractus intestinal avec complexification et diminution consécutive de l’absorption.
Focus particulier sur les substances et groupes de substances oncologiques : Interactions avec les médicaments supprimant l’acidité (inhibiteurs de la pompe à protons, antagonistes H2, antiacides) : Ex. Inhibiteurs de tyrosine kinase : crizotinib, dasatinib, erlotinib, gefitinib, lapatinib, pazopanib. Il est préférable d’éviter ces combinaisons ou de les espacer dans le temps.
- Distribution : interférence due à un déplacement de la liaison aux protéines plasmatiques avec augmentation du volume de distribution dont la pertinence clinique est discutable. La fraction libre non liée d’une substance médicamenteuse est considérée comme la partie pharmacologiquement active.
- Métabolisme : interférence dans le métabolisme avec induction ou inhibition des enzymes correspondantes, avec pour conséquence une accélération ou une inhibition du métabolisme.
En particulier, les substances et groupes de substances oncologiques : Un exemple de substrats du cytochrome (CYP) serait la classe des inhibiteurs de la tyrosine kinase (ITK), qui sont tous métabolisés dans une certaine mesure par le CYP3A4. Interactions avec des inhibiteurs puissants du CYP3A4 (par ex. kétoconazole, voriconazole, itraconazole) et des inducteurs puissants du CYP3A4 (par ex. rifampicine, enzalutamide) et les ITK : axitinib, crizotinib, dasatinib, erlotinib, gefitinib, imatinib, lapatinib, nilotinib, pazopanib, regorafenib, ruxolitinib, sunitinib, vemurafenib. L’utilisation concomitante doit être évitée ou accompagnée d’ajustements de la dose des substrats (ITK).
- Elimination : interférence lors de l’élimination avec compétition pour les mécanismes de transport avec retard consécutif de l’élimination et accumulation possible dans l’organisme.
Focus sur les substances et groupes de substances oncologiques : Des exemples de substances oncologiques éliminées par voie rénale sont la bendamustine, la bléomucine, le carboplatine, le cisplatine, l’oxaliplatine, le cyclophosphamide, le méthotrexate, le pemetrexed, le topotécan. Les salicylates, le probénécide ou les sulfamides peuvent entrer en compétition pour la sécrétion tubulaire rénale lorsqu’ils sont utilisés en même temps que le méthotrexate, ce qui entraîne une réduction de l’élimination et donc une augmentation de la concentration du méthotrexate.
Les interactions pharmacocinétiques entraînent une modification des taux plasmatiques des substances, ce qui peut se traduire par une diminution ou une augmentation de leur effet. Des représentants de la famille des enzymes cytochrome P450, des transporteurs de médicaments tels que la glycoprotéine P ou des transporteurs d’ions organiques sont souvent impliqués. Le tableau 1 présente des exemples d’inducteurs et d’inhibiteurs du CYP3A4 couramment utilisés.
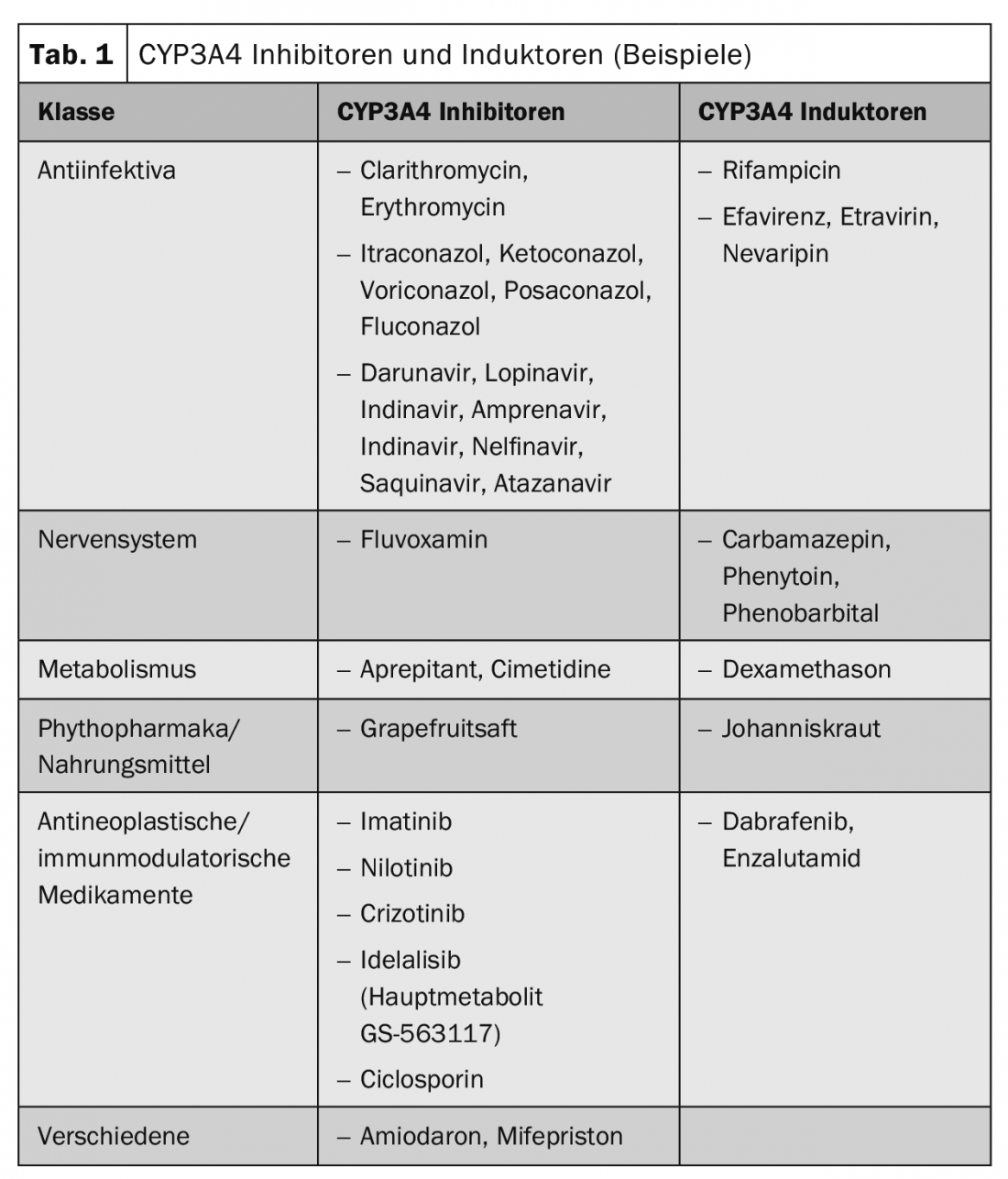
Focus particulier sur les substances et groupes de substances oncologiques : Le tamoxifène est lui-même une prodrogue activée par le CYP2D6. Il convient donc d’être particulièrement prudent avec les inhibiteurs de cette isoenzyme. Le tamoxifène est métabolisé en son métabolite actif, l’endoxifène, avec la participation du CYP2D6. Le CYP3A4 et, dans une moindre mesure, le CYP2C9 et le CYP2C19 sont également impliqués dans le métabolisme du tamoxifène. Les inhibiteurs du CYP2D6 peuvent donc affecter le métabolisme du tamoxifène de manière cliniquement significative, entraînant une réduction de l’efficacité ou une perte d’efficacité du tamoxifène. L’administration concomitante d’inhibiteurs du CYP2D6, tels que la paroxétine, a entraîné une réduction des concentrations plasmatiques du métabolite actif endoxifène pouvant atteindre 75% dans des études publiées. L’utilisation simultanée d’inhibiteurs du CYP2D6 (comme la paroxétine, la fluoxétine) avec le tamoxifène doit donc être évitée. En revanche, l’antidépresseur venlafaxine ne serait pas un inhibiteur du CYP2D6.
Inversement, les médicaments oncologiques eux-mêmes peuvent être non seulement des substrats pour les enzymes CYP, mais aussi des inhibiteurs ou des inducteurs pour les isoenzymes.
Focus particulier sur les substances et groupes de substances oncologiques : L’idélalisib, un inhibiteur de la phosphatidylinositol-3-kinase, est transformé en son principal métabolite, le GS-563117, qui est un puissant inhibiteur du CYP3A. La réaction du marqueur CYP3A4 avec le midazolam a montré une augmentation de 140% de la Cmax et de 440% de l’AUC du midazolam. Il existe donc un risque d’interaction avec d’autres médicaments métabolisés par le CYP3A4, tels que le Clostridium. Ciclosporine, sirolimus, tacrolimus, amlodipine, carbamazépine, colchicine, diltiazem, félodipine, fentanyl, kétoconazole, itraconazole, posaconazole, voriconazole, lidocaïne, méthadone, nifédipine, nicardipine, trazodone, warfarine, le phenprocoumon, le bocéprévir, le télaprévir, la clarithromycine, la télithromycine, l’atorvastatine, le tadalafil, la buspirone, le clorazépate, le diazépam, l’estazolam, le flurazépam, le zolpidem ou encore les inhibiteurs de tyrosine kinase comme l’erlotinib. L’association avec l’idélalisib nécessite par exemple une réduction de la dose d’erlotinib, qui doit alors être diminuée par paliers de 50 mg selon l’information professionnelle. La dose recommandée d’erlotinib est généralement de 150 mg une fois par jour, au moins une heure avant ou deux heures après le repas.
D’autres voies de dégradation ou de transformation indépendantes du cytochrome P450 sont également connues. Là encore, certaines interactions cliniquement pertinentes sont possibles.
Focus particulier sur les substances et groupes de substances oncologiques : Le fluorouracile est principalement métabolisé dans le foie en produits inactifs, notamment en dioxyde de carbone, en urée et en α-fluoro-β-alanine (FBAL). L’enzyme dihydropyrimidine déshydrogénase (DPD), pour laquelle un polymorphisme génétique est connu, est impliquée dans le métabolisme. Le métabolisme du fluorouracile est ralenti chez les patients présentant une insuffisance de la dihydropyrimidine déshydrogénase (DPD). C’est également l’objet d’une procédure en cours de l’Agence européenne des médicaments (EMA), qui examine les méthodes de dépistage existantes du déficit en DPD. Mais certaines substances peuvent également inhiber la DPD de manière irréversible. Médicaments contenant du fluorouracile, comme par exemple les médicaments à base d’acide acétique. La capécitabine ou le tegafur (promédicaments du 5-FU), ne doivent pas être utilisés avec la brivudine ou des substances chimiquement apparentées comme la sorivudine. L’inhibition de l’enzyme peut entraîner une augmentation de la toxicité des produits 5-FU, ce qui peut être potentiellement fatal. Un intervalle d’au moins 4 semaines doit être respecté entre un traitement par brivudine, sorivudine ou analogues et le début d’un traitement par produits 5-FU.
La pharmacodynamie décrit d’autre part l’effet de la substance sur l’organisme.
Dans ce type d’interaction, l’activité pharmacologique de la substance concernée est influencée, sans modification de la concentration au site d’action, par la combinaison avec une substance ayant une action similaire ou opposée, ce qui se traduit soit par une augmentation soit par une diminution de l’effet thérapeutique. Cela ne modifie pas les concentrations dans le sang. Le suivi thérapeutique des médicaments (TDM) avec détermination des taux plasmatiques n’apporte donc pas d’informations supplémentaires dans ce cas. Par exemple, différentes substances, ainsi que des substances oncologiques classiques (par exemple, les anthracyclines), peuvent allonger l’intervalle QTc. Ces modifications de l’ECG sont également fréquemment rapportées pour les inhibiteurs de tyrosine kinase. Le potentiel dépend de la structure chimique et de la concentration plasmatique de la substance. Par conséquent, l’allongement de l’intervalle QTc peut être encore plus important en cas d’association avec des inhibiteurs du CYP, mais aussi en cas d’utilisation simultanée de différents médicaments qui influent sur l’intervalle QTc.
Focus particulier sur les substances et groupes de substances oncologiques : Exemples d’inhibiteurs de tyrosine kinase qui interagissent avec des substances allongeant l’intervalle QTc : Crizotinib, Gefitinib, Lapatrinib, Nilotinib, Pazopanib, Sorafenib, Sunitinib, Vandetanib, Vemurafenib. Si des combinaisons spéciales sont cliniquement nécessaires, des contrôles ECG sont recommandés avant même le début du traitement, puis au fur et à mesure de son déroulement.
Les interactions substance-substance (“drug-drug”) sont particulièrement importantes, car elles peuvent être prédites par des rapports de cas antérieurs, des études cliniques ou la compréhension des principes pharmacologiques. Les interactions médicamenteuses indésirables peuvent avoir des conséquences allant jusqu’à mettre la vie en danger, ce qui peut entraîner le retrait du marché de substances même bien établies.
Les interactions pharmaceutiques, en tant qu’incompatibilités physico-chimiques entre deux substances à l’extérieur du corps, peuvent entraîner une complexation, une dégradation ou une précipitation. Ils ne font toutefois pas l’objet de cet aperçu.
Outre les interactions “drug-drug” entre différents médicaments, il existe également des interactions “drug-herb” (par exemple avec le ginkgo, le ginseng, l’ail), des interactions “drug-food” (par exemple avec le lait, le jus de pamplemousse), des interactions “drug-alcohol” (par exemple avec les benzodiazépines et de nombreuses autres substances sédatives), ou des interactions “drug-disease” (par exemple métoclopramide et maladie de Parkinson). Des interactions avec d’autres substances et des substances exogènes, comme le tabac, sont également possibles. Les composants du tabac entraînent une induction du CYP1A1 et du CYP1A2 chez les fumeurs.
Focus particulier sur les substances et groupes de substances oncologiques : Étude de cas sur le tabac et l’erlotinib : par exemple, l’erlotinib est métabolisé par les isoenzymes CYP3A4 et CYP1A2 dans le foie et peut-être par le CYP1A1 dans les poumons. Il en résulte une réduction de 50 à 60% de l’exposition à l’erlotinib chez les fumeurs. Dans une étude pharmacocinétique, l’exposition était de la moitié à un tiers de celle observée chez les non-fumeurs ou les ex-fumeurs, en raison de l’induction du CYP1A1 dans les poumons et du CYP1A2 dans le foie. C’est pourquoi il convient de recommander en outre aux fumeurs d’arrêter de fumer.
Les interactions, en particulier en oncologie où de nombreuses thérapies combinées sont utilisées, sont également souhaitables. Mais les interactions médicamenteuses sont également responsables, selon les études, de 20 à 30% des effets indésirables des médicaments, dont une grande partie devient cliniquement significative. Plus le nombre de médicaments administrés est élevé, plus le potentiel d’interactions médicamenteuses indésirables augmente. Ils sont associés à une augmentation de la morbidité et de la mortalité, à une prolongation de l’hospitalisation des patients concernés et à une augmentation des coûts des soins de santé. Si une partie des interactions médicamenteuses et des effets secondaires indésirables ne sont pas prévisibles, beaucoup peuvent être anticipés et évités.
Cas pratiques
L’interaction pharmacocinétique : chimiothérapie et traitement antirétroviral : un homme de 63 ans, déjà infecté par le VIH depuis de nombreuses années avec un traitement antirétroviral approprié et une maladie coronarienne à 3 vaisseaux, présente désormais des masses floues dans la tête du pancréas. En cas de cancer de la tête du pancréas avéré, une chimiothérapie à base de gemcitabine et de nab-paclitaxel doit être évaluée afin de déterminer les interactions avec le traitement existant (tableau 2).
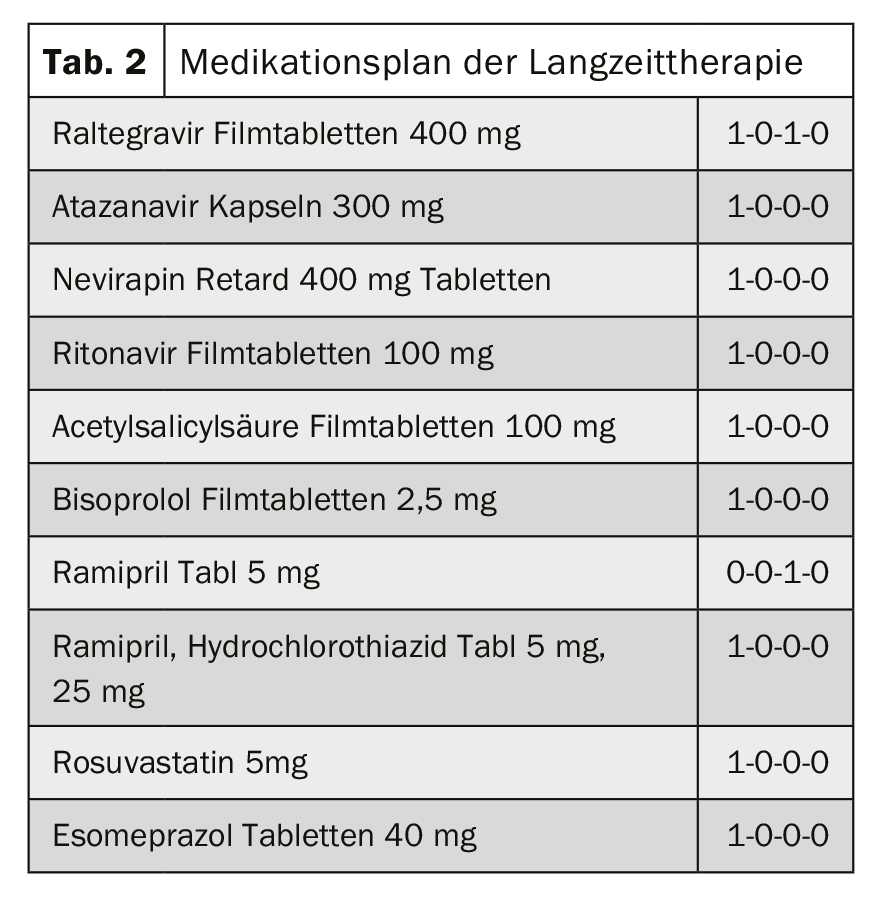
Évaluation et contexte : Le nab-paclitaxel est un agent antimicrotubulaire. Le nab-paclitaxel est métabolisé via le CYP2C8 et le CYP3A4. Les médicaments qui induisent ou inhibent le système enzymatique CYP (CYP2C8 et/ou CYP3A4) peuvent donc influencer les taux plasmatiques de nab-paclitaxel et donc son efficacité.
- Interaction nab-paclitaxel et ritonavir : le ritonavir est un puissant inhibiteur du CYP2C8 et du CYP3A4. La forte inhibition de ces enzymes peut également entraîner une augmentation des taux plasmatiques de nab-paclitaxel.
- Interaction paclitaxel et atazanavir : l’atazanivir est un puissant inhibiteur du CYP3A4 et un faible inhibiteur du CYP2C8. La forte inhibition du CYP3A4 peut entraîner une augmentation des taux plasmatiques de nab-paclitaxel. La faible inhibition du CYP2C8 devrait jouer un rôle plutôt mineur – mais pourrait s’additionner à d’autres interactions. Bien que ces interactions ne soient pas formellement prouvées par des études pharmacocinétiques, des déductions théoriques permettent de supposer une augmentation de l’effet et du risque d’effets secondaires liés à la dose.
Sur la base de déductions théoriques, les interactions pharmacocinétiques de l’atazanavir et du ritonavir avec le nab-paclitaxel peuvent entraîner une augmentation des taux plasmatiques de l’agent antimicrotubulaire. En cas de traitement combiné, il faudrait s’attendre à des effets médicamenteux indésirables du nab-paclitaxel dépendant de la concentration, tels qu’une dépression de la moelle osseuse, une mucosite et une neuropathie périphérique. En raison de la marge thérapeutique étroite de la chimiothérapie, de la myélotoxicité comme complication potentiellement mortelle et de plusieurs voies de dégradation du paclitaxel qui seraient inhibées, il est recommandé de changer de partenaire de combinaison atazanavir/ritonavir et nab-paclitaxel.
L’interaction pharmacodynamique : inhibiteur de point de contrôle & “immunomodulateurs”/immunosuppresseurs [7] : Une patiente de 53 ans, ayant subi une transplantation hépatique il y a 36 mois en raison d’un carcinome hépatocellulaire sur la base d’une cirrhose du foie et d’une infection chronique par l’hépatite C, reçoit comme traitement immunosuppresseur de la prednisone, du mycophénolate et de l’évérolimus. En raison d’une récidive du CHC avec des métastases deux ans après la transplantation, le sorafenib est administré. En raison des effets secondaires et de la progression de la maladie sous-jacente, ce traitement est à nouveau arrêté au bout de deux mois. Le nivolumab à une dose de 200 mg (3 mg/kg de poids corporel) est commencé. En conséquence, les paramètres de la fonction hépatique augmentent après une semaine. Une biopsie du foie est effectuée, qui présente des signes de rejet cellulaire aigu. Il est ensuite traité avec du tacrolimus et de la méthylprednisone 500 mg/jour. Il s’ensuit une nouvelle détérioration de la fonction hépatique, de l’état clinique, une dépression du SNC en cas d’hémorragie intracérébrale nécessitant des soins intensifs et, finalement, une issue fatale.
Évaluation et contexte : Les inhibiteurs de points de contrôle immunitaire tels que le nivolumab ont révolutionné le traitement de plusieurs maladies tumorales. Le nivolumab (Opdivo®) est un anticorps monoclonal humain IgG4 qui bloque les récepteurs PD-1 sur les lymphocytes T activés, les lymphocytes B et les cellules T tueuses naturelles, les monocytes et les cellules dentritiques. Les récepteurs PD-1 ont 2 ligands, PD-L1 et PD-L2, qui sont exprimés sur les cellules tumorales et les cellules présentatrices d’antigènes. La liaison du récepteur aux ligands entraîne une régulation négative des lymphocytes T et une prévention de la réponse des lymphocytes T. L’empêchement de la liaison entraîne une réponse des cellules T et un effet anti-tumoral. D’autre part, la tolérance immunitaire en cas de transplantation d’organes est essentielle pour ce patient. La transduction des signaux PD-1 et CTLA-4 entraîne une tolérance immunitaire. Par conséquent, l’inhibition peut déclencher une défaillance d’organe à médiation immunitaire chez ces patients.
Selon l’information professionnelle suisse, “le traitement par nivolumab ou par nivolumab en association avec l’ipilimumab ne doit pas être repris pendant que le patient reçoit des doses de corticostéroïdes immunosuppresseurs ou un autre traitement immunosuppresseur”. De même, “l’utilisation de corticostéroïdes systémiques et d’autres immunosuppresseurs avant le début du traitement par nivolumab doit être évitée en raison de leur possible interférence avec l’activité pharmacodynamique”. Sur la base de considérations pharmacodynamiques, cette interaction peut être pertinente dans les deux sens : Une diminution de l’effet immunosuppresseur des médicaments importants après la transplantation, mais aussi une diminution de l’effet anti-tumoral des inhibiteurs de points de contrôle.
Approche clinique des interactions médicamenteuses
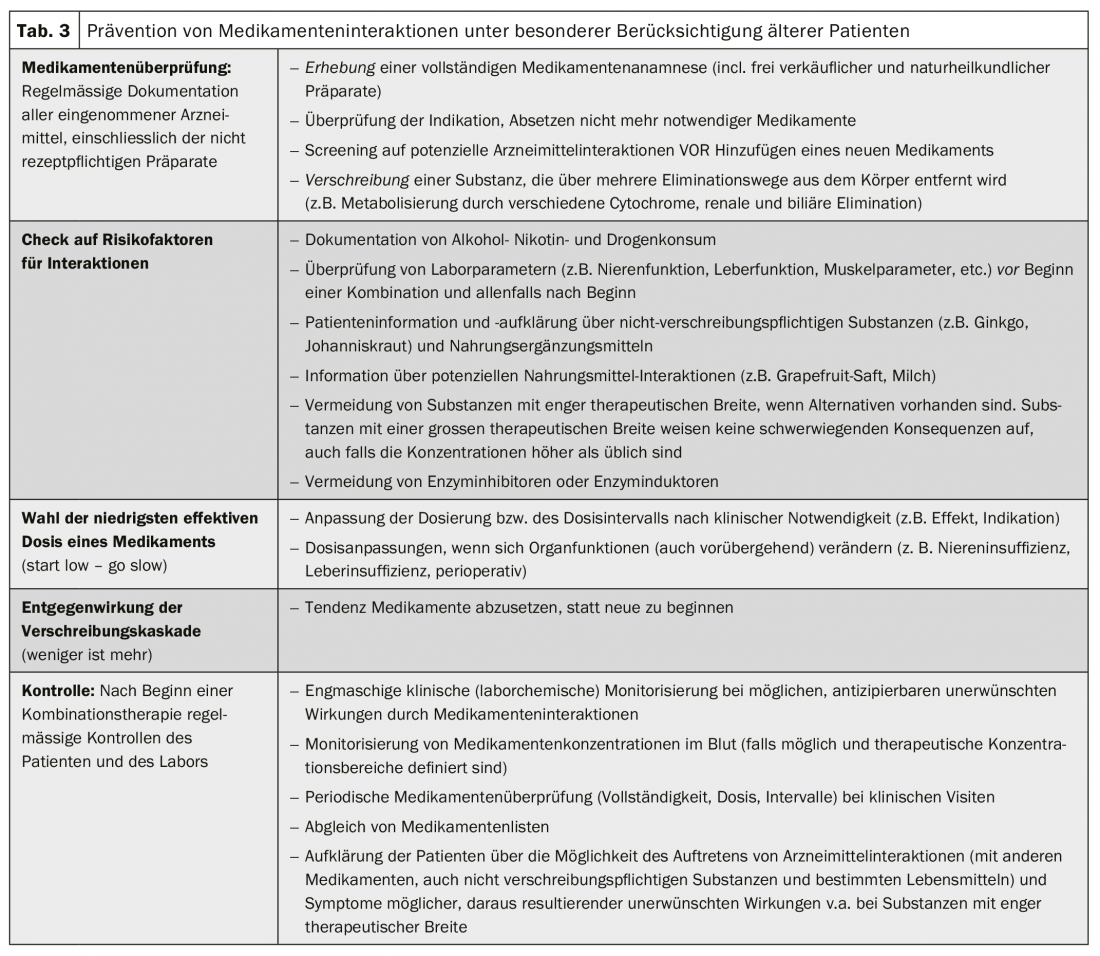
Les interactions médicamenteuses peuvent entraîner des problèmes cliniques à des degrés divers. L’idéal est de les anticiper avant qu’elles ne se produisent. Certaines règles doivent être respectées, en particulier en cas de polypharmacie (tab. 3). Les interactions et les effets secondaires non reconnus peuvent également aboutir à ce que l’on appelle une cascade de prescriptions : Les effets secondaires ne sont pas reconnus comme tels et de nouveaux traitements sont administrés contre les nouveaux “symptômes” au lieu d’identifier le déclencheur pharmacologique. Si des interactions avec des effets indésirables se produisent, la prise en charge consiste à arrêter ou à réduire la dose de la ou des substances suspectées, à poursuivre le monitorage, les contrôles cliniques ou les mesures thérapeutiques des taux. (Tab. 4). La détection et la prévention des interactions médicamenteuses indésirables et cliniquement significatives est un travail d’équipe qui implique, outre le patient lui-même, tous les médecins, infirmiers et pharmaciens impliqués.

Il a été démontré que les hospitalisations liées à l’interaction pourraient être évitées grâce à des contrôles adéquats et au choix rationnel des médicaments les plus adaptés à la situation. Les interactions médicamenteuses sont traitées dans des manuels, des programmes d’interaction ou des sites web d’interaction (encadré). Cependant, les programmes informatiques censés aider à détecter les combinaisons dangereuses échouent dans un tiers des interactions, alors qu’ils avertissent souvent inutilement des interactions triviales et non pertinentes sur le plan clinique. Il est donc souvent utile d’interroger plus d’une base de données d’interaction.
|
Pages web de vérification des interactions
|
Les considérations de principe sur l’interaction potentielle constituent une aide supplémentaire :
- Si la liste de médicaments est complète, y compris des préparations à base de plantes ?
- Y a-t-il parmi eux des substances particulièrement sensibles aux interactions ?
- Existe-t-il des alternatives potentielles à ces substances ?
- Comment les effets peuvent-ils être monitorés ?
- S’agit-il d’une interaction pharmacocinétique pour laquelle un drug monitoring thérapeutique avec détermination des taux pourrait être utile ?
- Quelle est la gravité de l’effet indésirable ? Quelle est la pertinence clinique de la thérapie ? (évaluation des risques et des avantages)
- L’interaction est-elle liée à la dose ou à la concentration ? Peut-on s’attendre à une amélioration des symptômes en cas de réduction de la dose ?
- Existe-t-il d’autres facteurs spécifiques au patient qui favorisent la réaction indésirable (par exemple, insuffisance rénale) ? Peut-on les optimiser ?
Résumé
En résumé, il est important de penser d’abord aux interactions médicamenteuses potentielles. Cela est particulièrement pertinent lorsqu’un nouveau médicament est ajouté à un régime thérapeutique déjà complexe. Les nouvelles substances oncologiques, telles que les thérapies ciblées (targeted therapies), sont souvent prises quotidiennement. La portée thérapeutique est souvent faible. Les patients oncologiques âgés et présentant une capacité d’élimination réduite – comme des troubles de la fonction rénale – sont particulièrement vulnérables aux effets indésirables dus aux interactions médicamenteuses.
Messages Take-Home
- En oncologie notamment, on utilise principalement des substances à faible marge thérapeutique.
- Avant d’ajouter une nouvelle substance (médicament, mais aussi produit phytopharmaceutique) à un plan de traitement déjà existant, il convient de vérifier les interactions potentielles.
- Pour les contrôles d’interaction médicamenteuse, il existe des programmes d’interaction spéciaux, des pages Web d’interaction avec une précision variable.
- Les options en cas d’interactions médicamenteuses indésirables varient en fonction du type et de la gravité ou du rapport bénéfice/risque. Il peut être nécessaire de réduire la dose, de modifier le temps d’application ou même d’arrêter la ou les substances suspectées.
- En cas d’interactions médicamenteuses suspectées ou non évitables, un contrôle clinique ou de laboratoire étroit et, si nécessaire, des mesures des concentrations de médicaments dans le sang (en cas d’interactions pharmacocinétiques) sont utiles.
Littérature :
- Wilkinson GR : Métabolisme des médicaments et variabilité parmi les patients en matière de réponse aux médicaments. N Engl J Med 2005 ; 352 : 2211-2221.
- van Leeuwen RW, et al : Interactions médicament-médicament avec les inhibiteurs de tyrosine-kinase : une perspective clinique. Lancet Oncol 2014 ; 15 : e315-e326.
- van Leeuwen RW, et al : Prevalence of potential drug-drug interactions in cancer patients treated with oral anticancer drugs. Br J Cancer 2013 ; 108 : 1071-1078.
- Mallet L, Spinewine A, Huang A : Le défi de la gestion des interactions médicamenteuses chez les personnes âgées. Lancet. 2007 Jul 14;370(9582) : 185-191.
- Beijnen JH, Schellens JHM : Drug interactions in oncology. Lancet Oncol. 2004 Aug;5(8) : 489-496.
- Van Meerten E, Verweij J, Schellens JHM : Agents antinéoplasiques : interactions médicamenteuses d’importance clinique. Drug Safety 1995 ; 12 : 168-182.
- Gassmann D, et al : Liver Allograft Failure After Nivolumab Treatment-A Case Report With Systematic Literature Research. Transplant Direct. 2018 Jul 20;4(8) : e376.
- Weiler S, et al. Conseils pratiques : Interactions médicamenteuses indésirables cliniquement significatives. Forum Med Suisse 2015. 15 : 152-156.
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(2-3) : 5-10