Les tachycardies supraventriculaires (TSV) surviennent dans la population générale avec une prévalence d’environ 2-3/1000 habitants. De nombreuses personnes peuvent être aidées par un diagnostic et un traitement adéquats des arythmies cardiaques, et la lecture correcte d’un ECG en cas de TSV est importante pour tout professionnel de la santé.
Les tachycardies supraventriculaires (TSV) surviennent dans la population générale avec une prévalence d’environ 2-3/1000 habitants. Par définition, la tachycardie supraventriculaire se caractérise par des fréquences auriculaires supérieures à 100 battements par minute au repos et la propagation de l’excitation d’une tachycardie supraventriculaire passe par le faisceau de His ou par des structures plus élevées [1].
La Société européenne de cardiologie (ESC) a récemment publié un guide complet qui met l’accent sur le diagnostic et la prise en charge clinique des TVC et résume les progrès réalisés au cours des 10 dernières années dans une spécialité en évolution rapide [2]. Outre les aspects généraux de l’approche clinique, un diagnostic ECG correct est nécessaire, mais il est souvent difficile pour les médecins peu expérimentés dans le traitement des arythmies cardiaques. Par conséquent, l’objectif de cet article est de présenter de manière simplifiée les aspects importants du diagnostic ECG [1,2]. En ce qui concerne la procédure clinique, nous recommandons au lecteur une autre publication de notre groupe de travail : [3].
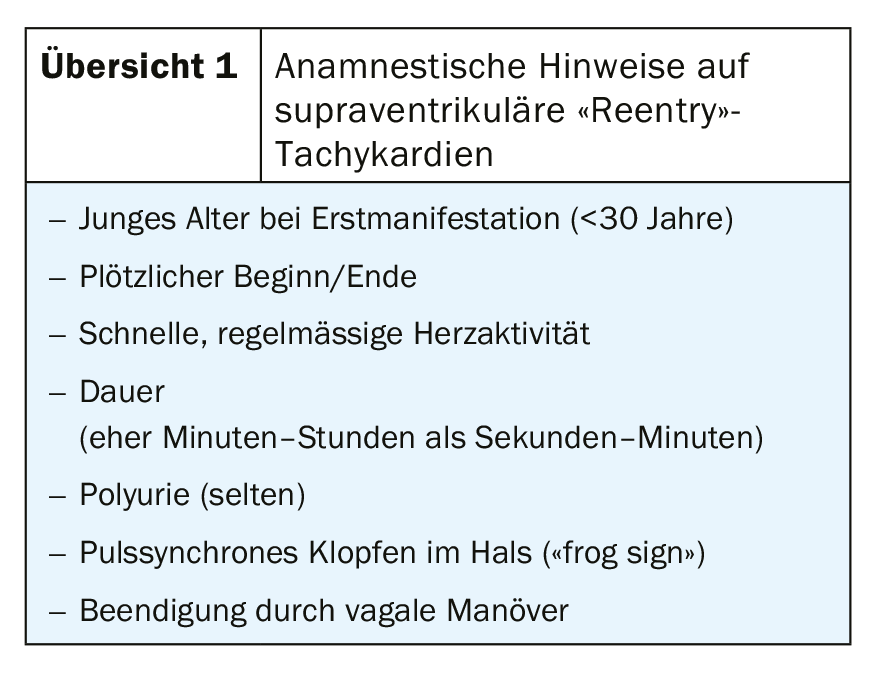
En général, il faut essayer de documenter la TSV sur un ECG 12 dérivations pour diagnostiquer le trouble du rythme. Une comparaison avec l’ECG de repos peut également être utile (par exemple, la présence d’une pré-excitation, Fig. 1). Si la documentation ECG échoue, un examen électrophysiologique avec possibilité d’ablation par cathéter peut être indiqué chez les patients dont l’anamnèse est orientée (tableau 1).
Tachycardie à complexe étroit
Les SVT qui activent le cœur via le système His-Purkinje se présentent typiquement comme une tachycardie à complexe étroit (QRS <120 ms). Dans de rares cas, une activation précoce du faisceau de His peut également se produire en cas de tachycardie ventriculaire (VT) de haut septum, entraînant une tachycardie à complexe étroit.
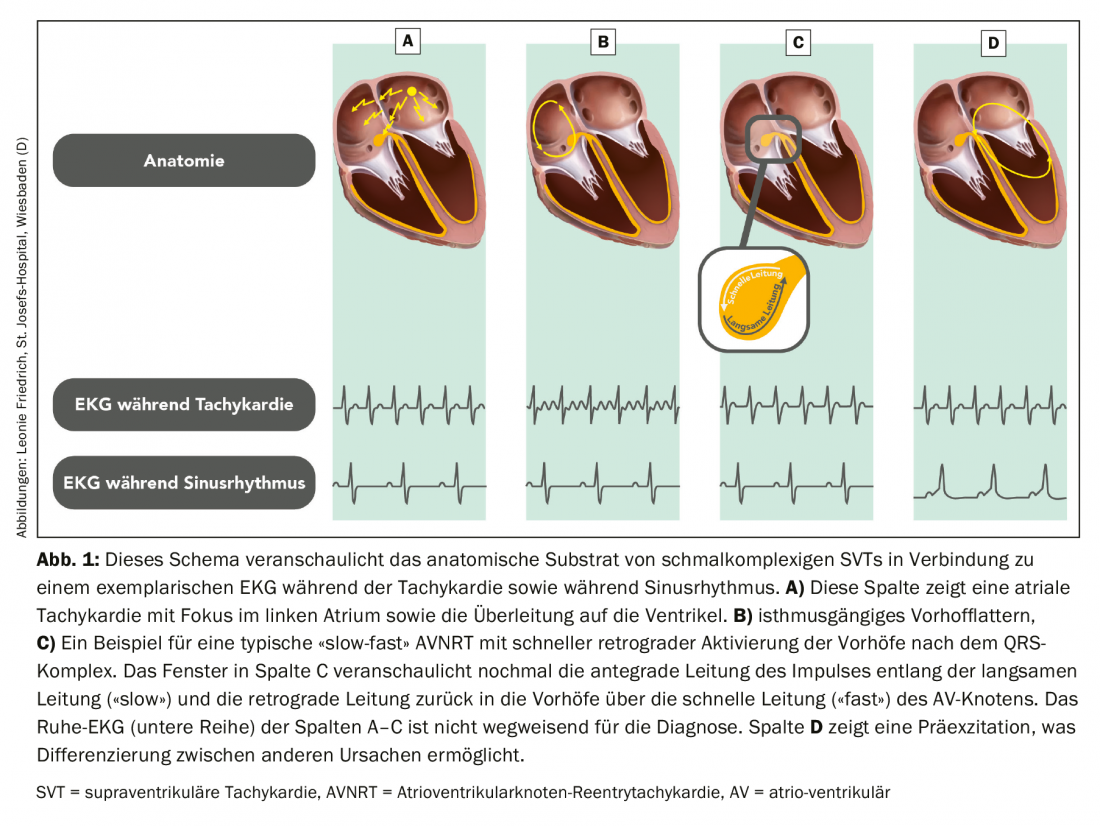
Des modifications spécifiques de l’ECG sont souvent à la base de troubles du rythme individuels et une comparaison de l’ECG de tachycardie avec l’ECG de repos est recommandée (Fig. 1).
Les tachycardies auriculaires (AT) présentent souvent des complexes QRS inchangés par rapport à l’ECG de repos (figure 1A), commencent souvent par des accélérations successives et se terminent par un ralentissement de la fréquence cardiaque. Les tachycardies irrégulières peuvent être des AT focaux ou multifocaux, ainsi que des fibrillations et flutters auriculaires avec conduction AV alternée. La fibrillation auriculaire est la cause la plus fréquente. Le flutter auriculaire présente souvent une conduction AV régulière (figure 1B), bien qu’une conduction 2:1 avec des ondes de flutter masquées constitue parfois un défi diagnostique. En cas de conduction AV très rapide, une fibrillation auriculaire “pseudo-” régularisée doit également être prise en compte dans le diagnostic différentiel. En revanche, les SVT avec mécanisme de réentrée ne sont jamais irréguliers [4].
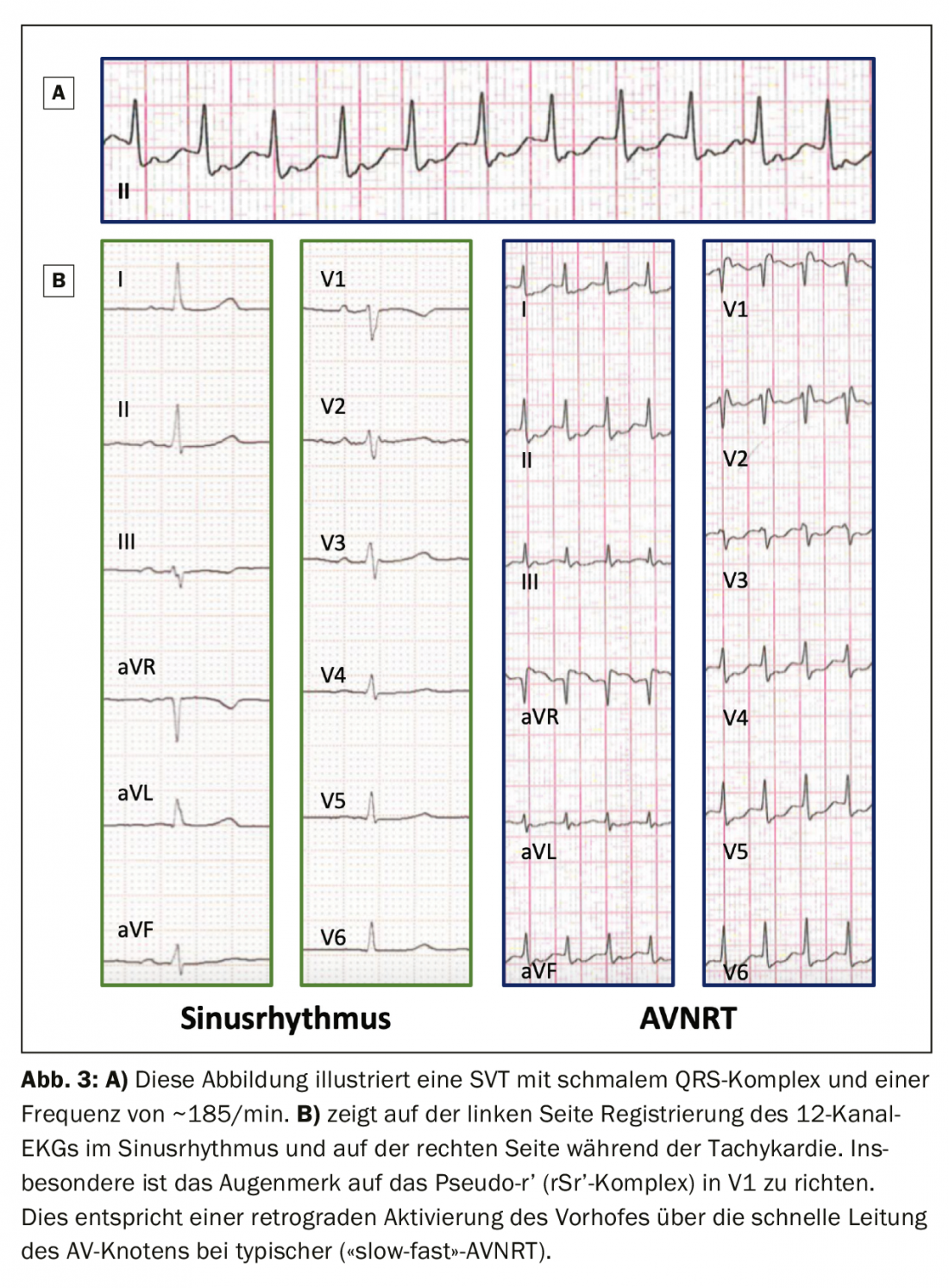
Une tachycardie de réentrée du nœud AV typique (dite “slow-fast” = AVNRT) entraîne, par conduction rétrograde rapide (“fast”), un “pseudo-R'” (en V1) ou “pseudo-S” (dans les dérivations inférieures, encadré de la figure 1C). Ce trouble du rythme se caractérise par un début et une fin brusques, le plus souvent déclenchés par une extrasystole supraventriculaire. Les battements ventriculaires prématurés sont plus susceptibles de déclencher une TRNAV atypique (la circulation de réentrée va dans le sens inverse d’une tachycardie de réentrée du nœud AV typique) ou une tachycardie de réentrée AV (TRNAV).
Une préexcitation (excitation prématurée du ventricule) à l’ECG de repos (figure 1D) peut également orienter le diagnostic en l’absence de documentation de la tachycardie. L’absence de pré-excitation n’exclut cependant pas l’AVRT, car une tachycardie orthodromique (tachycardie avec excitation ventriculaire le long du système de conduction physiologique) peut survenir via une voie de conduction dite “cachée” avec des caractéristiques de conduction uniquement rétrograde (ventriculo-atriale).
Rapport R/P et morphologie des ondes P
Les tachycardies à complexes étroits peuvent être divisées en tachycardies à intervalles RP longs et courts. Les tachycardies avec un intervalle RP court sont caractérisées par un intervalle RP <50% que l’intervalle RR de la tachycardie, alors que les SVT avec un RP long sont caractérisées par un RP > PR (Fig. 2).
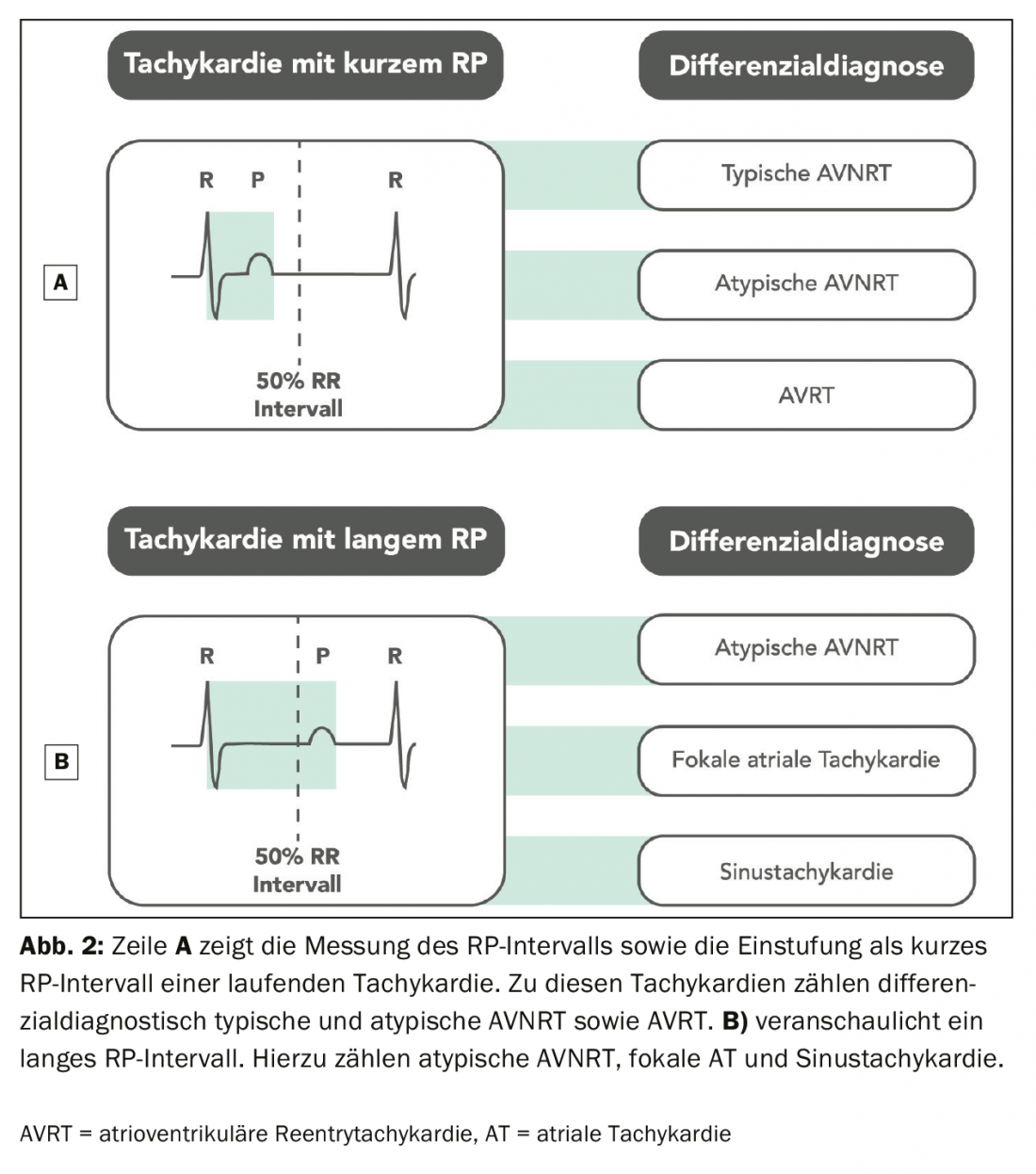
Un intervalle RP très court indique une stimulation auriculaire rétrograde rapide, comme dans le cas d’une AVNRT typique (“slow-fast”) ou d’un AT, mais ici moins fréquemment. Il est difficile de mesurer précisément l’intervalle RP sur l’ECG de surface, mais on peut supposer un cut-off de 90 ms pour différencier une AVNRT typique d’une atypique ou d’une AVRT [5]. Les ondes P rétrogrades rapides peuvent apparaître sous la forme d’un “pseudo-R” en V1 et/ou d’un “pseudo-S” dans les dérivations inférieures, qui ne sont pas présentes dans l’ECG de repos. (Figure 1C). Ces caractéristiques sont généralement plus présentes dans une AVNRT typique. (Fig. 3) que dans le cas d’une AVRT due à une voie de conduction accessoire ou à une AT [1].
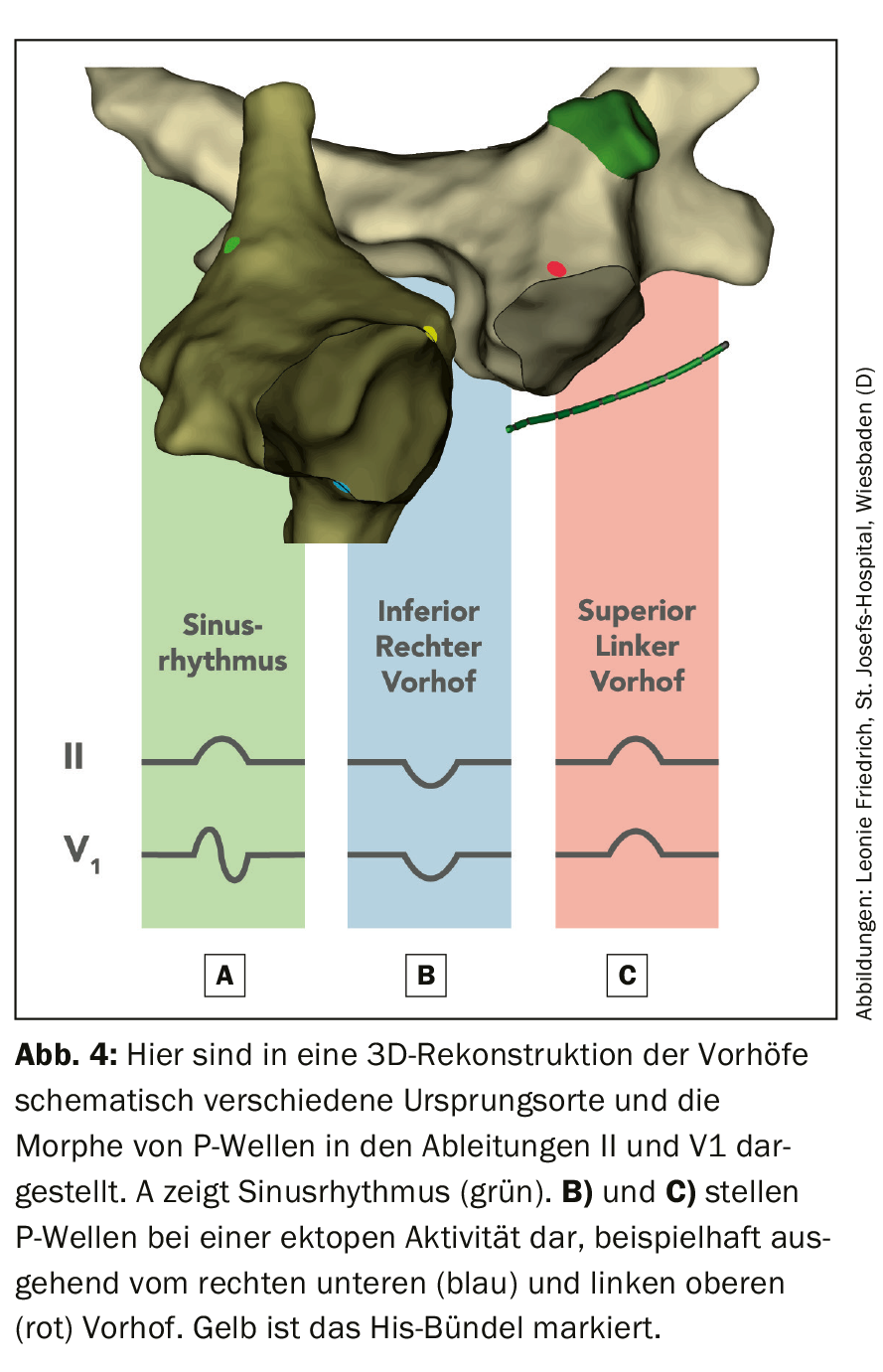
Outre le rapport P/R, la morphologie de l’onde P est importante. Les ondes P ayant une morphologie similaire à celle du rythme sinusal normal indiquent une tachycardie sinusale adéquate ou inadéquate, une tachycardie par réentrée du nœud sinusal ou un AT avec un foyer situé près du nœud sinusal. Des ondes P différentes du rythme sinusal avec une conduction AV différente sont typiquement observées dans les AT. Dans ce cas, la morphologie de l’onde P peut indiquer la localisation du foyer AT. Par exemple, des ondes P positives dans V1 et des ondes P négatives dans la dérivée I indiquent une origine auriculaire gauche (figure 4).
Tachycardie à complexe large
L’analyse des tachycardies à complexe large (QRS >120 ms) est souvent plus difficile. Les SVT peuvent se manifester sous la forme d’une tachycardie à large complexe en cas de bloc de branche préexistant ou fonctionnel, de ralentissement de la conduction dû à un médicament, de voie accessoire antégrade conductrice ou de rythme perçu au niveau auriculaire et stimulé par le ventricule chez les patients porteurs d’un stimulateur cardiaque. Les SVT à complexes ventriculaires larges peuvent encore être provoqués par des troubles électrolytiques ou des médicaments. Les antiarythmiques sont des médicaments typiques qui peuvent provoquer un élargissement du QRS [6,7]. Un bloc de branche droit (BBR) fonctionnel lié à la tachycardie est plus fréquent qu’un bloc de branche gauche (BBG) fonctionnel en raison de la période réfractaire plus longue de la branche droite. Les blocs de branche peuvent se produire dans toute SVT ou tachycardie sinusale. L’objectif de l’interprétation ECG d’une tachycardie à large spectre est de distinguer une TSV d’une TV.
Dissociation auriculo-ventriculaire
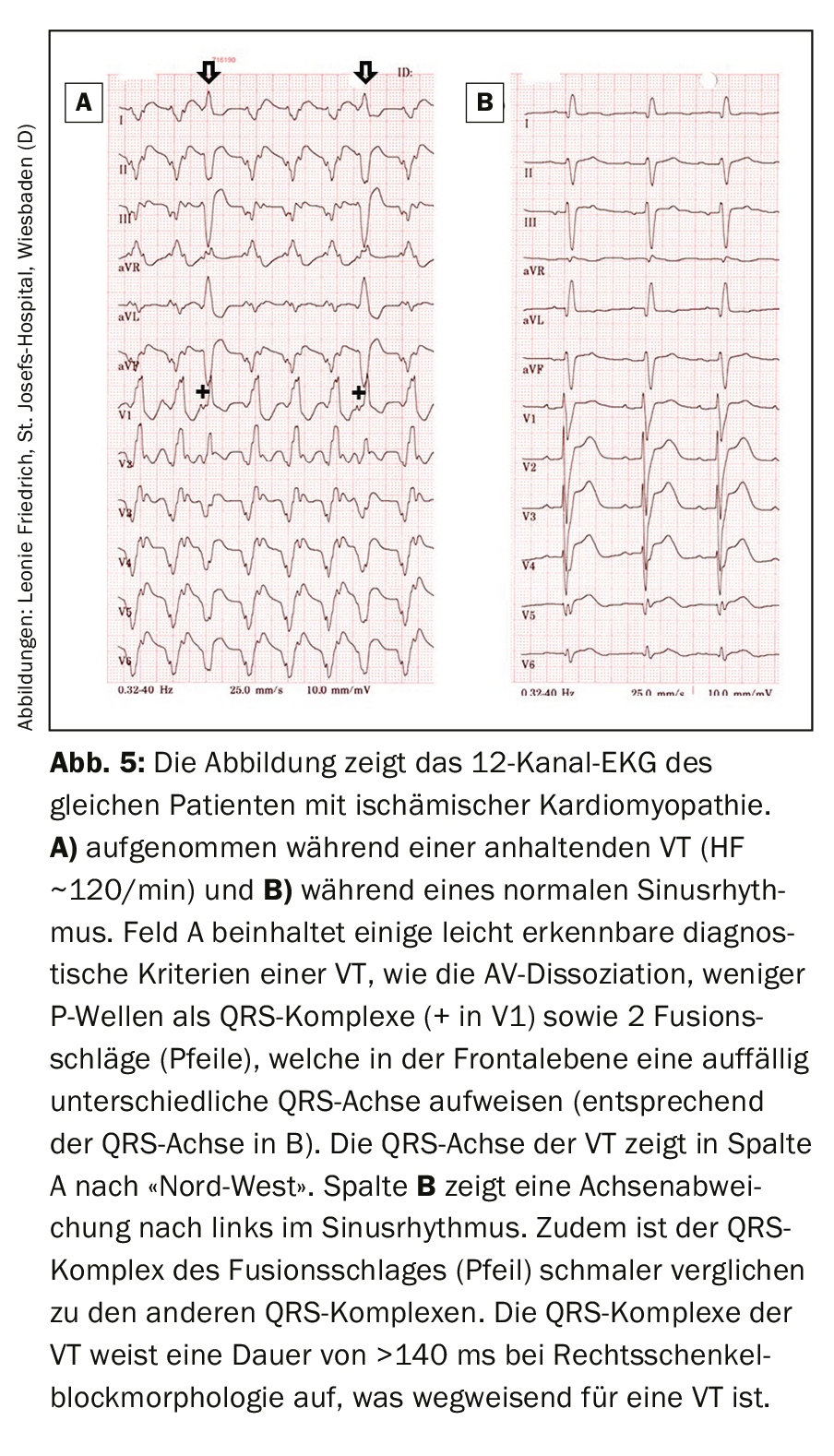
La dissociation AV est un critère ECG probant d’une TV et se caractérise par une activité auriculaire indépendante de l’activation ventriculaire. Le rapport entre l’activité auriculaire et ventriculaire est généralement de 1:1 ou plus dans les SVT (plus d’ondes P que de complexes QRS). Bien qu’une conduction ventriculo-atriale soit également présente chez jusqu’à 50% des patients atteints de TV et qu’un rapport 1:1 soit possible, le rapport est souvent inférieur à 1:1 en cas de TV (plus de complexes QRS que d’ondes P). La détection d’une dissociation AV est souvent difficile, car les ondes P sont généralement dissimulées dans les complexes QRS ou les ondes T. Les ondes P ne sont pas toujours détectées par les examens. En général, les ondes P sont mieux identifiées dans les dérivations inférieures et de la paroi thoracique [8].
Coups de fusion et de capture
En particulier pour les TV dont la fréquence est de ~100-120 battements par minute, il est parfois possible d’identifier des battements sinusaux isolés transférés aux ventricules en raison de la morphologie modifiée du QRS. Pendant l’activité ventriculaire récurrente, il existe de courts intervalles excitables qui peuvent être capturés ou fusionnés avec des battements sinusoïdaux isolés (d’où le nom de battements “capture” et “fusion”). La morphologie de ces battements est une combinaison de la morphologie VT et du rythme sinusal correspondant (Fig. 5).
Durée du QRS et axe QRS
La probabilité de la présence d’un TV augmente en cas de RSB avec QRS >140 ms ou de LSB avec QRS >160 ms. En outre, l’axe QRS peut être utile pour l’interprétation. L’axe QRS d’un SVT avec aberration est généralement limité à -60° à +120°. Par conséquent, un axe QRS d’une tachycardie à complexe large situé en dehors de cette plage est un argument en faveur de la présence d’une TV (figure 6). En particulier, une déviation extrême de l’axe de -90° à +180° (axe “nord-ouest” dans le cercle de Cabrera) indique une TV. Par conséquent, des complexes QRS majoritairement négatifs dans les dérivations I, II et III (qui reflètent cette déviation axiale extrême) sont des critères utiles pour identifier une TV.

Le diagnostic différentiel d’une tachycardie à large spectre sur un ECG 12 dérivations est souvent un défi, même pour les experts. La discussion de critères morphologiques détaillés et l’application de différents algorithmes dépassent le cadre de ce travail. À cet égard, nous renvoyons le lecteur aux excellents travaux correspondants [1,2].
En résumé, de nombreuses personnes peuvent être aidées par un diagnostic et un traitement adéquats des arythmies cardiaques, et la réalisation correcte d’un ECG en cas de TSV est importante pour tout professionnel de la santé.
Messages Take-Home
- L’enregistrement d’un ECG 12 dérivations est important en cas de tachycardie en cours chez les patients stables.
- En cas de tachycardie à large complexe, la présence d’une dissociation AV et de battements de fusion et de capture est la preuve d’une tachycardie ventriculaire.
- En cas de tachycardie à complexe large, l’axe “nord-ouest” du QRS indique la présence d’une tachycardie ventriculaire.
Littérature :
- Katritsis DG, Boriani G, Cosio FG, et al : European Heart Rhythm Association (EHRA) consensus document on the management of supraventricular arhythmias, endorsed by Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Europace 2017 ; 19(3) : 465-511.
- Brugada J, Katritsis DG, Arbelo E, et al. : 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J 2020 ; 41(5) : 655-720.
- Boehmer AA, Rothe M, Soether CM, et al. : Procédure et options de traitement des tachycardies supraventriculaires. Dtsch Med Wochenschr 2020, sous presse.
- Jais P, Matsuo S, Knecht S et al : A deductive mapping strategy for atrial tachycardia following atrial fibrillation ablation : importance of localized reentry. J Cardiovasc Electrophysiol 2009 ; 20(5) : 480-491.
- Letsas KP, Weber R, Siklody CH, et al : Différenciation électrocardiographique de la tachycardie réentrante auriculaire nodale de type commun de la tachycardie auriculo-ventriculaire à répétition via une voie accessoire cachée. Acta Cardiol 2010 ; 65(2) : 171-176.
- Crijns HJ, Kingma JH, Gosselink AT, et al. : Blocage bilatéral séquentiel des branches du faisceau pendant le dofétilide, un nouvel agent antiarythmique de classe III, chez un patient souffrant de fibrillation auriculaire. J Cardiovasc Electrophysiol 1993 ; 4(4) : 459-466.
- Crijns HJ, van Gelder IC, Lie KI : Supraventricular tachycardia miming ventricular tachycardia during flecainide treatment. Am J Cardiol 1988 ; 62(17) : 1303-1306.
- Alzand BS, Crijns HJ : Critères de diagnostic de la tachycardie complexe à large QRS : décennies d’évolution. Europace 2011 ; 13(4) : 465-472.
CARDIOVASC 2021 ; 20(2) : 6-10