Quels bénéfices les patients atteints de sclérose en plaques récurrente-rémittente (SEP) peuvent-ils attendre d’un traitement de première ligne par l’ofatumumab (KESIMPTA®) ? La réponse à cette question a été apportée par une analyse en sous-groupe des données des patients naïfs de traitement dans les deux études ASCLEPIOS. Dans ce cas, il a été démontré que les patients sous ofatumumab présentaient une activité de la maladie plus faible et une progression plus lente par rapport au tériflunomide. La tolérance était comparable à celle de l’ensemble de la population étudiée et le taux d’adhésion était élevé.
De plus en plus de données indiquent que l’utilisation précoce d’un traitement à haute efficacité (HET) a un impact plus positif sur l’évolution de la maladie que si l’on commence par une option à efficacité modérée et que l’on escalade le traitement en cas d’aggravation de la maladie. Par exemple, une analyse de 592 patients britanniques a montré que l’utilisation précoce d’une HET par rapport à un traitement d’escalade sur une période de cinq ans donnait de meilleurs résultats en termes de taux annuel de poussées, de score EDSS (Expanded Disability Status Scale) et d’accumulation persistante de handicaps.1 Les anticorps monoclonaux ont été considérés comme HET, tandis que tous les autres traitements modificateurs de la maladie ont été considérés comme ayant une efficacité modérée. Par ailleurs, une analyse rétrospective a comparé 213 patients ayant bénéficié d’une TEH précoce (débutée dans les 2 ans suivant le début de la maladie) à un groupe correspondant de 253 patients chez lesquels la TEH n’a débuté que 4 à 6 ans après le début de la maladie.2 Il s’est avéré que les patientes ayant bénéficié d’une HET précoce présentaient un score EDSS moyen significativement plus bas après 6 à 10 ans que les patientes ayant bénéficié d’une HET plus tardive (2,3 vs. 3,5 après 10 ans ; p < 0,0001). Toutefois, ces options précoces doivent également présenter un bon profil de sécurité et ne doivent pas imposer aux patients et à leur adhésion de fréquents rendez-vous de traitement et de contrôle, ainsi que des prétraitements éventuellement nécessaires.
ASCLEPIOS I et II : analyse de sous-groupes de patients naïfs de traitement
L’ofatumumab, un anticorps anti-CD20 entièrement humain, est une nouvelle option très efficace pour le traitement de première ligne de la SEP.3,4 L’efficacité et l’innocuité de l’ofatumumab dans le traitement des patients atteints de SMR ont été évaluées dans deux études multicentriques de conception identique, en double aveugle, contrôlées en phase active, en double-dôme et en groupes parallèles, ASCLEPIOS I (n = 927) et ASCLEPIOS II (n = 955).5 Le teriflunomide a été choisi comme substance de référence. Les patients inclus dans le bras ofatumumab ont reçu une dose initiale de 20 mg d’ofatumumab par voie sous-cutanée (s.c.) aux jours 0, 7 et 14, suivie d’une dose d’entretien mensuelle (également 20 mg) et d’un placebo per os. Le traitement d’entretien pouvait être appliqué par les patients eux-mêmes à domicile. Le groupe témoin a été traité avec 14 mg de tériflunomide par jour et un placebo s.c.. La durée des études était flexible et ne dépassait pas 30 mois.
Une analyse de sous-groupe a été réalisée pour évaluer le profil bénéfice/risque d’un traitement par ofatumumab chez des patients co-thérapeutiques à un stade précoce de la maladie (≤ 3 ans depuis le diagnostic).6 Il s’agissait d’environ un tiers de la population totale de l’ASCLEPIOS (314 patients sous ofatumumab, 301 patients sous tériflunomide). L’âge médian de ces patients était de 36 ans et le délai médian depuis le diagnostic était de 0,35 an.
Patients naïfs de traitement : Résultats cohérents avec l’ensemble de la population ASCLEPIOS
L’analyse des données des patients naïfs de traitement a montré que le traitement par ofatumumab a entraîné une réduction significative du taux de rechute annuel (ARR, annualized relapse rate) de 50,3% par rapport au tériflunomide (p < 0,001).6 De plus, la progression confirmée du handicap (confirmed disa- bility worsening ; CDW) sur 6 mois a été réduite de 46% sous ofatumumab par rapport au tériflunomide (p=0,044). Ce résultat, ainsi que celui de la CDW à 3 mois (38% de réduction du risque ; p=0,065), était cohérent avec celui de la population totale. L’analyse de différents paramètres d’imagerie a confirmé la supériorité de l’ofatumumab (figure 1). Ainsi, le nombre de lésions T1 positives au gadolinium (Gd) par scanner a été significativement réduit de 95,4% par l’ofatumumab par rapport au tériflunomide (p <0,001). Le nombre de nouvelles lésions T2/de lésions qui s’agrandissent a également diminué de manière significative de 82,0% par an (p < 0,001). Au cours de la deuxième année de traitement, on a même constaté une réduction de 97,1% des lésions T2 sous ofatumumab par rapport au tériflunomide (p < 0,001).
 Fig. 1. l’ofatumumab a obtenu des résultats significativement supérieurs à ceux du tériflunomide pour différents paramètres d’imagerie chez les patients atteints de SEP en phase de traitement.6
Fig. 1. l’ofatumumab a obtenu des résultats significativement supérieurs à ceux du tériflunomide pour différents paramètres d’imagerie chez les patients atteints de SEP en phase de traitement.6
L’un des objectifs d’un traitement réussi de la SEP est le NEDA (No Evidence of Disease Activity).7 La NEDA-3 est définie par l’absence de poussées (1), de progression du handicap (2) et d’activité radiologique (3). Il s’est avéré que les patients naïfs de traitement dans les deux études ASCLEPIOS avaient plus de 3 fois plus de chances d’atteindre la NEDA-3 avec l’ofatumumab qu’avec le tériflunomide au cours de la première année de traitement et même plus de 14 fois au cours de la deuxième année (figure 2).6
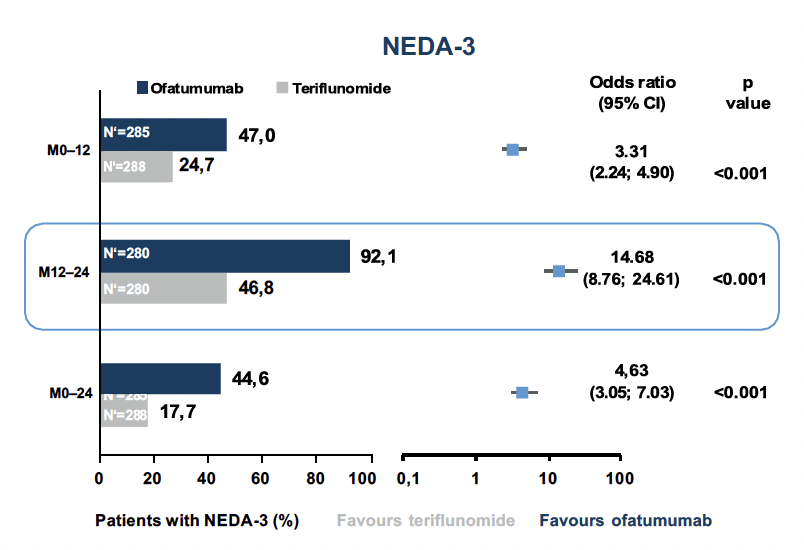 Fig. 2. sous ofatumumab, les chances d’atteindre la NEDA-3 étaient significativement plus élevées que sous traitement par tériflunomide6
Fig. 2. sous ofatumumab, les chances d’atteindre la NEDA-3 étaient significativement plus élevées que sous traitement par tériflunomide6
Profil d’effets secondaires favorable
L’analyse des effets secondaires a clairement montré que la bonne efficacité de l’ofatumumab ne se fait pas au détriment de sa tolérance. Dans la population totale des deux études ASCLEPIOS, 83,6% des patients sous ofatumumab et 84,2% des patients sous tériflunomide ont présenté des effets indésirables.5 Des événements graves ont été enregistrés chez 9,1% et 7,9% des patients respectivement. Les réactions associées à l’injection étaient les plus fréquentes. Ils sont survenus chez 20,2% des patients du groupe ofatumumab et 15,0% des patients du groupe tériflunomide. Les réactions systémiques à l’injection ont été légères ou modérées dans plus de 99% des cas. Ils sont apparus principalement après la première injection et ont diminué de manière significative avec les applications suivantes. Des infections ont été enregistrées chez 51,6% des patients traités par ofa- tumumab et 52,7% des patients traités par tériflunomide. Les plus fréquentes étaient les na- sopharyngites (18% ofatumumab, 16,7% teriflunomide), les infections des voies respiratoires supérieures (10,3% vs 12,8%) et les infections urinaires (10,3% vs 8,3%).
L’analyse du groupe de patients naïfs de traitement a montré une incidence équilibrée d’effets indésirables entre les deux groupes de traitement.6 Le taux d’effets indésirables graves était plus faible dans le groupe des patients naïfs de traitement que dans la population totale, mais restait comparable entre le groupe ofatumumab et le groupe tériflunomide. Aucun cas d’infection opportuniste comme la LEMP (leucoencéphalopathie multifocale progressive) ou de réactivation de l’hépatite B n’a été enregistré. Le taux d’adhésion à l’ofatumumab chez les patients traités était élevé (98,8%) et presque identique à celui de la population globale ASCLEPIOS (98,3%).
Conclusion
De plus en plus de données indiquent que l’utilisation précoce d’un traitement très efficace a un impact plus positif sur l’évolution de la maladie que l’escalade du traitement en cas d’aggravation de la maladie. Cependant, les traitements très efficaces sont souvent associés à un profil de sécurité limité. Comme l’ont montré les deux études ASCLEPIOS, l’ofatumumab s’est révélé très efficace non seulement dans la population générale, mais aussi et surtout chez les patients non traités jusqu’à présent et se trouvant à un stade précoce de la maladie. En outre, le profil d’effets secondaires chez les patients naïfs de traitement était comparable à celui des patients déjà prétraités. Une fois le traitement initié sous la supervision du médecin traitant, les patients peuvent facilement s’auto-administrer KESIMPTA® (ofatumumab), une fois par mois, à l’aide d’un stylo auto-injecteur sous-cutané. Dans le cadre de l’application, il n’est en outre pas nécessaire de procéder à une prémédication, à une hospitalisation ou à une phase d’observation ultérieure. Dans les études ASCLEPIOS, le taux d’adhésion des patients naïfs de traitement et de l’ensemble de la population était supérieur à 95%.
Cet article a été réalisé par Novartis Pharma Schweiz AG, Suurstoffi 14, 6343 Rotkreuz
NO55104/04.2021