Dans le passé, les douleurs neuropathiques étaient classées en fonction de l’étiologie sous-jacente. Cependant, compte tenu de l’hétérogénéité des mécanismes de la douleur, d’autres schémas de classification pourraient être plus appropriés. Dans ce cas, le profil somatosensoriel individuel peut fournir quelques indications sur les troubles physiopathologiques du traitement afférent. En outre, les symptômes rapportés par les patients peuvent également décrire les qualités sensorielles.
Les patients souffrant de douleurs neuropathiques sont hétérogènes en termes d’étiologie, de physiopathologie et de présentation clinique. Ils présentent un grand nombre de symptômes et de signes sensoriels liés à la douleur, ce que l’on appelle un profil sensoriel. Des profils sensoriels différents peuvent indiquer des classes différentes de mécanismes neurobiologiques, de sorte que des sous-groupes ayant des profils sensoriels différents peuvent répondre différemment au traitement.
Principe de classement basé sur les mécanismes et les profils sensoriels
En utilisant des méthodes statistiques sans hypothèse dans la base de données de trois réseaux de recherche multinationaux (Deutsches Forschungsnetzwerk für neuropathische Schmerzen (DFNS), IMI-Europain et Neuropain), une étude a examiné l’identification de sous-groupes dans un large échantillon de patients souffrant de douleurs neuropathiques. Des tests sensoriels quantitatifs standardisés ont été réalisés chez 902 (cohorte test) et 233 (cohorte de validation) patients souffrant de douleurs neuropathiques périphériques d’étiologies diverses. Pour créer des sous-groupes, une analyse en cluster a été réalisée sur la base de 13 paramètres de tests sensoriels quantitatifs. Trois sous-groupes différents avec des profils sensoriels caractéristiques ont été identifiés et répliqués [2].
Le cluster 1 (perte sensorielle, 42%) était caractérisé par une perte de la fonction des petites et grandes fibres et la présence d’une sensation de chaleur paradoxale (PHS). Ces patients n’ont pas souffert de renforcement sensoriel, à l’exception d’une légère allodynie mécanique dynamique (DMA) chez quelques patients. Environ 52% des patients atteints de polyneuropathies entraient dans cette catégorie, ce qui indique une dégénérescence en voie de disparition de presque toutes les classes de fibres. Il est intéressant de noter que 43% des patients atteints de radiculopathie douloureuse (RAD) présentaient ce schéma sensoriel, ce qui indique une dégénérescence sévère des fibres sensorielles au sein de la racine nerveuse concernée. Les sensations paradoxales de chaleur étaient les plus fréquentes, ce qui indique qu’elles sont déclenchées par une perte d’input afférent, bien qu’il s’agisse à première vue d’un signe sensoriel positif, peut-être lié à un processus de désinhibition centrale. Le profil sensoriel est similaire à celui d’un bloc nerveux de compression. Il représente probablement les sous-groupes de “désafférentation” ou “d’hypoesthésie douloureuse” décrits par d’autres. La douleur spontanée est probablement due à des potentiels d’action ectopiques générés dans des sites proximaux des nocicepteurs lésés, par exemple dans le ganglion spinal ou dans des neurones nociceptifs centraux déafférents [2].
Le cluster 2 était caractérisé par des fonctions sensorielles relativement préservées des grandes et petites fibres, associées à une hyperalgésie au chaud et au froid et à une DMA de faible intensité. Ce schéma (hyperalgésie thermique) est apparu chez 33% des patients souffrant de douleurs neuropathiques périphériques, quelle que soit l’étiologie. Le fait que chez un tiers des patients, la fonction sensorielle cutanée était relativement bien préservée malgré une lésion nerveuse documentée suggère que les douleurs neuropathiques périphériques peuvent être associées à une régénération cutanée efficace et à des nocicepteurs sensibilisés. Le profil sensoriel est similaire à celui d’une lésion de brûlure UV-B et est probablement dû à une sensibilisation périphérique. Il représente les sous-groupes de “nocicepteurs irritables” décrits par d’autres. Les nocicepteurs sensibilisés sont associés à une surexpression des canaux et des récepteurs, ce qui entraîne des décharges spontanées pathologiques et un abaissement du seuil d’activation des stimuli thermiques (chaleur et froid) et mécaniques. L’hyperactivité persistante des nocicepteurs survivants est peut-être responsable de la douleur persistante et peut entraîner une certaine sensibilisation centrale dans la corne dorsale de la moelle épinière, de sorte que les stimuli tactiles transmis par les fibres A peuvent activer les neurones nociceptifs centraux. En conséquence, les stimuli mécaniques induisent une perception accrue de la douleur, c’est-à-dire l’hyperalgésie par piqûre d’aiguille et la DMA. Étant donné que ces types d’hyperalgésie mécanique n’ont été observés que chez environ 20% des patients, il est évident que la commande périphérique des nocicepteurs n’induit pas toujours une sensibilisation centrale [2].
Le cluster 3 (hyperalgésie mécanique, 24%) était caractérisé par une perte prédominante des petites fibres sensibles au froid et à la chaleur, associée à une hyperalgésie de pression émoussée, une hyperalgésie par piqûre d’aiguille et des DMA prononcés et plus fréquents. La qualité de la douleur à type de brûlure était plus prononcée dans ce groupe que dans les autres, ce qui est cohérent avec les résultats obtenus dans le syndrome de Guillain-Barré, où la douleur à type de brûlure a été associée à des déficits des petites fibres, et avec le concept de chaleur synthétique plutôt que de sensibilisation périphérique à la chaleur. Ce profil était le plus fréquent chez les patients souffrant de névralgie post-zostérienne (PHN) (47%). Il ressemble au profil provoqué par la stimulation électrique à haute fréquence de la peau, capable d’induire une potentialisation spinale à long terme, et correspond probablement aux sous-groupes d'”hyperalgésie neurogène” ou de “sensibilisation centrale” décrits par d’autres. La sensibilisation centrale est prononcée pour les stimuli mécaniques, mais pas pour les stimuli thermiques. La dissociation de l’hyperalgésie thermique et mécanique peut s’expliquer par des différences dans la signalisation neuronale de la douleur thermique et mécanique, qui commence par un codage périphérique dans différents sous-groupes de nocicepteurs. Une douleur persistante dans ce sous-groupe indique à nouveau une activité spontanée dans le système nociceptif, qui peut avoir son origine dans le système nerveux périphérique et/ou central [2].
Traitement basé sur le profil – les sous-groupes répondent mieux !
Sur la base de cet algorithme, d’autres études cliniques ont classé les patients selon des groupes similaires et ont testé les différences d’efficacité des médicaments dans une analyse secondaire prévue. Par exemple, une étude de preuve de concept randomisée et contrôlée par placebo a évalué l’innocuité et l’efficacité de l’administration pendant 28 jours d’ISC 17536, un nouvel inhibiteur oral du récepteur de la douleur largement répandu. Potentiel de récepteur transitoire de l’ankyrine 1, qui transmet la signalisation nociceptive dans les petites fibres nerveuses périphériques, a été étudié chez 138 patients atteints de neuropathie périphérique diabétique chronique et douloureuse, en utilisant des tests sensoriels quantitatifs pour caractériser le phénotype initial des patients. Le critère d’évaluation principal était la variation de la valeur moyenne sur 24 heures de l’intensité de la douleur, sur la base d’une échelle numérique d’évaluation de l’intensité de la douleur en 11 points, depuis la valeur initiale jusqu’à la fin du traitement. Dans l’étude, le critère d’évaluation principal n’a pas été atteint dans l’ensemble de la population de patients. Cependant, dans une sous-population exploratoire, génératrice d’hypothèses, de patients ayant une fonction préservée des petites fibres nerveuses, définie par des tests sensoriels quantitatifs, une amélioration statistiquement significative et cliniquement significative de la douleur a été observée avec ISC 17536 [3].
Une autre étude randomisée, en double aveugle, contrôlée par placebo et stratifiée phénotypiquement a évalué l’efficacité de l’oxcarbazépine (1800-2400 mg) et du placebo sur deux périodes de traitement de 6 semaines. La mesure primaire de l’efficacité était le changement de l’intensité médiane de la douleur entre la valeur initiale et la dernière semaine de traitement, mesurée sur une échelle de notation numérique de 11 points, et l’objectif primaire était de comparer l’effet de l’oxcarbazépine chez les patients avec et sans phénotype de nocicepteur irritable, défini par une hypersensibilité et une fonction préservée des petites fibres nerveuses, déterminée par des tests sensoriels quantitatifs détaillés. 97 patients souffrant de douleurs neuropathiques périphériques dues à une polyneuropathie, une lésion nerveuse chirurgicale ou traumatique ou une névralgie post-zostérienne ont été randomisés. La population en intention de traiter comprenait 83 patients : 31 avec le phénotype de nocicepteur irritable et 52 avec le phénotype de nocicepteur non irritable. Dans l’échantillon total, l’oxcarbazépine a soulagé la douleur de 0,7 point (sur une échelle d’évaluation numérique de 0 à 10 ; intervalle de confiance à 95% [CI] 0,4-1,4) de plus que le placebo (p=0,015), et il y avait une interaction significative entre le traitement et le phénotype de 0,7 (IC à 95% 0,01-1,4, p=0,047). Le nombre de patients qui ont dû être traités pour obtenir un soulagement de la douleur de plus de 50% était de 6,9 (IC 95% 4,2-22) dans l’échantillon total, 3,9 (IC 95% 2,3-12) dans le groupe des nocicepteurs irritables et 13 (IC 95% 5,3-∞) dans le groupe des nocicepteurs non irritables. Les résultats montrent que l’oxcarbazépine est plus efficace pour soulager les douleurs neuropathiques périphériques chez les patients présentant un phénotype de nocicepteur irritable que non irritable [4].
Une autre étude a utilisé des modèles d’effets mixtes pour des mesures répétées afin d’évaluer l’efficacité de la prégabaline par rapport au placebo dans des sous-groupes présentant des phénotypes de douleur induite (c.-à-d. hyperalgésie ou allodynie) à partir des données d’un essai clinique multinational randomisé récent (n=539) dans lequel des sous-groupes phénotypiques ont été identifiés en utilisant un examen clinique structuré. La différence de la valeur moyenne de la douleur entre le groupe actif et le groupe placebo (c.-à-d. le delta) après 15 semaines de traitement était de -0,76 (p=0,001) pour le sous-groupe souffrant d’hyperalgésie, contre 0,19 (p=0,47) pour le sous-groupe ne souffrant pas d’hyperalgésie. L’interaction entre le traitement et le phénotype, qui teste si les sous-groupes répondent au traitement de manière statistiquement différente, était significative (p=0,0067). Le delta pour le sous-groupe avec allodynie était de -0,31 (p=0,22), comparé à -0,30 (p=0,22) pour le sous-groupe sans allodynie (interaction traitement-phénotype p=0,98). Ces résultats suggèrent que l’hyperalgésie, mais pas l’allodynie, prédit la réponse à la prégabaline chez les patients souffrant de douleurs neuropathiques post-traumatiques chroniques [5].
Sous-groupes identifiés Répondants
Dans ces études et dans d’autres études sur la douleur neuropathique, le profil sensoriel QST* a été utilisé pour identifier les prédicteurs de la réponse au traitement, qui peuvent être provisoirement classés dans les trois clusters. Par exemple, les patients présentant un profil de sortie QST similaire au cluster 2 (“hyperalgésie due à la chaleur”) ont montré une efficacité supérieure dans une étude prospective randomisée contrôlée par placebo avec l’oxcarbazépine, dans une analyse préplanifiée d’une étude contrôlée par placebo avec la toxine botulique, et dans une analyse rétrospective d’une étude avec des patchs topiques de capsaïcine sans bras placebo. Une analyse rétrospective d’une étude contrôlée par placebo avec de la lidocaïne topique a montré une efficacité moindre. Les patients présentant un profil de sortie QST similaire au cluster 1 (“perte sensorielle”) ont montré une efficacité supérieure dans une analyse rétrospective d’une étude contrôlée par placebo sur les opioïdes oraux. Une étude prospective randomisée et contrôlée par placebo sur l’oxcarbazépine a montré une efficacité moindre. Les patients présentant un profil de sortie QST similaire au cluster 3 (“hyperalgie mécanique”) ont montré une efficacité supérieure lors d’analyses rétrospectives d’études contrôlées par placebo avec la prégabaline orale, la lidocaïne topique, la lamotrigine, ou la lidocaïne intraveineuse.
* QST= protocole standardisé d’évaluation sensorielle quantitative
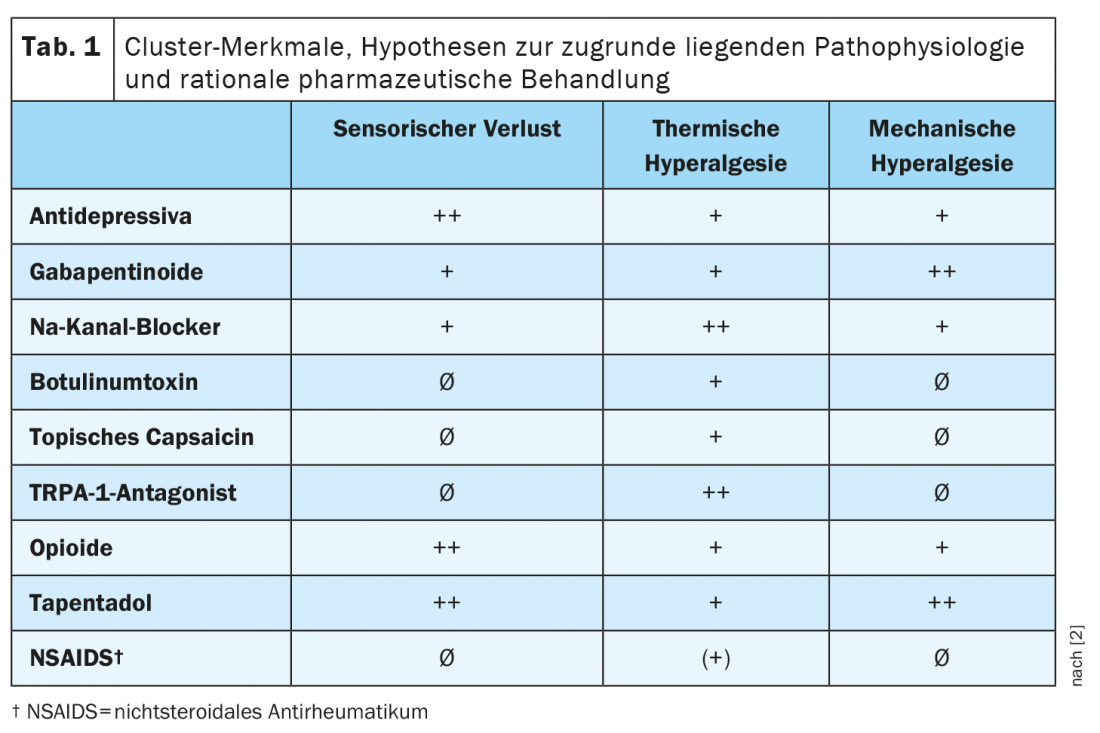
Les différents profils pharmacologiques soulignent la pertinence clinique des clusters. Une prédiction de la différence d’efficacité des principaux médicaments contre les douleurs neuropathiques dans les différents clusters est résumée dans le tableau 1 [2]. Le professeur Ralf Baron, directeur de la section de recherche et de traitement de la douleur neurologique à l’hôpital universitaire du Schleswig-Holstein à Kiel, souligne à ce stade que l’ampleur de la différence de réponse au traitement entre les clusters doit cependant encore être démontrée dans de futures études prospectives [1].
Symptômes sensoriels enregistrés par les résultats rapportés par les patients (PRO)
Outre le profil sensoriel QST, il existe également des symptômes rapportés par les patients qui décrivent des qualités sensorielles. Un résultat rapporté par le patient (PRO) décrit les informations évaluées et rapportées directement par la personne sur la façon dont elle se sent ou fonctionne par rapport à sa santé ou son traitement, sans interprétation ou modification par d’autres, y compris les cliniciens et les chercheurs. Pour les patients souffrant de douleurs neuropathiques ou chroniques, il existe quelques questionnaires validés qui évaluent très spécifiquement différents symptômes sensoriels (tableau 2) [6–8].
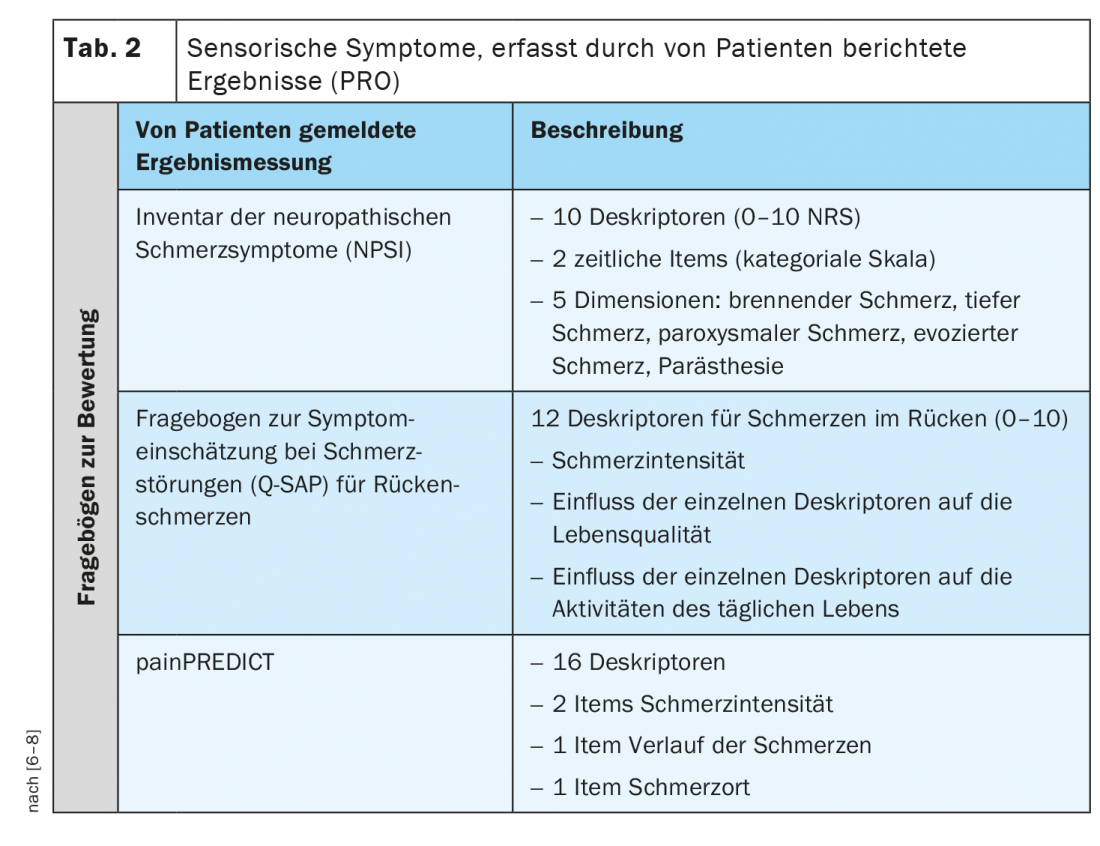
Par exemple, le Neuropathic Pain Symptom Inventory (NPSI) est un auto-questionnaire spécialement conçu pour évaluer les différents symptômes de la douleur neuropathique. La version finale du NPSI comprend dix descripteurs (plus deux items temporels) qui permettent de distinguer et de quantifier cinq dimensions différentes, cliniquement pertinentes, des syndromes douloureux neuropathiques et sensibles au traitement. Les propriétés psychométriques du NPSI suggèrent qu’il pourrait être utilisé pour caractériser des sous-groupes de patients souffrant de douleurs neuropathiques et pour vérifier s’ils répondent différemment à différents agents pharmacologiques ou à d’autres interventions thérapeutiques [6].
Le Q-SAP est un auto-questionnaire spécifique qui évalue les symptômes classiques de douleur nociceptive et neuropathique des patients souffrant de lombalgie chronique en fonction de leur répartition locale. En outre, le questionnaire évalue l’intensité de ces symptômes et leur impact sur la qualité de vie et la fonctionnalité, et peut être utilisé pour évaluer le traitement. L’auto-questionnaire se compose de deux parties (pour les symptômes du dos et, le cas échéant, des jambes) et a été testé sur 152 patients souffrant de lombalgie chronique avec ou sans radiculopathie. Contrairement à d’autres questionnaires, le Q-SAP dos/jambes n’évalue pas seulement l’intensité des symptômes, mais aussi leur impact sur la qualité de vie et la fonctionnalité du patient. De plus, ce questionnaire interroge les symptômes en fonction de leur répartition anatomique [7].
painPREDICT est un questionnaire qui utilise un large éventail de descripteurs, selon les déclarations des patients, potentiellement liés aux mécanismes de la douleur neuropathique et nociceptive, et d’examiner les modèles de symptômes sensoriels. Le questionnaire final comportait 20 items couvrant les domaines suivants : Intensité de la douleur, localisation de la douleur, évolution de la douleur et symptômes sensoriels. Le regroupement hybride des nouvelles données du questionnaire a permis d’identifier trois profils différents de symptômes sensoriels caractéristiques chez les patients souffrant de douleurs neuropathiques (NeP) : “nocicepteurs irritables”, “douleurs de désafférentation” et “crises douloureuses avec composante nociceptive”. Bien que certaines différences aient été observées dans la distribution des profils sensoriels, tous les profils étaient représentés dans tous les groupes d’étiologie du NeP [8].
Messages Take-Home
- Il existe des sous-groupes mécaniques chez les patients douloureux
- Certains sous-groupes répondent particulièrement bien aux opioïdes
- Les outils d’évaluation sont :
– Profils sensoriels QST
– Profils sensoriels PRO
Congrès : Congrès allemand sur la douleur 2022
Littérature :
- Ralf Baron : Évaluation de la douleur – La base d’un traitement personnalisé. Congrès allemand sur la douleur 2022, symposium industriel ; 21.10.2022.
- Baron R, et al. : Douleur neuropathique périphérique : un principe d’organisation lié au mécanisme basé sur des profils sensoriels. Pain 2017 ; doi : 10.1097/j.pain.0000000000000753.
- Jain M, et al : Essai randomisé, en double aveugle, contrôlé par placebo d’ISC 17536, un inhibiteur oral du récepteur transitoire potentiel de l’ankyrine 1, chez des patients souffrant de neuropathie diabétique périphérique douloureuse : impact de la fonction préservée des fibres du petit nerf. Pain 2022 ; doi : 10.1097/j.pain.0000000000002470.
- Demant DT, et al. : L’effet de l’oxcarbazépine dans la douleur neuropathique périphérique dépend du phénotype de la douleur : une étude randomisée, en double aveugle, contrôlée par placebo et basée sur le phénotype. Pain 2014 ; doi : https://doi.org/10.1016/j.pain.2014.08.014.
- Gewandter JS, et al : Predicting Treatment Response with Sensory Phenotyping in Post-Traumatic Neuropathic Pain. Pain 2022 ; doi : 10.1093/pm/pnac045.
- Bouhassira D, et al. : Développement et validation de l’inventaire des symptômes de douleur neuropathique. Pain 2004 ; doi : 10.1016/j.pain.2003.12.024.
- Otto JC, et al. : Validation du Questionnaire for Symptom Assessment in Pain disorders for Back pain patients (Q-SAP). Eur J Pain 2020 ; doi : 10.1002/ejp.1690.
- Tölle TR, et al : painPREDICT : premières données provisoires issues du développement d’un nouveau questionnaire sur la douleur rapportée par les patients pour prédire la réponse au traitement en utilisant des profils de symptômes sensoriels. Curr Med Res Opin 2019 ; doi : 10.1080/03007995.2018.1562687.











