Les stratégies thérapeutiques actuelles pour les maladies inflammatoires chroniques de l’intestin (MICI) ont atteint un plateau en ce qui concerne les taux de réponse et/ou de rémission obtenus avec un seul agent thérapeutique. Par conséquent, la thérapie combinée avancée (ACT) s’est imposée comme un nouveau concept de traitement. Un groupe de chercheurs a évalué des études récentes comparant les ACT aux monothérapies.
Les thérapies biologiques sont devenues la norme pour le traitement des maladies inflammatoires actives de l’intestin modérées à sévères, y compris la maladie de Crohn (MC) et la colite ulcéreuse (CU). Malgré ces progrès, les approches thérapeutiques actuelles de la MEC stagnent en termes de taux de réponse et/ou de rémission. L’arsenal actuel de thérapies avancées ne conduit qu’à des taux de rémission clinique globaux d’environ 50%. De plus, environ 50% des patients qui répondent initialement à un traitement biologique ou à un traitement à petites molécules perdent cette réponse avec le temps. Par conséquent, les patients atteints de CED qui ne répondent pas ou qui ont perdu la réponse à un traitement biologique donné doivent passer à une autre molécule, ce qui réduit leurs chances d’obtenir une rémission à long terme de la maladie.
La nouvelle approche de la thérapie combinée avancée ( ACT) s’est avérée être une stratégie de traitement prometteuse pour les CED. Elle consiste en l’utilisation de deux thérapies ciblées différentes, soit biologiques, soit à base de petites molécules, dans le but premier de surmonter le plateau thérapeutique. Des données sur l’ACT ont récemment été obtenues dans le cadre de l’étude randomisée et contrôlée VEGA : Le Dr Panu Wetwittayakhlang, du département de gastro-entérologie et d’hépatologie de l’Université Prince of Songkla, Hat Yai, Thaïlande, et le Dr Peter L. Lakatos, du département de gastro-entérologie et d’hépatologie du Centre universitaire de santé McGill, Montréal, ont passé en revue les connaissances actuelles (février 2024) sur l’ACT et son impact sur le dépassement du plafond thérapeutique dans le traitement de la MCE [1].
Une combinaison à court terme de deux médicaments biologiques peut aider les patients atteints de RCH à mieux contrôler leur maladie
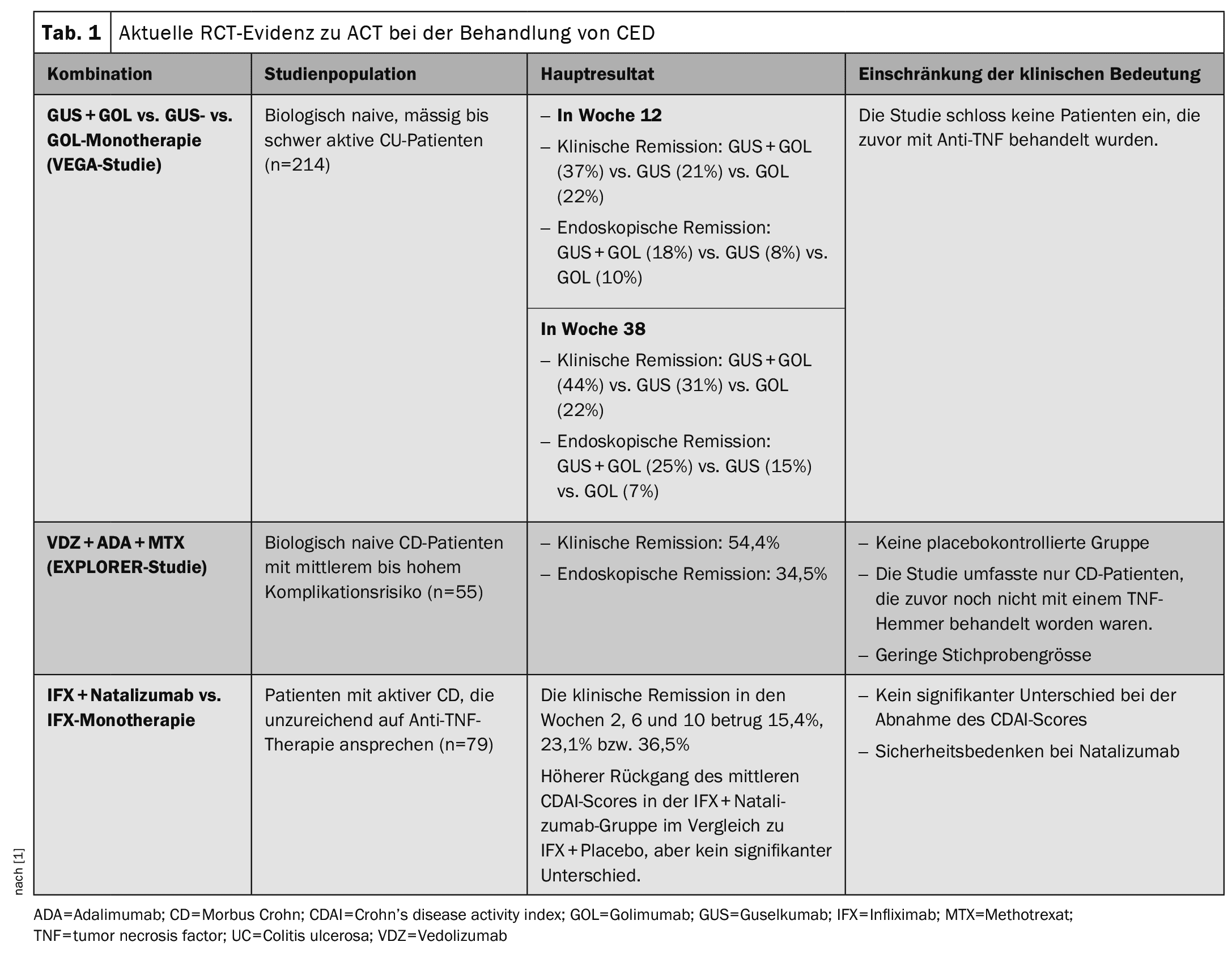
L’ECR de phase 2a VEGA a évalué l’efficacité d’un traitement d’induction combiné associant le guselkumab, un inhibiteur sélectif de l’interleukine (IL) 23, et le golimumab, un inhibiteur du TNF alpha, par rapport à une monothérapie par guselkumab ou golimumab chez des patients atteints de CU modérément à sévèrement active. Un total de 214 patients qui n’avaient pas répondu à un traitement anti-TNF et qui n’avaient pas répondu à un traitement conventionnel ou ne l’avaient pas toléré ont été randomisés pour recevoir l’un des traitements suivants :
- Guselkumab 200 mg i.v. aux semaines 0, 4 et 8 (n=71),
- Golimumab 200 mg s.c. à la semaine 0, puis 100 mg s.c. aux semaines 2, 6 et 10 (n=72)
- ou une combinaison de 200 mg de guselkumab i.v. plus 200 mg de golimumab s.c. à la semaine 0 ; 100 mg de golimumab s.c. aux semaines 2, 6 et 10 et 200 mg de guselkumab i.v. aux semaines 4 et 8 (n=71).
Au cours de la phase de maintien, les patients du bras combiné sont passés à une monothérapie par guselkumab au début de la semaine 12.
Chez les patients atteints de CU non traités biologiquement, l’étude indique un taux plus élevé de rémission clinique et d’amélioration endoscopique dans le bras combiné (traitement d’induction au golimumab et au guselkumab) vs. les monothérapies au golimumab ou au guselkumab. Les auteurs notent toutefois que l’étude VEGA n’a pas inclus de patients CU ayant été exposés ou ayant échoué à des traitements biologiques antérieurs. Par conséquent, les données issues d’essais cliniques sur l’efficacité de l’ACT chez les patients atteints de CU réfractaires à un traitement biologique restent limitées. Les données disponibles sur l’ACT chez les patients atteints de la maladie de Crohn sont également limitées, ce qui constitue un défi particulier pour les personnes atteintes d’une maladie compliquée.
Le traitement combiné a entraîné une rémission clinique chez 54,5% des patients
L’étude de phase 4 en ouvert EXPLORER a évalué l’efficacité d’une trithérapie associant vedolizumab, adalimumab et méthotrexate chez des patients atteints de la maladie de Crohn (MC) non traités biologiquement et présentant un risque modéré à élevé, déterminé par un score endoscopique pour la MC (SES-CD) >7 (ou >4 si la maladie est isolée au niveau iléal). Les patients éligibles atteints de la maladie de Crohn ont été considérés comme présentant un risque moyen à élevé de complications. Une analyse intérimaire a été réalisée sur 55 patients traités par la trithérapie (vedolizumab 300 mg i.v. le jour 1 et les semaines 2 et 6, puis toutes les 8 semaines ; adalimumab 160 mg s.c. le jour 2, 80 mg la semaine 2, puis 40 mg toutes les 2 semaines jusqu’à la semaine 26 ; méthotrexate 15 mg par voie orale toutes les semaines jusqu’à la semaine 34). Après la trithérapie et jusqu’à la semaine 34, chaque patient a reçu une monothérapie de vedolizumab jusqu’à la semaine 102. A la semaine 26, une réponse clinique et une rémission endoscopique ont été observées chez 54,4% et 34,5% respectivement. Aucun signal de sécurité n’a été associé à la trithérapie. Les preuves actuelles de l’ECR sur l’ACT dans le traitement de la CED sont résumées dans le tableau 1 .
L’étude EXPLORER suggère l’efficacité d’une combinaison de vedolizumab, d’adalimumab et de méthotrexate pour améliorer la réponse endoscopique et la rémission chez les patients atteints de MC naïfs de traitement biologique et présentant un risque moyen à élevé de complications. Cependant, l’absence d’un bras contrôlé dans l’étude empêche de démontrer clairement l’efficacité thérapeutique de l’ACT dans la MC, selon les Drs Wetwittayakhlang et Lakatos.
Faibles preuves issues d’études du monde réel
En ce qui concerne les données d’observation pratiques, une grande étude multicentrique a rapporté que 98 patients ont commencé un traitement combiné pour une DEC active (67%), des maladies inflammatoires actives à médiation immunitaire (IMIDs) ou des manifestations extra-intestinales (EIMs, 22%), ou les deux (10%), après l’échec de plusieurs traitements biologiques chez eux. L’activité de la maladie a été cliniquement améliorée chez 70% des patients, et 81% pour les IMIDs/EIMs. Une autre étude rétrospective a porté sur 92 patients qui ont reçu un traitement biologique combiné pour des CED actifs ou des EIM. Les combinaisons les plus fréquentes étaient le vedolizumab et l’ustékinumab (32%) ou le vedolizumab et les anti-TNF (31%). Les taux de réponse clinique à 3 et 6 mois étaient respectivement de 46% et 34%. Une étude rétrospective menée par Glassner et al. a porté sur 50 patients atteints de CED et traités par différentes combinaisons de produits biologiques ou de thérapies à petites molécules. Environ 50% ont reçu du vedolizumab plus des anti-IL-12 et IL-23 (ustekinumab) en cas d’activité persistante de la maladie (n=47) ou en cas de maladie rhumatologique ou dermatologique concomitante (n=3). Un nombre significativement plus élevé de patients étaient en rémission clinique à 4 mois (50% vs. 14%, p=0,0018) et en rémission endoscopique à 8 mois (34% vs. 6%, p=0,0039) qu’à l’état de référence.
Une autre série de cas a montré que la bithérapie biologique était sûre et efficace chez 22 patients atteints de MC réfractaire sévère, qui avaient reçu au total 24 traitements biologiques duaux après l’échec de plusieurs thérapies biologiques. Une réponse clinique et une rémission clinique ont été observées chez 50% et 41% des patients respectivement. Une amélioration et une rémission endoscopiques ont été observées chez 43% et 26% respectivement. La présence d’une fistule périanale active a diminué de 50% au début de l’étude à 33% après le traitement. De la même manière, deux études de cohorte rétrospectives ont rapporté l’efficacité de l’association du tofacitinib avec d’autres traitements biologiques.
Une méta-analyse réalisée par Alayo et al. a évalué l’efficacité de l’ACT avec différents schémas d’association. Pour les patients recevant le vedolizumab plus le tofacitinib, les taux de réponse et de rémission cliniques groupés étaient respectivement de 59,9% (IC à 95% : 37,2-80,8) et 47,8% (IC à 95% : 19,0-77,4). Pour le vedolizumab plus ustekinumab, les taux regroupés de réponse et de rémission cliniques étaient respectivement de 83,9% (IC à 95% : 66,4-96,8) et 47,0% (IC à 95% : 14,5-80,7). Les patients ayant reçu du vedolizumab plus un anti-TNF ont présenté des taux de réponse et de rémission endoscopiques/radiologiques groupés de 38,2% (IC à 95% : 19,5-58,4) et 18,0% (IC à 95% : 1,6-41,8), respectivement. Et chez les patients traités par tofacitinib plus vedolizumab, les taux correspondants étaient de 46,2% (IC à 95% : 20,4-73,0) et 24,6% (IC à 95% : 6,4-47,6).
Selon les Drs Wetwittayakhlang et Lakatos, les études d’observation du monde réel, bien qu’informatives, ne permettent pas de déterminer si l’ACT peut augmenter la limite thérapeutique de la CED dans les complexités d’un cadre clinique du monde réel, étant donné que la plupart des patients recevant l’ACT n’ont pas répondu ou ont répondu de manière insuffisante à un traitement biologique. Par conséquent, il convient de prendre en compte les données disponibles les plus fiables, provenant principalement d’un nombre limité d’essais cliniques auxquels ont participé des patients sous ACT n’ayant pas encore reçu d’agents biologiques.
Une option thérapeutique prometteuse pour contrôler efficacement la maladie
L’ACT est apparue comme une nouvelle stratégie thérapeutique potentielle visant à améliorer l’efficacité thérapeutique et à dépasser le plateau observé avec les thérapies actuellement disponibles. Chez les patients hautement sélectionnés présentant un phénotype de maladie à haut risque (tels que les patients présentant une atteinte étendue de l’intestin grêle dans la maladie de Crohn ou les patients ne répondant pas à plusieurs traitements), l’utilisation de l’ACT peut être utile pour contrôler la maladie à un stade précoce afin de prévenir la progression de la maladie et les complications. Pendant la phase d’induction, une co-induction simultanée avec une combinaison de médicaments biologiques ou de petites molécules peut être utilisée afin d’obtenir un contrôle maximal de la maladie grâce à des effets synergiques. Une fois la rémission de la maladie obtenue, une monothérapie avec l’un des agents combinés peut être utilisée pour maintenir la rémission de la maladie.
Un autre aspect, selon les auteurs, qui devrait être pris en compte lors de l’application de la stratégie ACT dans la pratique clinique est le potentiel de modification des signaux de sécurité lors d’une exposition prolongée à plusieurs immunosuppresseurs. Bien que les préoccupations en matière de sécurité n’aient pas été mises en avant jusqu’à présent, il est important de reconnaître que les données disponibles proviennent de petites études avec des périodes de suivi limitées. D’autres grandes études prospectives avec des périodes de suivi plus longues seraient donc nécessaires pour comprendre pleinement l’efficacité et la sécurité de cette stratégie. Des incertitudes subsistent également quant à savoir si la combinaison doit être utilisée exclusivement pour la phase d’induction ou si elle doit être étendue au traitement d’entretien.
Les résultats actuels, comme ceux de l’étude VEGA, montrent que l’association de nouveaux agents biologiques chez les patients biologiquement naïfs atteints de RCH modérément à sévèrement active permet d’obtenir une efficacité thérapeutique supérieure, tant sur le plan clinique qu’endoscopique, par rapport à un traitement monobiologique. Cependant, les données sont souvent limitées. En ce qui concerne l’avenir, les études actuellement en cours telles que les études DUET-CD et DUET-UC (qui évaluent l’association du guselkumab et du golimumab chez les patients atteints de MEC réfractaire) et l’étude VICTRIVA (qui évalue l’association du vedolizumab et de l’upadacitinib) promettent des données supplémentaires sur l’efficacité de l’ACT chez les patients atteints de la maladie de Crohn et de la colite ulcéreuse chez qui le traitement biologique a échoué, concluent le Dr. Wetwittayakhlang et le Dr Lakatos.
Littérature :
- Wetwittayakhlang P, Lakatos PL : Thérapie combinée avancée : est-ce le meilleur moyen de briser le plafond thérapeutique ? Therapeutic Advances in Gastroenterology 2024 ; 17 ; doi : 10.1177/17562848241272995.
GASTROENTÉROLOGIE PRATIQUE 2024 ; 2(2) : 22-23