L’épithélium normal de la plaque œsophagienne peut, sous l’effet de différents facteurs, donner naissance à une métaplasie intestinale, appelée épithélium de Barrette. Il peut en résulter des dysplasies de bas ou de haut niveau, qui peuvent à leur tour être associées à un adénocarcinome dangereux. L’article suivant discute de l’évolution, des facteurs de risque et des possibilités et nécessités de la surveillance. Le traitement des dysplasies “de haut grade” par résection de la muqueuse ou par ablation par radiofréquence donne de très bons résultats.
L’œsophage de Barrett est défini (du moins sous nos latitudes) comme la présence d’un épithélium cylindrique dans l’œsophage distal, avec en plus une métaplasie intestinale spécialisée (présence de cellules en gobelet, Fig. 1). Dans d’autres pays (par exemple en Angleterre, en France ou au Japon), la seule détection histologique de l’épithélium cylindrique suffit pour diagnostiquer un œsophage de Barrett [1, 2].
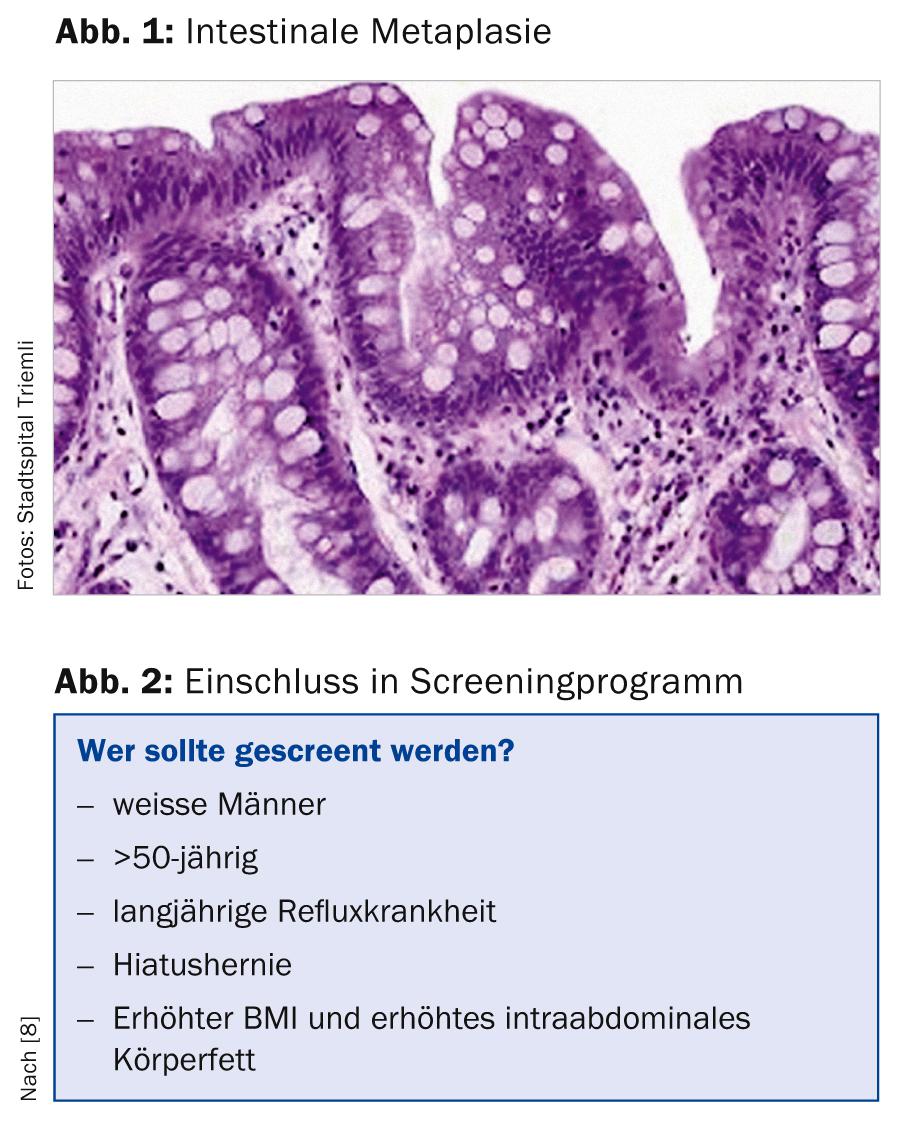
Nous distinguons l’œsophage de Barrett à segment long (langue épithéliale d’au moins 3 cm de long) de l’œsophage de Barrett à segment court (langue de Barrett plus courte que 3 cm).
Historique
L’épithélium normal de la plaque œsophagienne peut se transformer en métaplasie intestinale sous l’effet de différents facteurs. On la retrouve dans environ 5 à 20% des panendoscopies supérieures. L’épithélium de Barrette peut donner naissance à des dysplasies de bas ou de haut niveau qui peuvent évoluer vers un adénocarcinome. L’adénocarcinome de l’œsophage – surtout s’il est découvert tardivement – continue d’avoir un très mauvais pronostic, avec une survie à 5 ans d’à peine 20%, malgré l’amélioration des options thérapeutiques (radiochimiothérapie néoadjuvante) [3, 4].
Facteurs de risque connus pour le développement de l’œsophage de Barrett
Nous connaissons les facteurs de risque suivants pour le développement d’un épithélium de Barrette [5, 6] :
- Vieux
- Sexe masculin
- Troubles du reflux
- Origine caucasienne
- Fumer
- Longueur de l’œsophage de Barrett
- Obésité centrale
- Le diabète de type 2.
Dépistage et surveillance : généralités
Le risque annuel d’adénocarcinome de l’œsophage a probablement été largement surestimé dans les études anciennes et se situe à un niveau bas dans les études récentes (et plus larges), entre 0,1 et 0,3% par an chez les patients présentant un œsophage de Barrett non dysplasique. Selon une étude de cohorte réalisée au Royaume-Uni, plus de 95% des patients atteints d’œsophage de Barrett ne meurent pas d’un cancer de l’œsophage, mais principalement de maladies cardiovasculaires, de maladies pulmonaires ou d’autres affections tumorales [7]. C’est pourquoi, selon l'”American Gastroenterological Association” (AGA), les patients présentant de multiples facteurs de risque doivent être dépistés en priorité (figure 2) [8]. Le fait que l’œsophage de Barrett soit une lésion précancéreuse, généralement asymptomatique, plaide en faveur d’un dépistage de ces patients. De plus, comme décrit précédemment, l’adénocarcinome de l’œsophage a un mauvais pronostic, qui peut être amélioré par un traitement précoce.
Le principal argument contre le dépistage est que la progression naturelle de l’œsophage de Barrett vers le carcinome est faible. En outre, les endoscopies et les biopsies comportent certains risques (certes mineurs) et des coûts.
La surveillance, tout comme le dépistage, vise à réduire la mortalité due à l’adénocarcinome de l’œsophage. L’inclusion dans un programme de surveillance est justifiée par le fait que les dysplasies de haut grade ou les cancers précoces sont ainsi détectés le plus tôt possible et que les interventions précoces peuvent entraîner une réduction des coûts et de la mortalité. De plus, la surveillance donne souvent un sentiment de sécurité tant au patient qu’au médecin.
Les arguments contre l’inclusion dans un programme de surveillance sont que la détection endoscopique des dysplasies peut être relativement difficile et que les prélèvements de biopsie randomisés peuvent entraîner des “erreurs d’échantillonnage”. De plus, l’interprétation histologique des biopsies prélevées peut également être difficile et, comme mentionné précédemment, les endoscopies comportent des risques potentiels et génèrent des coûts.
Dépistage et surveillance : lignes directrices
Il existe plusieurs lignes directrices internationales sur la prise en charge des patients atteints d’œsophage de Barrett. Nous souhaitons aborder brièvement les directives de la Société américaine de gastroentérologie (ACG), auxquelles nous nous conformons pour l’essentiel à l’hôpital municipal Triemli (fig. 3) [9] :
Chez les patients présentant un œsophage de Barrett sans dysplasie, une deuxième gastroscopie doit être réalisée dans l’année et, si la dysplasie n’est toujours pas détectée, un suivi doit être effectué tous les trois ans.
En cas de détection de dysplasies de “bas grade”, il est recommandé de répéter la gastroscopie dans les six mois et de faire confirmer les dysplasies par un second pathologiste. Par la suite, des contrôles annuels sont recommandés jusqu’à ce que la muqueuse soit exempte de dysplasie à deux reprises.
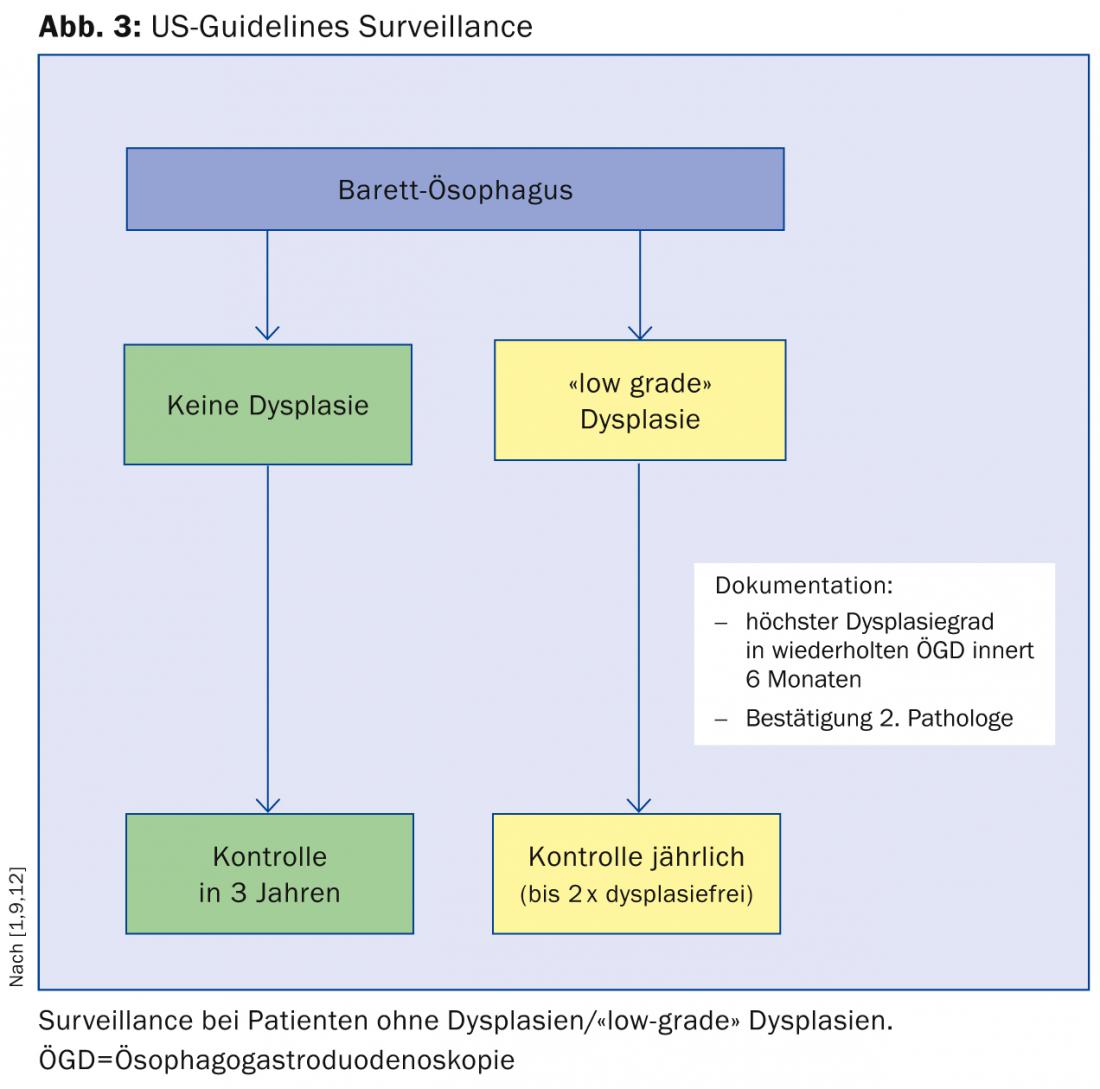
En cas de détection de dysplasie de haut grade, une confirmation par un deuxième institut de pathologie est également nécessaire. La suite de la procédure dépend alors de l’âge du patient, de l’expertise du centre concerné et des comorbidités.
Traitements de l’œsophage de Barrett et de l’adénocarcinome
Traitement par inhibiteur de la pompe à protons : un traitement par un inhibiteur de la pompe à protons (IPP, posologie 20-40 mg/j) en traitement continu est recommandé. Cela bien qu’il n’existe pas d’études randomisées contrôlées par placebo prouvant que le traitement par IPP entraîne une régression de l’épithélium métaplasique ou une réduction du développement de carcinomes [8].
Traitements des dysplasies “de haut grade” : les lésions macroscopiques visibles et de petite taille sont traitées par voie endoscopique par résection de la muqueuse (mucosectomie) ou par ablation par radiofréquence (RFA). Les patients présentant des lésions étendues doivent faire l’objet d’une discussion interdisciplinaire entre les gastroentérologues et les chirurgiens. Toutefois, selon les recommandations d’un groupe international d’experts multidisciplinaires, la résection endoscopique est en principe préférable au traitement chirurgical, car elle est associée à un taux de complications plus élevé [10].
La mucosectomie consiste à aspirer de grandes zones de muqueuse dans une capsule placée sur l’extrémité de l’endoscope. Les lésions peuvent alors être réséquées à l’aide d’une unité de coupe. Cette méthode permet non seulement de traiter les dysplasies “de haut grade” et les cancers précoces, mais aussi d’établir un staging définitif.
L’ablation par radiofréquence – la deuxième méthode la plus répandue pour l’ablation de l’épithélium de Barrett – consiste à décharger la muqueuse de Barrett en utilisant l’énergie de radiofréquence libérée par un ballonnet.
Le résultat à long terme de ces méthodes est très bon.
Par exemple, dans une étude récente, trois ans après l’ablation par radiofréquence, 98% des patients étaient exempts de dysplasie et 91% des patients ne présentaient aucune trace de muqueuse de Barrett [11].
CONCLUSION POUR LA PRATIQUE
- L’épithélium de Barrette peut présenter des dysplasies “de bas grade” ou “de haut grade” et, dans le pire des cas, un adénocarcinome dangereux.
- Pour les patients présentant un œsophage de Barrett sans dysplasie : une deuxième gastroscopie (dans l’année qui suit) et, si la dysplasie n’est toujours pas détectée, un contrôle de l’évolution (tous les trois ans).
- Dysplasies “de bas grade” : répétition de la gastroscopie dans les six mois et confirmation par un second pathologiste. Ensuite, contrôles annuels jusqu’à ce que la muqueuse soit exempte de dysplasie à deux reprises.
- “high-grade” dysplasies : également une confirmation par un deuxième institut de pathologie. La suite de la procédure dépend de l’âge du patient, de l’expertise du centre concerné et des comorbidités.
- Le traitement par un IPP est recommandé.
- Le traitement des dysplasies “de haut grade” par résection de la muqueuse ou par ablation par radiofréquence donne de très bons résultats.
- Sampliner RE, et al : Am J Gastroenterol 2002 ; 97 : 1888-1895.
- Messmann H, et al : Z Gastroenterol 2005 ; 43 : 184-190.
- Shaheen N, et al : Gastroenterology 2005 ; 128 : 1554-1566.
- Siegel R, et al : Cancer statistics, 2012. Cancer J Clin 2012 ; 62 : 10.
- Prasag G, et. al : Clin Gastroenterol Hepatol 2013 ; 11 : 1108.
- Wani, et al : Clin Gastroent and hepatol 2011 ; 9 : 220-227.
- Masoud S : Gastroenterology 2013 : 144 : 1375.
- AGA Institute Medical Position Panel : Gastroenterology 2011.
- Wang KK : AM J Gastroenterol 2008 ; 103 : 788-797.
- Bennett, et al : Gastroenterology 2012 ; 143 : 336.
- Shaheen NJ : Gastroenterol 2011 ; 141 : 460-468.
- Sharma P : NEJM 2009 ; 361 : 2548-2556.
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9(1) : 23-25











