Le diabète de type 1 est l’une des maladies métaboliques les plus courantes chez les enfants et les adolescents. Le diagnostic du diabète de type 1 représente un fardeau considérable pour les personnes concernées et leurs familles, en particulier lorsqu’elles sont jeunes. Le développement des traitements médicamenteux à base d’insuline et des immunomodulateurs ainsi que les progrès technologiques permettent de disposer d’options thérapeutiques de plus en plus innovantes pour atteindre les objectifs fixés au niveau international. Le traitement le plus avancé actuellement consiste à coupler un système de capteurs, un algorithme de contrôle et une pompe à insuline, le système AID (automated insulin delivery).
Le diabète de type 1 est l’une des maladies métaboliques les plus courantes chez les enfants et les adolescents. Actuellement (2021), 26 642 personnes vivent avec le diabète de type 1 en Suisse, avec une incidence d’environ 20 nouveaux cas pour 100 000 enfants et adolescents de moins de 16 ans. L’âge moyen au moment du diagnostic était de 8,8 ans (données publiées avec l’aimable autorisation de Daniel Konrad, Société suisse d’endocrinologie et de diabétologie pédiatriques). L’augmentation de l’incidence chez les enfants et les adolescents est observée depuis plusieurs années. On estime qu’il y a un doublement du nombre de cas tous les 20 ans. Les enfants qui tombent malades sont de plus en plus jeunes, de sorte que la charge pathologique cumulée de glucose et le risque de maladies cardiovasculaires secondaires augmentent en conséquence. Selon des estimations statistiques, la perte de durée de vie est d’environ 17 ans en cas de manifestation du diabète avant l’âge de 10 ans, en fonction bien sûr de l’équilibre métabolique [1,2].
On sait, en particulier depuis l’étude DCCT [3], à quel point il est important de maintenir les taux de glucose dans une plage cible définie afin d’éviter les complications ultérieures. C’est l’une des raisons pour lesquelles le diagnostic de diabète de type 1 représente un fardeau considérable pour les personnes concernées et leurs familles, en particulier lorsqu’elles sont jeunes. Le développement des traitements médicamenteux à base d’insuline et des immunomodulateurs, ainsi que les progrès technologiques, permettent de disposer d’options thérapeutiques de plus en plus innovantes pour atteindre les objectifs fixés au niveau international. Le traitement le plus avancé actuellement consiste à coupler un système de capteurs, un algorithme de contrôle et une pompe à insuline, le système AID (automated insulin delivery).
Développement de la technologie du diabète
Depuis les années 1980, le traitement par pompe à insuline (CSII) est utilisé de manière routinière en médecine adulte. Dans les années 2000, elle s’est progressivement établie comme traitement standard, y compris chez les enfants et les adolescents. Le développement des capteurs de glucose a permis la mise au point de systèmes de pompe à insuline assistés par capteur, c’est-à-dire le couplage du capteur et de la pompe à insuline. Il a d’abord été possible d’interrompre l’administration d’insuline en cas d’hypoglycémie (LGS, Low Glucose Suspend) (PARADIGM VEO), puis d’interrompre de manière prédictive l’administration d’insuline en cas de risque d’hypoglycémie (PLGM, Predictive Low Glucose Management) (MiniMed 640G). [4,5] L’administration d’insuline est alors interrompue pendant 5 à 120 minutes, selon le système, jusqu’à ce qu’une valeur cible de glucose définie soit à nouveau atteinte en toute sécurité. Ces dernières années, les systèmes AID ont permis de franchir de nouvelles étapes dans le contrôle automatique de l’insulinothérapie.
Parallèlement, des personnes ambitieuses atteintes de diabète de type 1 (“Looper Community”, “#WeAreNotWaiting”), qui ne voulaient pas attendre les systèmes disponibles dans le commerce, ont développé elles-mêmes des algorithmes open source et des instructions de construction, les ont couplés à des pompes à insuline et des systèmes CGM traditionnels et les ont transformés en systèmes semi-automatisés. Ces systèmes open source ou Do-it-yourself (DIY) sont soumis à un processus d’amélioration continue par les utilisateurs, donnent de bons voire de très bons résultats et ont favorisé le développement de systèmes approuvés commercialement [6,7]. En cas d’utilisation de ces systèmes de bricolage, il faut toutefois tenir compte du fait que la responsabilité du fabricant est annulée, car ces dispositifs médicaux sont utilisés en dehors de l’usage prévu par le fabricant. Vous n’êtes pas soumis à une procédure d’admission. Contrairement aux médicaments, qui peuvent être utilisés en dehors de l’autorisation de mise sur le marché (off label use) en cas d’indication et de consentement des parents, cette possibilité n’existe pas pour les dispositifs médicaux, ne serait-ce que pour des raisons juridiques.
En raison de données convaincantes et d’une expérience toujours positive dans tous les groupes d’âge, les systèmes AID sont recommandés dans les lignes directrices de consensus de l’ISPAD [8,9] et également dans les lignes directrices S3 de l’Association allemande du diabète [10] dans tous les groupes d’âge.
AID – Dosage automatique de l’insuline
Les systèmes AID se composent de trois éléments : Un capteur de glucose, un algorithme de calcul et une pompe à insuline. L’algorithme de calcul est intégré à la pompe à insuline, à une application pour smartphone ou à un appareil portable séparé et couplé au système de capteurs. L’algorithme de calcul contrôle l’administration basale adaptative d’insuline.
Les systèmes AID actuellement disponibles dans le commerce sont basés sur différents algorithmes de calcul, issus à l’origine de la technologie de contrôle industriel. Le principe de base est que les valeurs de glucose sont mesurées et que l’algorithme détermine la différence entre la valeur actuelle et une valeur cible définie, puis calcule la modification de la grandeur de commande à délivrer. La variable d’ajustement, l’insuline, est libérée et le cycle recommence. Il existe trois algorithmes de calcul principaux différents qui peuvent être utilisés [11].
| Critères de sélection pour un AID |
| – Limite d’âge |
| – Quantité d’insuline/poids corporel |
| – Contrôle : application, pompe, appareil séparé |
| – Tube oui/non ? |
| – Préférence du capteur |
| – Problèmes de peau |
| – Facilité d’utilisation |
| – Téléchargement automatique des données |
PID (Proportionnel-Intégral-Dérivé)
Cet algorithme est relativement simple et ne nécessite pas de simulation complexe de l’évolution du glucose. Il fonctionne de la même manière qu’un régulateur de température dans le domaine du chauffage, qui tente de maintenir la température ambiante constante à une valeur cible définie. Il ne nécessite que peu de paramètres à régler, tels que la durée d’action de l’insuline et les rapports d’IC, mais ne peut compenser que partiellement les fortes variations de glucose (MiniMed 780G).
MPC (contrôle prédictif de modèle)
Nous nous basons ici sur un modèle de référence qui tente d’améliorer les variables du processus de manière itérative. L’évolution actuelle des valeurs est comparée à la référence. Il permet de calculer l’ampleur de la variation de la variable d’ajustement nécessaire pour revenir au modèle de référence. Le facteur décisif est la qualité des variables de processus (CamAPS FX, myLife ; Control IQ, Tandem ; OmniPod 5, Insulet ; DBLG1, Diabeloop).
Logique floue
Il s’agit d’un modèle d’incertitude mathématique utilisé, par exemple, dans les systèmes intelligents de gestion des feux de circulation, qui adapte la longueur de la phase des feux au volume du trafic. Il peut gérer le flou des décisions humaines et effectue des ajustements selon le principe du “si-alors”. Pour cela, l’algorithme a besoin de nombreux scénarios possibles, car il ne peut fonctionner que dans des scénarios connus [12].
Le défi pour tous les algorithmes réside dans les nombreux facteurs d’influence inconnus. La nuit, il est généralement possible d’atteindre des taux de glucose normaux dans la plage cible avec une faible marge de variation. En revanche, le déroulement de la journée est soumis à de nombreux facteurs d’influence variables, tels que les différents repas, les facteurs de stress psychologiques fluctuants ou l’activité physique spontanée. La principale différence entre les systèmes AID réside dans les paramètres qui peuvent être modifiés activement par les utilisateurs et ceux qui sont imposés par le système. Le conseil en matière de choix du système s’oriente également de manière décisive sur ce point.
| Valeurs cibles pour le contrôle métabolique |
| – HbA1c <7% (53 mmol/mol) |
| – Time in Range (TiR) 70-180 mg/dl (3,9-10 mmol/l) : >70% |
| – Time below Range (TbR) 54-70 mg/dl (3,0-3,9 mmol/l) : <4% |
| – Time below Range (TbR) <54 mg/dl (3,0 mmol/l) : <1% |
| Futur : Tight in Tight Range (TiTR) 70-140 mg/dl (3,9-7,8 mmol/l) : >50% [22] |
Les systèmes AID actuellement disponibles sont des systèmes AID “hybrides” avec un apport d’insuline basal adaptatif, non lié à l’alimentation. Les bolus d’insuline prandiale et les bolus de correction rarement nécessaires doivent toujours être saisis manuellement, d’où l’appellation “AID hybride”.
Le développement technique de ces systèmes progresse rapidement, de sorte que l’on peut s’attendre à de nouveaux systèmes tous les 18 mois en moyenne. Les systèmes approuvés en Europe sont présentés dans le tableau 1. Les systèmes AID pour enfants et adolescents qui peuvent être prescrits en Suisse sont le mylife Ypsopump avec l’application mylife CamAPS FX, le Tandem t:slim X2 avec Control IQ et le MiniMed 780G de Medtronic. Un seul système est actuellement disponible, en particulier pour les familles avec des enfants en bas âge, pour lesquelles il est particulièrement difficile d’obtenir un contrôle métabolique proche de la normale. En Allemagne, depuis l’automne 2023, l’OmniPod 5 peut en outre être prescrit pour les enfants à partir de 2 ans.
Quel système AID pour qui ?
Le choix d’un système AID est individuel. Tous les systèmes ne conviennent pas à tout le monde. Plusieurs facteurs entrent en ligne de compte dans la décision. Tout d’abord, les restrictions d’âge doivent être prises en compte. Pour les enfants <6 ans, seul un système AID (CamAPS FX dès 1 an) est actuellement disponible en Suisse [13]. En Allemagne, un deuxième système, l’OmniPod 5 (à partir de deux ans), est disponible pour les enfants <6 ans. À partir de six ans, le t:slim X2 Control IQ est une autre option et à partir de sept ans, le MiniMed 780G [14,15]. Outre la limite d’âge, le poids corporel ou la quantité minimale d’insuline peuvent jouer un rôle dans la décision. Il faut tenir compte du fait que le contrôle doit être effectué via une application pour smartphone, la pompe à insuline ou un dispositif de contrôle séparé. La facilité d’utilisation est un autre facteur, l’utilisation principalement par icônes (CamAPS FX) pour les barrières linguistiques ou par repas fixes (CamAPS FX) pour les difficultés de calcul peut être utile. Lorsque l’OmniPod 5 est disponible, la question d’une pompe à insuline avec ou sans tubulure est souvent centrale [16]. Le cas échéant, la préférence pour un système de capteurs auquel la pompe à insuline peut être couplée doit être prise en compte lors de la prise de décision. S’il existe un problème de peau dû à une intolérance à certaines compositions de pansements ou de boîtiers, cela peut limiter les possibilités de choix. Un dernier facteur de décision pour ou contre un système AID peut être le logiciel. Chaque système AID doit être lu directement à l’aide d’un logiciel. Jusqu’à présent, il n’existe pas de logiciel compatible avec tous les systèmes, ce qui signifie que chaque établissement de soins doit acquérir et pouvoir se permettre d’utiliser différents systèmes logiciels.
Pour simplifier le processus de décision, il serait souhaitable que les trois composantes du système AID puissent être librement combinées. L’autorité sanitaire américaine (FDA) s’est fixé comme objectif cette interopérabilité et a défini à partir de là des objectifs et des normes pour les capteurs et les pompes à insuline. En Europe, l’objectif d’interopérabilité n’est pas encore prévisible avec le règlement “Medical Device” entré en vigueur depuis mai 2021 [17]. Depuis novembre 2022, il existe au moins un système AID, le “MyLife CamAPS FX”, qui peut être utilisé avec deux capteurs de glucose différents. Il est prévu que le “t:slim X2 Control IQ” soit également compatible avec deux systèmes de capteurs différents (Dexcom G6 et G7) début 2024.
Objectif en vue – avec AID
En général, il est préférable de commencer le traitement par pompe à insuline tôt, dans les six premiers mois suivant le diagnostic, plutôt que plus tard, deux à trois ans après la manifestation du diabète. La comparaison de plus de 8 332 patients issus de 311 centres de diabète en Allemagne, en Suisse, en Autriche et au Luxembourg montre que l’utilisation précoce d’une pompe à insuline chez les enfants et les adolescents a permis d’améliorer le contrôle métabolique, de réduire les hypoglycémies sévères et d’améliorer les valeurs de la pression artérielle et du cholestérol [18]. L’efficacité et la sécurité des systèmes AID ont été largement évaluées. Par rapport à toutes les autres formes de traitement, les systèmes AID permettent d’atteindre plus facilement les valeurs cibles recommandées au niveau international. Les valeurs d’HbA1c visées sont <7% (53 mmol/mol), Time in Range (TiR) >70% (environ 16 heures par jour), Time below Range (TbR) <4% (<1 heure par jour). On décrit des taux de glucose moyens plus bas, moins de variabilité dans l’évolution du glucose, une amélioration de la qualité du sommeil et une réduction du temps consacré à la gestion du diabète [19–21].
En résumé, les systèmes AID, quel que soit le système et l’algorithme utilisé, permettent d’améliorer considérablement les résultats thérapeutiques. Cela conduit à son tour à discuter d’objectifs thérapeutiques plus étroits ou de valeurs cibles, comme 50% Time in Tight Range (TiTR 70-140 mg/dl ou 3,9-7,8 mmol/l) [23,24], qui sont déjà appliqués et atteints en Suède par exemple. Dans l’ensemble, les meilleurs résultats sont obtenus par les utilisateurs qui atteignent déjà un TiR élevé au début d’un traitement contre le SID. D’autre part, ceux qui bénéficient le plus, en pourcentage, sont ceux dont le contrôle métabolique initial est trop élevé [25].
Comment fonctionne un système AID ?
AID et correction
Tous les systèmes AID peuvent corriger les excursions de glucose en augmentant l’administration d’insuline. La correction automatique s’effectue, selon le système, par le biais de bolus de correction automatiques (t:slim X2 Control IQ), de la modulation du débit basal adaptatif (MiniMed 780G, OmniPod 5, CamAPS FX) ou/et de microbolus supplémentaires délivrés (MiniMed 780G, OmniPod 5). (Fig. 1). Par exemple, si la correction est effectuée à l’aide de microbolus supplémentaires ou de bolus de correction automatiques, le débit basal, qui était déjà élevé, est ensuite à nouveau réduit, de sorte que l’insuline basale et le bolus de correction ne peuvent pas être clairement différenciés. Il faut donc s’écarter de l’hypothèse longtemps admise d’un rapport basal/bolus de 50:50 ou 60:40. En fin de compte, il importe peu que l’insuline entrante soit une insuline basale ou un bolus.
Gestion des repas avec AID
Dans tous les systèmes actuellement disponibles sur le marché, l’insuline pour les repas doit être administrée manuellement. L’annonce du repas doit être saisie soit directement dans la pompe à insuline (MiniMed 780G, t:slim X2 Control IQ), soit dans un boîtier de commande (OmniPod 5), soit via une application pour smartphone (CamAPS FX). Outre la saisie des glucides au gramme près, certains systèmes permettent de prédéfinir des repas semi-quantitatifs ou d’utiliser des facteurs de calcul (CamAPS FX). Le calcul des glucides continue de jouer un rôle, mais son importance diminue, car il est également possible d’atteindre des objectifs internationaux avec des quantités fixes de glucides adaptées à chaque individu [26]. Des écarts de quantité de 10 à 20 % peuvent généralement encore être facilement compensés par le système. L’insuline en bolus pour les repas est calculée à partir du rapport insuline/glucides (ICR = Insulin Carb Ratio). Il s’agit de la définition du nombre de grammes de glucides couverts par une unité d’insuline (U). Il est important de former les utilisateurs en conséquence, car le changement de mentalité n’est pas facile à mettre en œuvre lorsque l’on calcule des UC ou des UB depuis des années et présente un grand potentiel d’erreur. Un contrôle régulier du RIC reste nécessaire et, dans certains cas, une formation de suivi est également requise.
De même, le débit basal doit être ajusté régulièrement pour répondre à un besoin actuel. Pour le système “Control IQ”, celui-ci est nécessaire pour la mise en œuvre de la thérapie AID, pour tous les autres systèmes, il est nécessaire comme sauvegarde.
L’excursion postprandiale du glucose ne doit pas dépasser 60 mg/dl (3,3 mmol/l) par rapport à la valeur initiale préprandiale, 2-3 heures après le repas (Fig. 2). Des quantités de glucides de 60 à 80 g sont généralement faciles à couvrir. Si les quantités de glucides sont très importantes, il est possible, le cas échéant, de régler une administration maximale de bolus comme protection contre une administration excessive d’insuline et une hypoglycémie consécutive.
Les repas copieux ont tendance à nécessiter moins d’insuline. Outre le calcul des quantités de glucides, il était utile, avec les pompes à insuline traditionnelles, de calculer les unités lipides-protéines (UPP) pour les repas riches en graisses et en protéines, afin d’utiliser efficacement des fonctions telles que le “bolus dual” ou le “bolus retardé”. Certains systèmes AID offrent encore cette possibilité de répondre explicitement aux repas contenant des graisses et des protéines, par exemple en entrant un “bolus dual” ou “retardé” (t:slim X2 Control IQ) ou en modifiant la sensibilité au glucose en entrant des repas à absorption lente (CamAPS FX). D’autres systèmes réagissent comme s’il s’agissait d’une correction, en modulant le débit basal ou en délivrant des autocorrections supplémentaires.
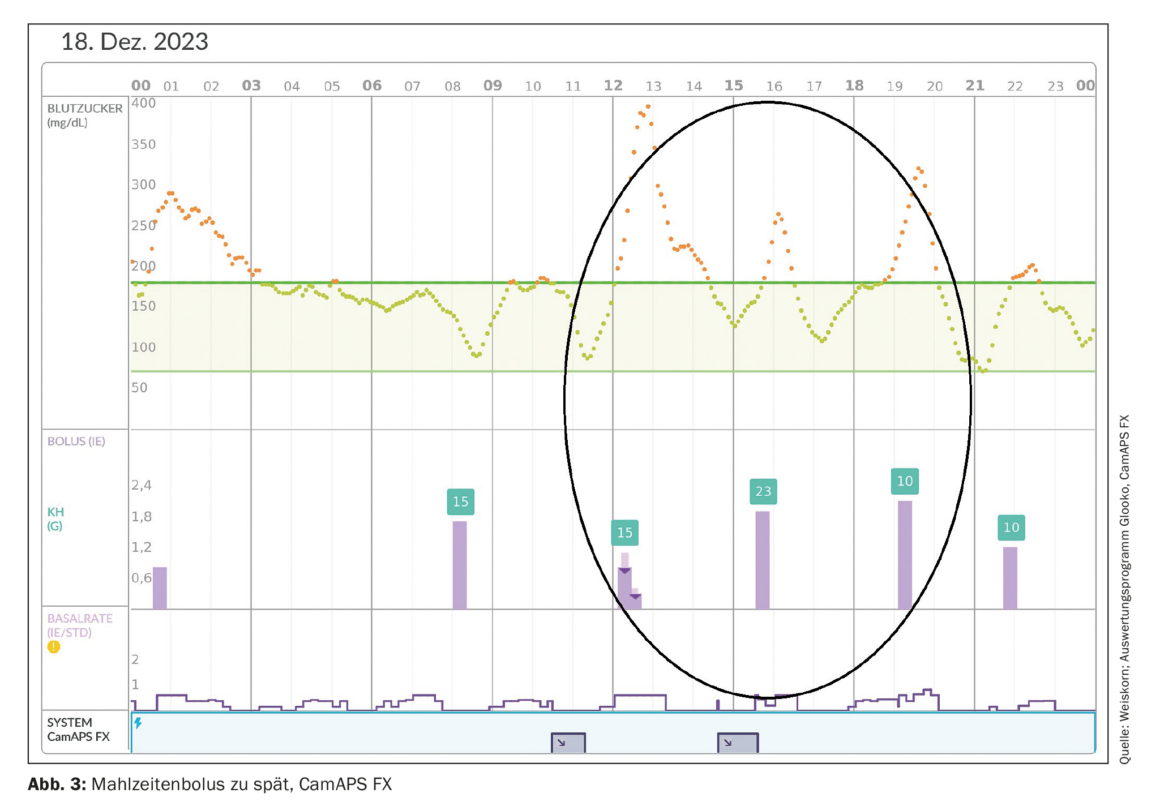
Outre l’entrée approximativement exacte des glucides, le moment de l’intervalle bolus-manger initié manuellement joue toujours un rôle important. Le bolus repas doit être administré au moins 10 minutes, de préférence 20 minutes avant un repas. Si la délivrance est retardée, l’augmentation du taux de glucose entraîne une régulation à la hausse de la délivrance actuelle d’insuline par l’algorithme. Un bolus initié trop tard pendant ou après le repas n’est pas pris en compte, car il entraînerait une accumulation d’insuline et probablement une hypoglycémie consécutive. (Fig. 3). En règle générale, il est recommandé : Si un bolus repas a été oublié à temps, la moitié du bolus repas doit être administrée 30 à 60 minutes après le repas, c’est-à-dire avant que l’algorithme ne tente de compenser le repas complet. Si plus de 60 minutes se sont écoulées depuis le repas, un bolus de correction recommandé par le système peut être administré par l’utilisateur. En règle générale, le moment de la journée (en particulier le petit-déjeuner), le taux de glucose actuel, la tendance du glucose et la composition du repas doivent être pris en compte pour administrer le bolus repas au moment opportun.
SID et activité physique
Quelle que soit la forme de thérapie, l’adaptation du traitement en cas de sport représente un défi majeur. De nombreux facteurs d’influence doivent être pris en compte, tels que le moment de la journée, l’intensité, le type et la durée du sport, l’état de forme individuel, l’activité physique habituelle ou les nouvelles formes d’exercice, le cycle menstruel, mais aussi le taux et la tendance actuels du glucose. Même si tous les facteurs mentionnés sont pris en compte et que le sport est pratiqué de manière plus ou moins standardisée, l’évolution du glucose sera toujours différente. Non seulement le sport, mais aussi la gestion de l’activité physique au quotidien, qui n’est délibérément pas définie comme un sport, comme aller à l’école à vélo, courir pour prendre le bus ou courir à la maternelle ou pendant la récréation, représentent souvent un défi individuel quotidien entre l’hypoglycémie et l’hyperglycémie. Les systèmes AID peuvent aider à maintenir la stabilité du glucose avant, pendant et après une activité physique et à réduire les hypoglycémies jusqu’à 24 heures après l’exercice.
Alors que sans AID, la gestion du sport se fait par une réduction en pourcentage de l’insuline basale et/ou de l’insuline prandiale, les systèmes AID fonctionnent avec une augmentation de la valeur cible du glucose et de la sensibilité à l’insuline. Par exemple, le mode sport de “CamAPS FX” “Ease off” fonctionne avec ces deux vis de réglage. Il peut être réglé jusqu’à 24 heures à l’avance. L’insuline en bolus reste inchangée. “Control IQ”, en “mode activité”, augmente la plage cible à 140-160 mg/dl (7,8-8,9 mmol/l) et la sensibilité à l’insuline. Avec le système “MiniMed 780G”, l’objectif temporaire peut être porté à 150 mg/dl (8,3 mmol/l). Les autocorrections ne sont pas délivrées lors de l’augmentation temporaire de la valeur cible. Lorsque l’OmniPod 5 est utilisé en mode sport, la valeur cible de glucose est également augmentée à 150 mg/dl (8,3 mmol/l) et l’administration automatisée d’insuline est également réduite pendant une durée de 1 à 24 heures [27].
Pour tous les systèmes, le mode sport ou activité est idéalement réglé au moins 1 à 2 heures avant le début de l’activité physique, en particulier pour les efforts aérobies. Lors d’une séance d’entraînement très intense ou de longue durée, par exemple un jour de compétition, le mode sport peut rester activé jusqu’à 24 heures pour réduire les hypoglycémies dues à l’effet de reconstitution du glycogène par le muscle. Lors de séances d’entraînement anaérobie et même de séances d’entraînement aérobie intensives plus courtes, on peut essayer de laisser le système AID en “mode normal” dans un premier temps, car les hormones contra-insuliniques que sont l’adrénaline, la noradrénaline et le cortisol entraînent d’abord une augmentation du glucose qui peut nécessiter une insuline de correction. Idéalement, la valeur du glucose avant le début et après la fin de l’exercice se situe entre 125 et 180 mg/dl (6,9-10 mmol/l) [28]. Si vous prévoyez un entraînement intensif de courte durée, il est préférable de commencer par un niveau de glucose plus bas, alors qu’un niveau de glucose plus élevé convient à un entraînement modéré de longue durée. Les systèmes AID facilitent la gestion du sport et de l’activité physique, mais ils atteignent aussi leurs limites lorsqu’il s’agit d’une activité spontanée, très intense ou de longue durée et que le mode sport n’est pas réglé à temps.
Adaptation du traitement avec AID
En raison de l’utilisation prédominante de systèmes CGM, l’adaptation du traitement par l’HbA1c et les protocoles glycémiques a déjà été remplacée par le “profil glycémique ambulatoire” (AGP). Outre le taux d’HbA1c, l’analyse du TiR, du TbR, du GMI, des valeurs moyennes de glucose, de l’étendue de la dispersion et également de la durée du tracé du capteur sont déjà des standards dans la consultation diabétologique. Avec les systèmes AID, des données continues et en temps réel sont disponibles dans le cloud. Seul le “t:slim Control IQ” nécessite encore un téléchargement actif des données système. Outre les paramètres statistiques de l’AGP, il est possible d’analyser précisément le comportement individuel des utilisateurs, comme par exemple la distribution d’un bolus repas au bon moment ou l’utilisation de différents modes. Une adaptation individualisée des paramètres est théoriquement possible à tout moment. Cela ouvre également de nouvelles possibilités de soins individuels de qualité dans le domaine de la télémédecine.
Le SID – un succès en soi ?
AID et ça marche ? Ce n’est pas si simple, un système AID ne se suffit pas à lui-même. Plus l’enfant est jeune, plus l’effort à fournir pour atteindre les objectifs métaboliques est important. Pour les jeunes enfants, la responsabilité de la thérapie incombe aux personnes qui s’en occupent. Les jeunes enfants ne sont pas encore prêts à être scolarisés. Ils peuvent parfois saisir et comprendre des aspects isolés de leur thérapie, mais ne peuvent pas lire ou calculer. La scolarisation commence à l’âge de l’école primaire. Ce n’est qu’au fur et à mesure de leur maturité scolaire, généralement lors du passage à l’école secondaire, que les enfants sont capables de saisir et d’effectuer des calculs simples, nécessaires à la prise de décision thérapeutique concernant l’administration d’insuline. Les exigences et les défis que les parents doivent relever jusqu’à ce moment-là sont par conséquent élevés [29].
Indépendamment de l’âge, il est important d’aborder les attentes vis-à-vis du système AID correspondant. Avant de choisir l’un ou l’autre système, il est nécessaire de faire une démonstration des systèmes disponibles et dûment approuvés et d’expliquer leurs avantages et inconvénients. Une fois qu’un système a été choisi, une formation qualifiée et adaptée à l’âge est indispensable. Un succès thérapeutique durable ne peut être obtenu que si le système AID est compris et si les exigences qu’il impose peuvent être satisfaites de manière appropriée et en fonction de la situation [30,31]. Si les fonctions du système ne sont pas suffisamment transmises, les besoins et les attentes ne sont pas satisfaits, cela peut conduire à un arrêt prématuré du traitement [32].
SID et charge mentale
L’un des arguments en faveur d’un système AID est souvent la réduction de la charge mentale et l’amélioration de la qualité de vie. C’est particulièrement vrai pour les parents qui ont souffert d’un sommeil nocturne perturbé par de nombreuses alertes nocturnes en cas d’hypoglycémie imminente et de mesures de la glycémie. Les systèmes AID permettent d’atteindre de bonnes valeurs de glucose avec une faible marge de fluctuation, en particulier pendant la nuit. Les hypoglycémies et les alarmes nocturnes sont réduites et la qualité du sommeil est nettement améliorée [33] (Fig. 4). Un sommeil nocturne réparateur va de pair avec un état d’esprit plus stable et peut réduire les tendances à la dépression. Une réduction de l'”hypo-anxiété” est également décrite [34].
Pour les personnes pour lesquelles les excursions de glucose vers le haut ou vers le bas sont difficiles à supporter et qui ont tendance à faire des corrections hâtives, un système AID qui prend en charge la correction de manière autonome peut être un soulagement et réduire le stress. Or, c’est précisément ce point fort des systèmes, le dosage automatique de l’insuline, qui peut avoir l’effet inverse. Si les utilisateurs ne font pas confiance au système, s’ils ont peur de perdre le contrôle ou de laisser l’algorithme gérer la thérapie, les objectifs thérapeutiques ne seront pas atteints et les attentes seront déçues.
Résumé et perspectives
En diabétologie pédiatrique, les capteurs de glucose et les pompes à insuline font partie du traitement standard. Le couplage des deux composants et leur combinaison avec un algorithme pour former un système AID est de plus en plus utilisé dans le monde. Les objectifs thérapeutiques peuvent être atteints plus facilement et les aspects psychosociaux améliorés. Pour obtenir un succès thérapeutique durable, le choix d’un système doit être fait individuellement, en tenant compte de toutes les restrictions d’autorisation, en collaboration avec la famille et l’équipe soignante du diabète. Une formation structurée et adaptée à l’âge des participants est une condition préalable à une utilisation efficace du système.
Les systèmes AID font actuellement l’objet d’un développement continu, dont l’aboutissement est le système “Fully-Closed-Loop”. Pour atteindre cet objectif, il faudra certainement des systèmes bi-hormonaux qui, jusqu’à présent, font l’objet de recherches actuelles mais ne sont pas encore disponibles commercialement.
Le développement rapide et la multiplication des systèmes AID commerciaux représentent un défi majeur pour les équipes de diabétologie afin de garantir une prise en charge de qualité. Des structures doivent être mises en place pour permettre le conseil, la formation et l’enseignement des fonctions détaillées du système, qui sont absolument nécessaires.
En conclusion, tous les systèmes autorisés en Europe sont sûrs et efficaces et peuvent conduire à un meilleur contrôle glycémique. Cela se traduit non seulement par un TiR plus élevé, mais aussi par des taux d’HbA1c plus faibles, ce qui, en fin de compte, réduit le risque de maladies secondaires liées au diabète et soulage les enfants et les adolescents atteints de diabète de type 1 et leurs familles.
Messages Take-Home
- En diabétologie pédiatrique, les capteurs de glucose et les pompes à insuline font partie du traitement standard. Le couplage des deux composants et leur combinaison avec un algorithme pour former un système AID est de plus en plus utilisé dans le monde.
- Les objectifs thérapeutiques peuvent être atteints plus facilement et les aspects psychosociaux améliorés.
- Pour obtenir un succès thérapeutique durable, le choix d’un système doit être fait individuellement, en collaboration avec la famille et l’équipe soignante du diabète.
- Une formation structurée et adaptée à l’âge des utilisateurs est une condition préalable à une utilisation efficace du système. Les jeunes enfants ne sont pas encore capables de suivre une formation, la responsabilité de la thérapie incombe donc aux personnes qui s’en occupent.
Conflits d’intérêts
- Dr. med. Jantje Weiskorn, spécialiste en pédiatrie et en diabétologie ; adiposiologue. Intérêts financiers : Honoraires de conférence : Amryt Pharma
- Dr Felix Reschke, Spécialiste en pédiatrie, diabétologie et endocrinologie, soins palliatifs, conseil génétique spécialisé ; Intérêts financiers : Honoraires de conférence : Kyowa Kirin
- Dr. med. Thekla von dem Berge, Spécialiste en pédiatrie et en diabétologie ; Intérêts financiers : Honoraires de conférencier : Medtronic, Ypsomed, Novo Nordisk, VitalAire, Ascensia et Sanofi.
- Dr. med. Mareike Niemeyer, Spécialiste en pédiatrie et en diabétologie ; Intérêts financiers : aucun
- PD Dr. med. Torben Biester, Spécialiste en pédiatrie, diabétologie, médecine d’urgence, conseil génétique spécialisé ; Intérêts financiers : Honoraires de conférence : AstraZeneca, Insulet, Lilly, Medtronic, NovoNordisk, Roche, Sanofi, Ypsomed. – Conseil consultatif : Ascensia, Medtronic, Insulet, Sanofi, Ypsomed
Littérature :
- Rawshani A, et al : Excès de mortalité et de maladies cardiovasculaires chez les jeunes adultes atteints de diabète de type 1 en fonction de l’âge à la naissance : une étude de cohorte nationale basée sur les registres. Lancet 2018 ; 392 : 477-486 ; doi : 10.1016/S0140-6736(18)31506-X.
- Arffman M, et al : Long-term and recent trends in survival and life expectancy for people with type 1 diabetes in Finland. Diabetes Research and Clinical Practice 2023 ; 198 : 110580.
- Diabetes Control and Complications Trial Research Group, N. D., Genuth S, et al : The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993 ; 30(14) : 977-986.
- Forlenza GP, et al : Predictive low-glucose suspend reduces hypoglycemia in adults, adolescents and children with type 1 diabetes in an at-home randomized cross-over study : results of the PROLOG Trial. Diabetes Care 2018 ; 41(10) : 2155-2161.
- Biester T, et al : “Let the Algorithm Do the Work” : Réduction de l’hypoglycémie grâce à un traitement par pompe à capteur augmenté avec suspension prédictive d’insuline (smardguard) chez les patients pédiatriques atteints de diabète de type 1. Diabetes Technol Ther 2017 ; 19(03) : 173-182.
- Drew L, et al : Le “pancréas bionique” DIY change le traitement du diabète – et après ? Nature 2023 ; 620 : 940-941.
- Burnside MJ, et al : Open-Source Automated Insulin Delivery in Type 1 Diabetes. N Engl J Med 2022 ; 397(10) : 869-881.
- Sher JL, Schoelwer M, Dos Santos TJ, et al. : ISPAD Clinical Practice Consensus Guidelines 2022 : Diabetes technologies : Insulin delivery. Pediatr Diabetes 2022 ; 23(8) : 1406-1431 ;
doi : 10.1111/pedi.13421. - Sundberg F, de Beaufort C, Krogvold L, et al : ISPAD Clinical Practice Consensus Guidelines 2022 : Managing diabetes in preschoolers. Pediatr Diabetes 2022 ; 23(8) : 1496-1511 ; doi : 10.1111/pedi.13427.
- Ligne directrice S3 Diagnostic, traitement et suivi du diabète sucré de l’enfant et de l’adolescent(https://register.awmf.org/de/leitlinien/detail/057-016).
- Biester T, Reschke R, et al. : Insulinothérapie moderne par systèmes interactifs chez les enfants atteints de diabète sucré de type 1. Internistische praxis 2023 ; 66/4.
- Les systèmes Digital Corner AID dans la pratique – Statu quo et potentiel de la technologie du diabète.
- Tauschmann M, et al : Closed-loop insulin delivery in suboptimally controlled type 1 diabetes : a multicenter, 12-week randomized trial. Lancet 2018 ; 392 : 1321-1329 ; doi : 10.1016/S0140-6736(18)31947-0.
- Bergenstal RM, et al : A comparison of two hybrid closed-loop systems in adolescents and young adults with type 1 diabetes (FLAIR) : a multicenter, randomized, crossover trial. Lancet 2021 ; 397 : 208-219 ; doi : 10.1016/S0140-6736(20)32514-9.
- Collyns OJ, et al : Improved Glycemic Outcomes With Medtronic MiniMed Advanced Hybrid Closed-Loop Delivery : Results From a Randomized Crossover Trial Comparing Automated Insulin Delivery With Predictive Low Glucose Suspend in People With Type 1 Diabetes. Diabetes Care 2021 ; 44(4) : 969-975 ; doi : 10.2337/dc20-225.
- Sherr JL, et al. : Sécurité et performance du système hybride en boucle fermée Omnipod chez les adultes, les adolescents et les enfants atteints de diabète de type 1 pendant plus de 5 jours dans des conditions de vie libre. Diabetes Technol Ther 2020 ; 22(3) : 174-184.
- https://health.ec.europa.eu/system/files/2020-07/md_generic_
fs_en_0.pdf. - Kamrath C, et al : Traitement par pompe à insuline précoce ou retardé chez les enfants atteints de diabète de type 1 nouvellement diagnostiqué : résultats de l’enregistrement multicentrique et prospectif de suivi du diabète DPV. The Lancet Child & Adolescent Health 2021 ; 5(1) : 17-25.
- Pease A, et al : Time in Range for Multiple Technologies in Type 1 Diabetes : A Systematic Review and Network Metaanalysis. Diabetes care 2020 ; 43 : 1967-1975.
- Jiao X, et al : Meilleur TIR, HbA1c, et moins d’hypoglycémie dans un système d’insuline en boucle fermée chez les patients atteints de diabète de type 1 : une méta-analyse. BMJ Open Diabetes Res Care 2022 ; 10(2).
- Beck RW, et al. : A Meta-Analysis of Randomized Trial Outcomes for the t:slim X2 Insulin Pump with Control_IQ Technology in Youth and Adults from Age 2 to 72. Diabetes Technol Ther 2023.
- Battelino T, Alexander CM, et al : Surveillance continue du glucose et métriques pour les essais cliniques : une déclaration de consensus international. Lancet Diabetes Endocrinol 2022 ; doi : 10.1016/S2213-8587(22)00319-9.
- Passanisi S, et al. : Aiming for the Best Glycemic Control Beyond Time in Range : Time in Tight Range as a new CGM Metric in Children and Adolescents with Type 1 Diabetes using Different Treatment Modalities. Diabetes Technol Ther 2023 ; doi : 10.1089/dia.2023.0373.
- Beck RW, et al. : A Comparison of Continuous Glucose Monitoring-Measured Time-in-Range 70-180 mg/dl Versus Time-in Tight-Range 70-149 mg/dl. Diabetes Technol Ther 2023 ; doi : 10.1089/dia.2023.0380.
- Schoelwer MJ, et al : Predictors of Time-in-Range (70-180 mg/dl) Achievend Using a Closed-Loop Control System. Diabetes Technol Ther 2021 ; doi : 10.1089/dia20200646.
- Petrovski G, Campbell J, et al : Simplified Meal Announcement Versus Precise Carbohydrate Counting in Adolescents With Type 1 Diabetes Using the MiniMed 780G Advanced Hybrid Closed Loop System : A Randomized Controlled Trial Comparing Glucose Control. Diabetes Care 2023 ; 46(3) : 544-550 ; doi : 10.2337/dc22-1692.
- Riddel MC, et al : Exercice chez les adultes atteints de diabète sucré de type 1. Nature Reviews Endocrinology 2023 ; 19(2) : 98-111.
- Moser O, et al. : Glucose management for exercise using continuous glucose monitoring (CGM) and intermittently scanned CGM systems (isCGM) in type 1 diabetes : position statement of the European Association for the Study of Diabetes (EASD) and of the International Society for Pediatric and Adolescent Diabetes (ISPAD) endorsed by JDRF and supported by the American Diabetes Association (ADA). Diabétologie 2020 ; 63(12) : 2501-2520 ; doi : 10.1007/s00125-020-05263-9.
- Dehn-Hindenberg A, et al. : Conséquences professionnelles à long terme pour les familles d’enfants atteints de diabète de type 1 : les mères prennent le fardeau. Diabetes Care 2021 ; 44(12) : 2656-2663.
- Messer LH, et al : A Clinical Guide to Advanced Diabetes Devices and Closed-Loop Systems Using the CARES Paradigm. Diabetes Technol Ther 2019 ; 21(8) : 462-469 ; doi : 10.1089/dia.2019.0105.
- Berget C, et al : A Clinical Training Program for Hybrid Closed Loop Therapy in a Pediatric Diabetes Clinic. J Diabetes Sci Technol 2020 ; 14(2) : 290-296 ; doi : 10.1177/1932296819835183.
- Lal RA, et al. : Un an d’expérience clinique du premier système hybride commercial à boucle fermée. Diabetes Care 2019 ; 42(12) : 2190-2196.
- Bisio A, et al : Sleep and diabetes-specific psycho-behavioral outcomes of a new automated insulin delivery system in young children with type 1 diabetes and their parents. Pediatr Diabetes 2021 ; 22 : 495-502.
- Amigó J, et al. : Passer d’un traitement avec une pompe à capteurs augmentés à un système hybride en boucle fermée dans le diabète de type 1 : impact sur le contrôle glycémique et les tests neurophysiologiques dans le monde réel. Diabetes Research and Clinical Practice 2023 ; 201 : 110730.
InFo DIABETOLOGIE & ENDOKRINOLOGIE 2024 ; 1(1) : 11-19