L’accident vasculaire cérébral est une maladie très répandue. Il entraîne le plus souvent un handicap permanent à l’âge adulte. Des projets de recherche sont donc menés afin d’améliorer le diagnostic et le traitement.
L’accident vasculaire cérébral est une maladie très répandue. Dans le monde, le nombre de patients victimes d’un AVC ischémique et hémorragique a augmenté respectivement de 37% et 47% entre 1990 et 2010. Comme cela a également entraîné une augmentation du nombre absolu de décès et que l’AVC est la maladie qui entraîne le plus souvent un handicap permanent à l’âge adulte, de nombreux projets de recherche sont en cours, visant principalement à améliorer le diagnostic, le traitement en phase aiguë et la prévention secondaire. Il s’agit ici de donner un aperçu des résultats actuels des études et d’en esquisser les conséquences pour la routine clinique. Étant donné que les accidents vasculaires cérébraux (AVC) ischémiques représentent 85 à 90% de tous les AVC et que les résultats les plus importants ont été obtenus chez les patients atteints d’AVC ischémique, ce travail se concentrera sur ces patients.
Thérapie aiguë – “time is brain” !
Les thérapies de recanalisation constituent la base et la condition préalable à la réussite du traitement aigu du SI. Cela comprend actuellement le traitement par thrombolyse intraveineuse à l’aide d’un activateur de plasminogène tissulaire recombinant (“recombinant tissue-type plasminogen activator”, rtPA) [1] et la thrombectomie mécanique, généralement réalisée à l’aide de stent-retrievers [2]. Les deux options de traitement ont en commun le fait que la thérapie est critique en termes de temps, ce qui est résumé par le slogan bien connu “time is brain”. On estime que près de deux millions de neurones par minute sont détruits de manière irréversible lors d’une SI aiguë. Le concept de pénombre est pertinent du point de vue physiopathologique, selon lequel un noyau dit d’infarctus est perdu de manière irréversible très rapidement après le début des symptômes, la pénombre entourant le noyau d’infarctus mais étant alimentée par des collatérales au moins à court terme et donc potentiellement sauvable. A partir d’un certain moment, le dommage potentiel de la mesure de recanalisation dépasse le bénéfice escompté, de sorte que la thérapie ne devrait alors pas être mise en œuvre. Alors qu’il y a quelques années encore, on tentait de fixer des fenêtres de temps généralement contraignantes (thrombolyse intraveineuse : 4,5 heures ; thrombectomie : 6 heures), il est de plus en plus clair qu’il existe de grandes différences interindividuelles dans la dynamique de progression de l’infarctus, qui dépendent probablement de manière déterminante du statut collatéral de chaque patient. En conséquence, la thérapie, c’est-à-dire l’évaluation de la fenêtre de temps, du traitement de recanalisation doit également être adaptée individuellement. Dans la suite de cet article, différents exemples illustreront l’état actuel des études dans ce domaine.
Thrombectomie parfois réussie plusieurs heures après le début des symptômes
L’étude DAWN [3] a examiné les résultats des thrombectomies dans une fenêtre de temps de six à vingt-quatre heures (“last seen well”). Les patients présentant une occlusion de l’artère carotide interne intracrânienne (ACI) ou de la section M1 de l’artère cérébrale moyenne (ACM) confirmée par angiographie par scanner (CTA) ou par angiographie par résonance magnétique (ARM) ont été inclus, à condition qu’il y ait une inadéquation entre le volume de l’infarctus et la sévérité des symptômes cliniques. Un autre critère d’inclusion était, entre autres, une échelle de Rankin modifiée (mRS) prémorbide de 0-1. Les patients ont été randomisés dans le groupe thrombectomie (n=107) ainsi que dans le groupe contrôle (n=99). Le score médian du National Institutes of Health Stroke Scale (NIHSS) était de 17 dans les deux groupes, le volume médian de l’infarctus était de 7,6 ml dans le groupe thrombectomie et de 8,9 ml dans le groupe contrôle. Après 90 jours, 49% des patients du groupe thrombectomie étaient fonctionnellement indépendants (mRS 0-2), contre seulement 13% dans le groupe témoin. Dès 24 heures, une différence a été observée dans le volume médian de l’infarctus (8 ml dans le groupe thrombectomie contre 22 ml dans le groupe contrôle). Les critères d’évaluation indésirables n’étaient pas différents dans les deux groupes.
L’étude DEFUSE-3 est une autre étude qui a examiné la procédure de thrombectomie dans une fenêtre de temps élargie [4]. L’étude a porté sur une période de 6 à 16 heures (groupe thrombectomie : n=92 ; groupe contrôle : n=90), avec un volume initial d’infarctus de 70 ml maximum et un rapport volume d’infarctus/zone menacée d’au moins 1,8 avec une pénombre d’au moins 15 ml. Il devait y avoir une occlusion de l’ACI ou de l’ACM proximale confirmée par une ACT ou une ARM. Le score du mRS à 90 jours a été choisi comme critère d’évaluation principal. En outre, le volume de l’infarctus après 24 heures, l’augmentation du volume de l’infarctus, la reperfusion et la réouverture de l’artère occluse ont été évalués. Après 90 jours, 45% du groupe thrombectomie et 17% du groupe contrôle étaient fonctionnellement indépendants. Dans le groupe thrombectomie, l’augmentation médiane du volume de l’infarctus était de 23 ml, contre 33 ml dans le groupe témoin.
Les deux études indiquent que chez des patients sélectionnés, une thrombectomie peut être réalisée avec un succès clinique même plusieurs heures après le début des symptômes. Il est impératif de garder cela à l’esprit dans la routine clinique.
IRM d’urgence 24h/24 et 7j/7 en cas de fenêtre temporelle incertaine
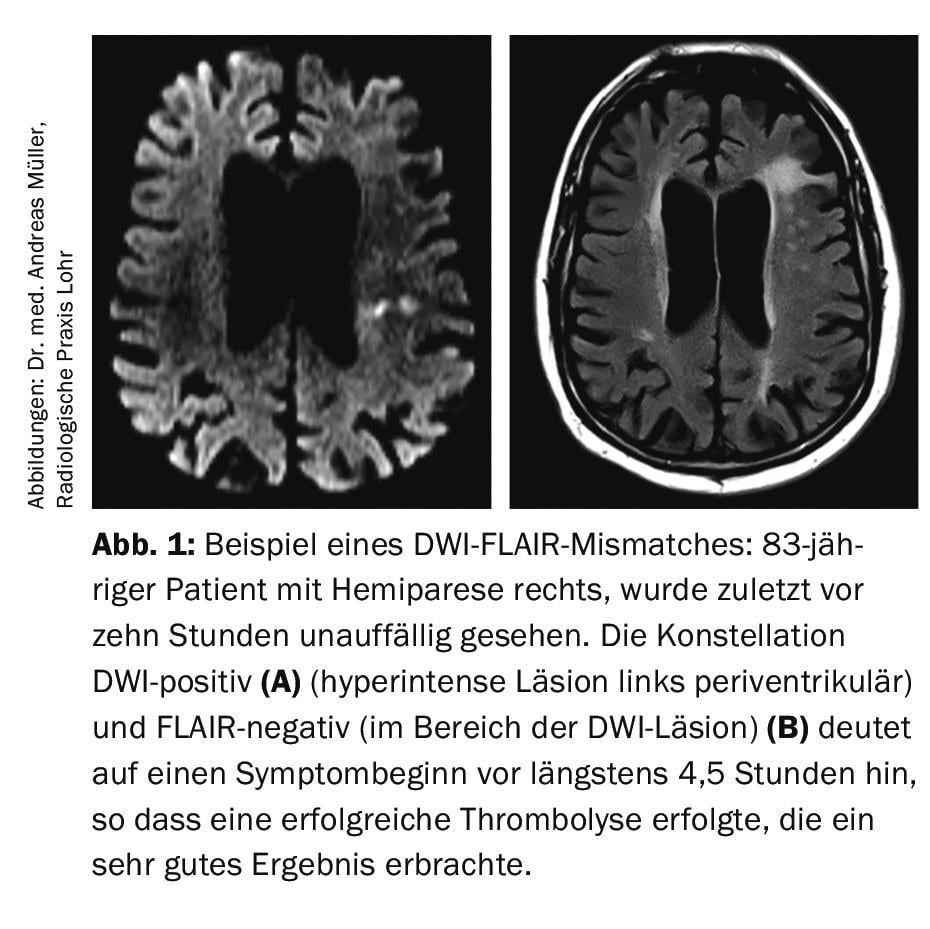
On sait que dans jusqu’à 30% de toutes les IS, la fenêtre temporelle (c’est-à-dire le début des symptômes) est inconnue, ce qui constitue formellement une contre-indication à la thrombolyse intraveineuse selon les critères d’approbation du rtPA. Dans le but de traiter ces patients par thrombolyse intraveineuse, le groupe de travail de Hambourg dirigé par le professeur Götz Thomalla a évalué l’imagerie DWI-FLAIR (DWI = “diffusion weighted imaging” ; FLAIR = “fluid-attenuated inversion recovery”). La séquence DWI représente l’œdème cytotoxique, qui apparaît généralement très tôt après le début d’un AVC ischémique. En revanche, la séquence FLAIR indique un œdème vasogénique qui ne se développe généralement qu’à partir de 4,5 heures après le début de l’infarctus. Il en résulte que si un patient présente une CFA positive mais pas de signal FLAIR, il est relativement probable que l’heure de début des symptômes se situe dans les 4,5 heures précédant l’IRM. (Fig.1). Dans l’étude multicentrique randomisée et contrôlée par placebo Wake-up, des patients atteints d’IS (DWI positif, FLAIR négatif) ont été inclus et randomisés 1:1 entre rtPA 0,9 mg/kg de poids corporel ou placebo [5]. L’étude a été interrompue prématurément car, lors d’une analyse intermédiaire, le critère d’évaluation primaire (mRS à 90 jours 0-1 points) a été atteint significativement plus souvent dans le groupe verum (53,3%) que dans le groupe placebo (41,8%). Le taux d’hémorragie intracrânienne a augmenté de manière non significative dans le groupe verum (2,0%) par rapport au groupe placebo (0,4%). Dans l’ensemble, l’étude a été saluée comme un grand succès. Elle a conduit à la nécessité de disposer d’une possibilité d’IRM d’urgence 24 heures sur 24, afin de ne pas manquer une possibilité de thrombolyse en cas de fenêtre temporelle incertaine.
Des neurologues à l’esprit critique se demandent depuis longtemps s’il ne serait pas envisageable, pour un patient donné, a) malgré une fenêtre de temps <4,5 heures (parce que, par exemple, les collatérales sont très mauvaises et qu’un gros noyau d’infarctus ou une petite/aucune pénombre est déjà présent(e) après peu de temps), ou b) malgré une fenêtre de temps >4,5 heures de thrombolyse dans les cas où le noyau de l’infarctus est relativement petit et la pénombre importante.
Alors que la constellation a) n’a pas fait l’objet de beaucoup d’études et devrait être beaucoup plus rare, la constellation b) fréquente dans la routine clinique. Des études récentes ont été menées sur la thrombolyse intraveineuse jusqu’à 9 heures après le début d’un AVC ischémique. L’étude multicentrique randomisée et contrôlée par placebo EXTEND a inclus 225 patients atteints de SI et de zones cérébrales hypoperfusées, y compris une pénombre potentiellement récupérable, dans un délai de 4,5 à 9 heures après le début des symptômes, et les a randomisés 1:1 dans les groupes 0,9 mg/kg de poids corporel ou placebo [6]. Après la publication de l’étude Wake-up positive [5], l’étude EXTEND a également été arrêtée prématurément. Le critère d’évaluation principal (mRS à 90 jours 0-1 points) a été atteint chez 35,4% des patients du groupe traité par le verum et chez 29,5% des patients du groupe placebo (p=0,04). Des hémorragies intracérébrales ont été diagnostiquées dans 6,2% des cas du groupe traité par le verum et dans 0,9% des cas du groupe placebo (p=0,05).
En résumé, une thrombolyse intraveineuse effectuée 4,5 à 9 heures après le début des symptômes chez un groupe de patients sélectionnés permet donc d’obtenir un meilleur résultat clinique à 90 jours, malgré un taux plus élevé d’hémorragies cérébrales. Cette affirmation est étayée par une méta-analyse récente [7]. Il semble toutefois encore trop tôt pour transposer immédiatement ces résultats dans la routine clinique générale. En fin de compte, on peut toutefois s’attendre à ce que le traitement aigu de l’AVC ischémique soit de plus en plus individualisé dans les années à venir, sur la base de l’imagerie multimodale.
Tenecteplase, une alternative à l’alteplase ?
Pour la thrombolyse, seule l’altéplase (0,9 mg/kg de poids corporel, max. 90 mg) est autorisé. Des substances alternatives continuent d’être étudiées dans le but d’obtenir un traitement plus sûr et plus efficace. La tenecteplase pourrait constituer une alternative prometteuse.
La ténectéplase a une affinité plus élevée pour la fibrine et une demi-vie plus longue. Cela permettrait une administration en bolus, contrairement à la perfusion d’une heure avec l’altéplase. Dans l’étude NOR-TEST [8], 1 100 patients ont été traités, dont 549 avec la ténectéplase (0,4 mg/kg) et 551 avec l’altéplase (0,9 mg/kg). Le critère d’évaluation d’un mRS de 0-1 à trois mois a été atteint par 64% des patients du groupe tenecteplase et 63% des patients du groupe témoin. Aucune supériorité de la tenecteplase par rapport à l’alteplase n’a été constatée et le profil de sécurité n’a pas montré de différences significatives.
En revanche, l’étude EXTEND-IA TNK [9] a évalué la lyse dite de pontage avant thrombectomie au moyen de la ténectéplase (n=101, dose de 0,25 mg/kg) par rapport à l’altéplase (n=101). Les patients se trouvaient dans la fenêtre temporelle de 4,5 heures et étaient destinés à subir une thrombectomie en cas d’occlusion avérée de l’ACI, de l’ACM ou de l’artère basilaire. Le critère d’évaluation principal était une reperfusion d’au moins 50% ou l’absence de thrombus interventionnel. Ce critère a été atteint chez 22% des patients du groupe tenecteplase, contre 10% dans le groupe témoin. Le résultat fonctionnel à 90 jours a également été amélioré dans le groupe tenecteplase (mRS médian de 2 vs 3), sans accumulation d’effets indésirables. D’autres études, TASTE et ATTEST, n’ont pas montré de supériorité de la ténectéplase par rapport à l’alteplase, mais une mise en commun des patients a montré un avantage pour les patients présentant une occlusion vasculaire complète avec une recanalisation complète après 24 heures chez 71% du groupe ténectéplase contre 43% dans le groupe témoin [10].
D’autres études sont en cours. Les résultats obtenus jusqu’à présent suggèrent au moins une non-infériorité de la ténectéplase avec un mode d’application plus simple, ce qui pourrait être un avantage pertinent, notamment en cas de transport secondaire avant thrombectomie. Les prochaines années montreront si l’alternative de thrombolyse très prometteuse avec la tenecteplase sera effectivement intégrée dans la routine clinique.
Prévention secondaire par anticoagulation orale ou fermeture de l’oreillette
Tout traitement antithrombotique actuellement autorisé pour la prévention secondaire du SI augmente la probabilité de complications hémorragiques. En cas de fibrillation auriculaire, le traitement médicamenteux consiste en une anticoagulation orale. Les antagonistes de la vitamine K (p. ex. phenprocoumone, INR cible 2-3) ou les anticoagulants oraux non dépendants de la vitamine K (NOAK, inhibiteurs anti-Xa ou dabigatran, inhibiteur direct de la thrombine), qui réduisent de moitié le risque d’hémorragie cérébrale par rapport aux antagonistes de la vitamine K, sont possibles.
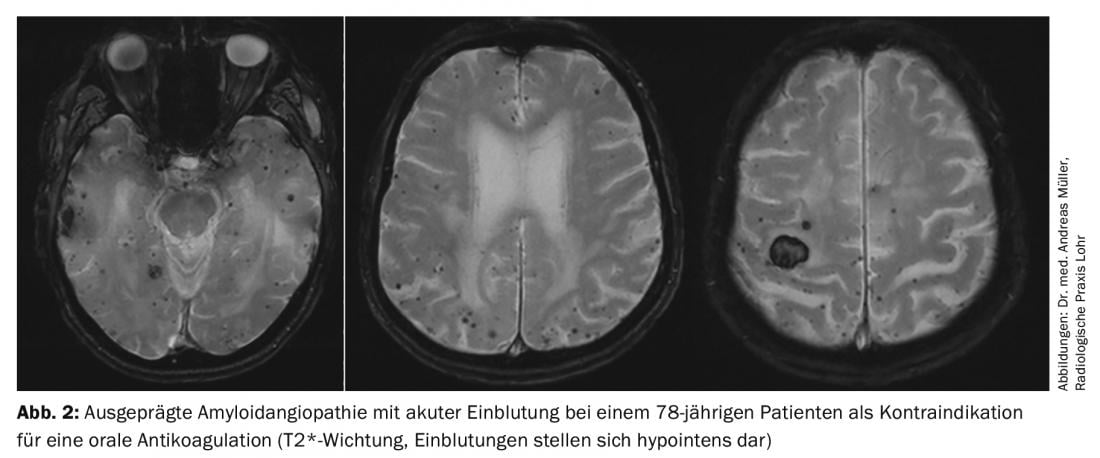
Néanmoins, certains patients ne peuvent pas être traités avec des anticoagulants oraux en raison d’un risque accru de saignement. Pour ces derniers, une fermeture interventionnelle de l’oreillette est en principe envisageable. On estime que 90% des thrombus cardiaques sont formés dans l’oreillette gauche. Différents dispositifs ont été développés pour la fermeture de l’oreillette, les données actuelles étant les meilleures pour le dispositif dit Watchman®. Récemment, les données à 5 ans des études PREVAIL et PROTECT AF ont été publiées, montrant un risque de saignement et une mortalité plus faibles par rapport à la warfarine [11]. En résumé, la fermeture interventionnelle de l’oreillette gauche à l’aide du dispositif Watchman® peut donc présenter des avantages, en particulier chez les patients à haut risque de saignement (score HASBLED élevé) ou présentant une contre-indication à l’anticoagulation orale, car le risque de saignement (surtout cérébral) est significativement réduit (fig. 2). Les points critiques sont les suivants : a) le manque de données à long terme, b) les complications péri-interventionnelles, c) Possibilité de formation de thrombus cardiaques en dehors de l’oreillette, d) nécessité d’une double inhibition temporaire de la fonction plaquettaire. La comparaison entre les NOAK et l’occlusion de l’oreillette doit encore être discutée, car aucune étude n’a encore été publiée à ce sujet. Il est possible que l’avantage de la fermeture de l’oreillette en termes de réduction des complications hémorragiques ne soit pas présent en cas d’anticoagulation par NOAK.
Les moins de 60 ans atteints d’ESUS et de FOP bénéficient de la fermeture du FOP plus de l’HTP
Pour une autre intervention cardiaque, l’état des études a considérablement changé en 2017. Alors que jusqu’à présent, les patients atteints d’IS et de foramen ovale persistant (PFO) étaient traités uniquement avec un inhibiteur de la fonction plaquettaire (ITP) comme cause présumée d’AVC, plusieurs travaux ont démontré que chez des patients sélectionnés âgés de 60 ans ou moins présentant un AVC cryptogénique et un PFO avec au moins un shunt gauche-droite modéré, la fermeture interventionnelle du PFO plus ITP était supérieure à l’ITP seul. [12–14]. L’anticoagulation orale n’offre explicitement aucun avantage. La limite d’âge de 60 ans est basée sur l’hypothèse que les patients âgés sont plus susceptibles d’avoir une cause alternative d’AVC que les patients plus jeunes (à savoir principalement la fibrillation auriculaire). Mais en fin de compte, la limite est arbitraire et il reste à voir si les patients de plus de 60 ans ne peuvent pas bénéficier d’une fermeture du PFO.
Le terme “accident vasculaire cérébral cryptogénique” n’étant pas précisément défini, le terme ESUS (“embolic stroke of undetermined source”) a été introduit en 2014 [15]. Sur la base de cette définition précise, les chercheurs ont cherché à savoir si les patients atteints d’ESUS (c’est-à-dire présentant une fibrillation auriculaire suspectée mais non prouvée) étaient mieux protégés contre la récidive d’un SI par les NOAK que par l’ASA. L’étude NAVIGATE-ESUS, qui comparait le rivaroxaban à l’ASA, a dû être interrompue prématurément après 3609 patients, car aucun avantage n’était plus attendu dans le groupe d’intervention. [16]. L’étude RE-SPECT-ESUS a également confirmé que l’anticoagulation orale par rapport à l’HNF avec ASS n’apporte aucun avantage au groupe global de patients ESUS [17]. Cette dernière étude a porté sur 5390 patients provenant de 564 centres d’étude. Ils ont reçu soit de l’ASS 100 mg, soit du dabigatran à la dose de 110 mg ou 150 mg deux fois par jour. Le critère d’évaluation principal était la réapparition des IS. Après une médiane de 19 mois, 4,1% des patients du bras dabigatran ont présenté un deuxième événement par an, contre 4,8% par an dans le bras ASA de l’étude. La réduction relative du risque de 15% n’a pas atteint la significativité statistique (p=0,10). Des hémorragies graves sont survenues chez 1,7% (dabigatran) et 1,4% (ASS) des patients par an. Une différence significative en défaveur du dabigatran a été observée pour les hémorragies non graves cliniquement significatives (1,6 vs 0,9 % par an). Les études ATTICUS et ARCADIA, qui comparent l’apixaban à l’ASA, sont toujours en attente. Indépendamment de cela, de plus en plus d’éléments indiquent qu’en cas d’ESUS, l’anticoagulation orale par NOAK est supérieure à l’HNF chez des patients sélectionnés (par ex. avec un FOP [18] ou une hypertrophie de l’oreillette gauche [19]). Des études supplémentaires sont toutefois nécessaires pour reproduire ces résultats.
Le double TFH peut prévenir les récidives
Depuis de nombreuses années, il est clair qu’une HTP duale permanente (généralement avec ASA et clopidogrel) n’est pas favorable dans l’évaluation du rapport bénéfice/risque. Cependant, dans certaines configurations, une double HET limitée temporairement peut être utile et nécessaire. Les raisons connues sont par exemple les sténoses intracrâniennes symptomatiques [20] ou la pose de sténoses dans les artères irriguant le cerveau. Ce qui est nouveau, en revanche, c’est la découverte que les patients présentant un AIT et un risque élevé de récidive (score ABCD2 ≥4) ou un IS léger (“minor stroke”, NIHSS ≤3) sont mieux protégés contre les récidives ischémiques précoces par une double HTP associant ASS et clopidogrel pour une durée de 10 à 21 jours que par une monothérapie par ASS [21,22]. Le risque de saignement est accru. Les auteurs de l’étude POINT estiment toutefois que le doublement de l’HNF permet de prévenir trois fois plus d’EI récidivantes que d’hémorragies graves [22]. On peut s’attendre à ce qu’une recommandation soit prochainement intégrée dans les lignes directrices de la Société allemande de neurologie (DGN). Un avis positif concernant la procédure a déjà été publié sur la page d’accueil de la DGN.
Perspectives
Les avancées thérapeutiques de ces dernières années reflètent une activité de recherche intense et une approche strictement fondée sur des preuves. Il est à espérer, et même à supposer, que cette évolution se poursuivra. Il est probable que le traitement de l’AVC se complique, car on identifie de plus en plus de patients (groupes de patients) qui répondent particulièrement bien ou non à une option thérapeutique particulière. L’individualisation de la médecine progresse.
Littérature :
- Hacke W, et al : Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008 ; 359(13) : 1317-1329.
- Berkhemer OA, et al : A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015 ; 372(1) : 11-20.
- Nogueira RG, et al : Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018 ; 378 : 11-21.
- Albers GW, et al : Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. N Engl J Med 2018 ; 378(8) : 708-718.
- Thomalla G, et al : MRI-Guided Thrombolysis for Stroke with Unknown Time of Onset. N Engl J Med 2018 ; 379(7) : 611-622.
- Ma H, et al : Thrombolysis Guided by Perfusion Imaging up to 9 Hours after Onset of Stroke. N Engl J Med 2019 ; 380(19) : 1795-1803.
- Campbell BCV, et al : Extending thrombolysis to 4,5-9 h and wake-up stroke using perfusion imaging : a systematic review and meta-analysis of individual patient data. Lancet 2019 ; 394(10193) : 139-147.
- Logallo N, et al : Tenecteplase versus alteplase pour la prise en charge de l’accident vasculaire cérébral ischémique aigu (nor-test) : un essai de phase 3, randomisé, en ouvert et en aveugle. Lancet Neurol 2017 ; 16 : 781-788.
- Campbell BCV, et al : Tenecteplase versus Alteplase avant thrombectomie pour accident vasculaire cérébral ischémique. N Engl J Med 2018 ; 378(17) : 1573-1582.
- Bivard A, et al : Tenecteplase in ischemic stroke offers improved recanalization. Neurology 2017 ; 89(1) : 62-67.
- Reddy VY, et al : 5-Year Outcomes After Left Atrial Appendage Closure : From the PREVAIL and PROTECT AF Trials. J Am Coll Cardiol 2017 ; 70(24) : 2964-2975.
- Søndergaard L, et al : Patent Foramen Ovale Closure or Antiplatelet Therapy for Cryptogenic Stroke. N Engl J Med 2017 ; 377(11) : 1033-1042.
- Mas JL, et al : Patent Foramen Ovale Closure or Anticoagulation vs Antiplatelets after Stroke. N Engl J Med 2017 ; 377(11) : 1011-1021.
- Saver JL, et al : Long-Term Outcomes of Patent Foramen Ovale Closure or Medical Therapy after Stroke. N Engl J Med 2017 ; 377(11) : 1022-1032.
- Hart RG, et al : Embolic strokes of undetermined source : the case for a new clinical construct. Lancet Neurol 2014 ; 13(4) : 429-438.
- Hart RG, et al : Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med 2018 ; 378(23) : 2191-2201.
- Diener HC, et al : Dabigatran for Prevention of Stroke after Embolic Stroke of Undetermined Source. N Engl J Med 2019 ; 380(20) : 1906-1917.
- Kasner SE, et al : Rivaroxaban ou aspirine pour foramen ovale patenté et accident embolique de source indéterminée : une analyse de sous-groupe présélectionnée de l’essai NAVIGATE ESUS. Lancet Neurol 2018 ; 17(12) : 1053-1060.
- Healey JS, et al. : Recurrent Stroke With Rivaroxaban Compared With Aspirin According to Predictors of Atrial Fibrillation : Secondary Analysis of the NAVIGATE ESUS Randomized Clinical Trial. JAMA Neurol 2019, sous presse.
- Chimowitz MI, et al : Stenting versus agressive medical therapy for intracranial arterial stenosis. N Engl J Med 2011 ; 365(11) : 993-1003.
- Prasad K, et al : Dual antiplatelet therapy with aspirin and clopidogrel for acute high risk transient ischaemic attack and minor ischaemic stroke : a clinical practice guideline. BMJ 2018 ; 363 : k5130.
- Johnston SC, et al : Clopidogrel and Aspirin in Acute Ischemic Stroke and High-Risk TIA. N Engl J Med 2018 ; 379(3) : 215-225.
InFo NEUROLOGIE & PSYCHIATRIE 2019 ; 17(5) : 5-9