Chez les patients atteints de tumeurs, il convient également de rechercher délibérément les causes d’anémie pouvant être traitées avant de procéder à une transfusion. Pas de transfusion parce qu’un “seuil de transfusion” n’est pas atteint : l’indication d’une transfusion doit toujours être posée en fonction de la situation clinique. Une stratégie de transfusion restrictive est également appropriée pour les patients atteints de tumeurs. Chez les patients hémato-oncologiques, des produits sanguins irradiés peuvent être indiqués. Les agents stimulant l’érythropoïèse (érythropoïétine, darbopoïétine) sont une alternative aux transfusions dans certains cas, mais uniquement en cas d’anémie sous chimiothérapie. En situation curative, ils doivent être évités.
L’anémie est un problème fréquent chez les patients atteints de tumeurs (tableau 1). Elle affecte la qualité de vie, est un cofacteur important de la fatigue associée aux tumeurs et constitue un facteur pronostique négatif dans de nombreuses entités tumorales. L’étiologie de l’anémie est généralement multifactorielle. Outre les comorbidités (par ex. insuffisance rénale, carences), la maladie tumorale (hémorragie, hypersplénisme, infiltration de la moelle osseuse, environnement cytokinique pro-inflammatoire) et son traitement (effet myélosuppressif et néphrotoxique de la chimiothérapie et/ou de la radiothérapie, rarement hémolyse induite par les médicaments) contribuent à sa survenue.

Le traitement est de préférence causal, souvent seules des mesures de soutien sont possibles. Pour cela, il existe des transfusions sanguines et l’administration d’agents stimulant l’érythropoïèse (ESA). Les paragraphes suivants mettent en lumière certains aspects de la transfusion sanguine chez les patients atteints de tumeurs. Les directives en vigueur en Suisse concernant l’évaluation prétransfusionnelle ainsi que certains aspects de la mise en œuvre pratique ont été récemment présentés dans le Swiss Medical Forum et ne sont pas mentionnés ici en tant que tels [1].
Évaluations avant transfusion
Les examens de base avant de commencer une transfusion doivent permettre de s’assurer que d’autres causes d’anémie pouvant être traitées ne sont pas négligées. Les examens doivent être effectués avant le début des transfusions et en cas d’évolution imprévue, comme une augmentation de la fréquence des transfusions.
Une évaluation visuelle du frottis sanguin donne des indications sur une cause concomitante de l’anémie, par exemple des signes de dysplasie en cas de syndrome myélodysplasique (SMD), des microsphérocytes en cas d’hémolyse auto-immune ou des fragmentocytes en cas de microangiopathie thrombotique. Le dosage des réticulocytes permet de distinguer les anémies hypo- et hyper-régénératives, une anémie hyper-régénérative indiquant toujours une consommation accrue alors que la capacité de synthèse est intacte – une situation inhabituelle dans le contexte d’une anémie tumorale et nécessitant des investigations supplémentaires.
La recherche d’une carence en substrat implique un bilan ferrique (fer, transferrine, saturation de la transferrine, ferritine et CRP, récepteur soluble de la transferrine en cas de résultat incertain), la vitamine B12 (holotranscobalamine en cas de résultat limite, éventuellement acide méthylmalonique et homocystéine) et l’acide folique érythrocytaire. Le dosage de la créatinine révèle un dysfonctionnement rénal concomitant. En cas de dysfonctionnement rénal manifeste, le dosage de l’érythropoïétine est utile. Une augmentation de la LDH et une baisse de l’haptoglobine indiquent une hémolyse. Un test de Coombs est principalement indiqué chez les patients atteints de leucémie lymphoïde chronique, de lymphome non hodgkinien ou ayant des antécédents de maladies auto-immunes.
Si une dépendance prolongée à la transfusion est prévisible (par exemple en cas de SMD ou de longue durée de traitement), il peut être utile de caractériser le modèle antigénique des érythrocytes du patient par rapport à d’autres systèmes de groupes sanguins, en plus des examens pré-transfusionnels obligatoires, afin de pouvoir choisir les concentrés érythrocytaires de manière plus ciblée. Cela permet de réduire la probabilité de formation d’allo-anticorps, qui rend la poursuite des soins plus difficile. Une fois la première transfusion effectuée, ces examens sérologiques ne sont plus possibles et il faut recourir à des méthodes de biologie moléculaire.
Déclencheur de transfusion et dose de transfusion
L’objectif de la transfusion est de minimiser les symptômes liés à l’anémie et de prévenir les lésions organiques dues à l’hypoxie. Les bénéfices potentiels doivent être comparés aux effets secondaires associés à la transfusion (tableau 2) [2].

L’indication ne peut pas dépendre uniquement du fait de passer en dessous d’un “seuil de transfusion”, car les conséquences cliniques ne dépendent pas seulement de l’ampleur de l’anémie, mais aussi de son mode d’apparition, de sa durée et de son contexte clinique. Les symptômes graves sont plus susceptibles de se produire rapidement, alors que si l’anémie se développe lentement, des mécanismes de compensation à plusieurs niveaux se mettent en place (par exemple, une augmentation du débit cardiaque, une adaptation de la capacité de fixation de l’oxygène, une modification de la consommation d’oxygène et une extraction adaptée de l’oxygène dans les tissus cibles) [3]. Les maladies pulmonaires, cardio-vasculaires et cérébrovasculaires préexistantes limitent souvent la capacité d’adaptation. L’indication de la transfusion dépend donc de manière décisive de la situation du patient et constitue toujours une décision clinique individuelle (tab. 3).

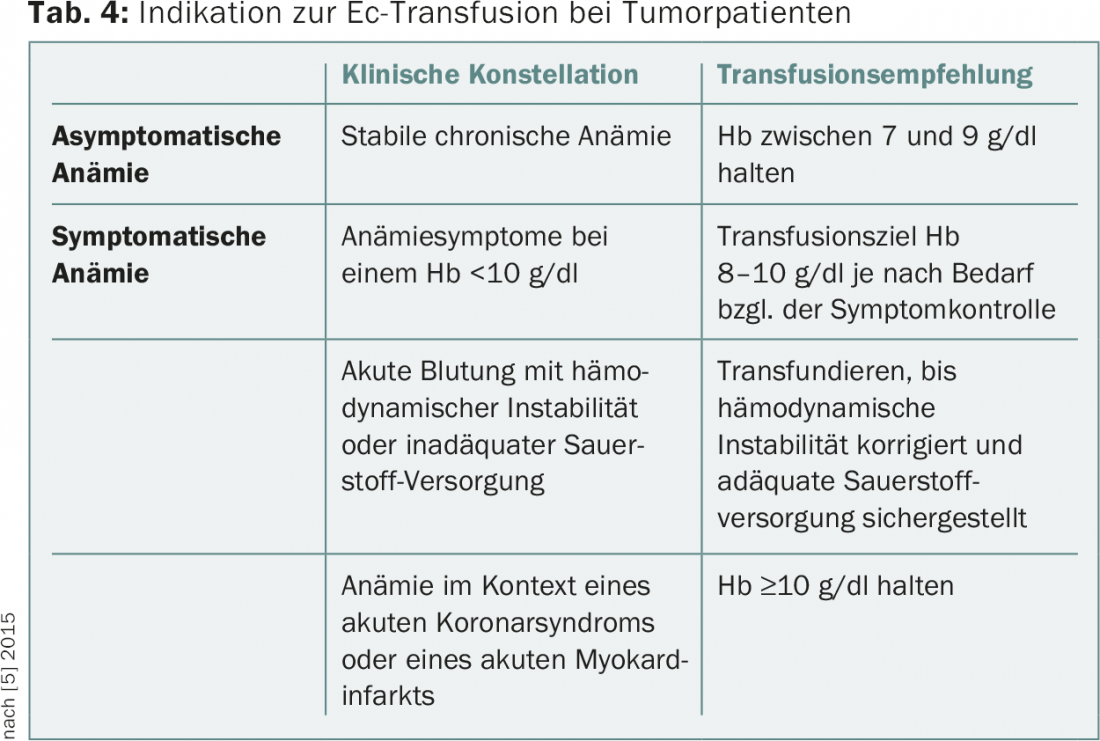
En général, on peut distinguer une stratégie de transfusion restrictive (transfusion à une Hb ≤7-9 g/dl) d’une stratégie libérale (transfusion à une Hb ≤9-10 g/dl). Des études randomisées ont démontré qu’une stratégie restrictive ne présente pas d’inconvénients quo ad vitam, mais permet d’éviter les complications liées à la transfusion et de réduire les coûts. Selon une analyse Cochrane, une stratégie de transfusion restrictive entraîne une réduction statistiquement significative de la mortalité associée à l’hospitalisation et n’augmente pas le taux d’événements indésirables tels que les infarctus du myocarde ou les accidents cérébrovasculaires [4]. Cependant, les données prospectives proviennent généralement du contexte de la gestion périopératoire de l’anémie ou de la médecine intensive et ne concernent pas les patients ambulatoires. Il n’existe pas d’études prospectives randomisées pour les patients atteints de tumeurs, mais une stratégie de transfusion restrictive est également généralement acceptée pour ce groupe de patients. Le tableau 4 présente les recommandations en matière de transfusion pour les patients atteints de tumeurs, telles qu’elles figurent dans les directives actuelles du NCCN (février 2015) [5].
Pour les patients présentant une thrombocytopénie sévère concomitante, il convient de noter que le risque de saignement augmente lorsque la concentration d’hémoglobine diminue. Il est donc recommandé de maintenir l’hémoglobine >8 g/dl chez les patients thrombopéniques.
Un concentré érythrocytaire (CE, volume d’environ 300 ml) entraîne une augmentation d’environ 1 g/dl de la concentration en Hb. Selon un dogme non écrit, deux CE sont généralement administrés par transfusion. Il existe toutefois des preuves que la transfusion d’un seul CE peut également être efficace, du moins chez les patients hospitalisés sous chimiothérapie intensive [6]. Dans le contexte d’un programme de transfusion ambulatoire individuel, il s’agit également d’une option, par exemple chez les patients présentant une comorbidité cardiaque ou si des variations importantes de l’hémoglobine sont mal tolérées lors d’un intervalle de transfusion prolongé.
Si des symptômes subjectifs jouent un rôle dans l’indication, il est conseillé de les évaluer de manière semi-quantitative avant la première transfusion et de documenter leur évolution sous traitement (par exemple à l’aide d’une échelle visuelle analogique).
Produits sanguins irradiés chez les patients immunodéprimés
Les patients souffrant d’une immunosuppression importante liée au traitement courent le risque de contracter la maladie du greffon contre l’hôte (ta-GvHD) associée à la transfusion. Dans ce cas, les lymphocytes T du donneur contenus dans le produit sanguin se retournent contre le tissu du receveur, car ils ne peuvent pas être reconnus comme étrangers et éliminés. Cette maladie est mortelle dans >90% des cas. Après l’introduction de la déplétion leucocytaire (qui limite la teneur en leucocytes d’un produit sanguin à <1× 106), le niveau d’indication déjà très bas a encore diminué, mais des cas isolés ont été rapportés après l’administration de produits sanguins déplétés en leucocytes [7].
Après irradiation (au moins 25 Gy), les lymphocytes du produit sanguin ne sont plus capables de se diviser et ne peuvent plus provoquer de ta-GvHD. Les indications pour l’administration de produits sanguins irradiés selon les guidelines actuelles sont résumées dans le tableau 5 [8,9]. Il n’existe pas de lignes directrices contraignantes pour la Suisse. Outre les indications non controversées (patients ayant subi une transplantation de cellules souches hématopoïétiques, traitement par analogues des purines), il existe des situations qui sont diversement appréciées.
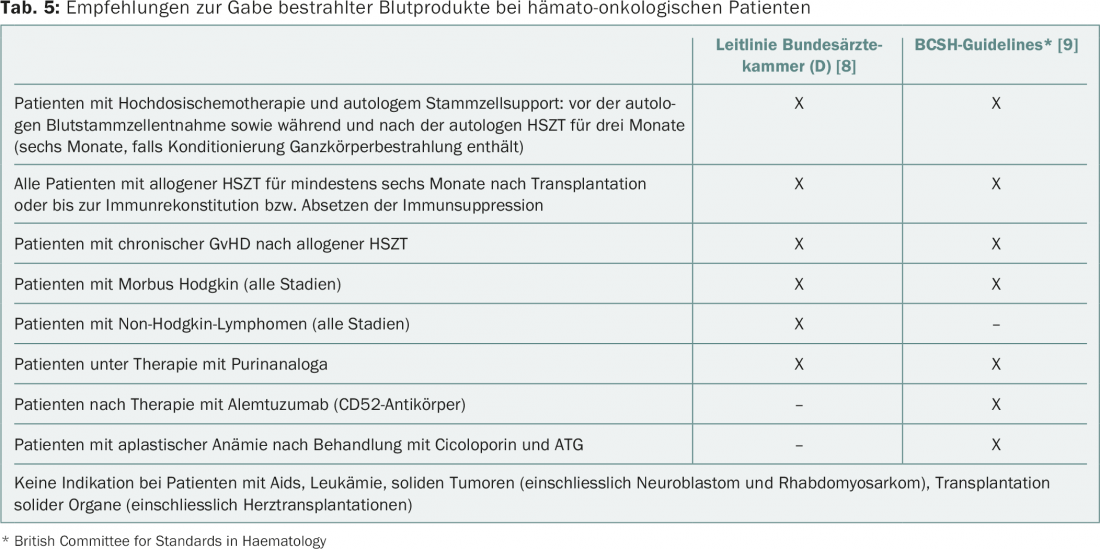
L’inactivation des pathogènes dans les concentrés plaquettaires, pratiquée de manière généralisée en Suisse, a un effet équivalent à une irradiation. Par conséquent, seuls les CE et les concentrés de granulocytes, qui ne sont de toute façon utilisés que dans des indications très spécifiques, doivent être irradiés.
Chélation du fer en cas de dépendance transfusionnelle à long terme
Chaque CE contient environ 200-250 mg de fer. Comme l’organisme ne peut éliminer le fer que par la perte de sang, il faut s’attendre à une surcharge en fer cliniquement significative à partir d’environ 20 CE. Une substitution régulière à long terme de l’Ec entraîne ainsi des effets secondaires cardiaques ou hépatiques fatals. C’est pourquoi la chélation du fer est la norme dans les maladies hématologiques bénignes telles que les thalassémies.
Il n’est pas clair si cela peut également améliorer le pronostic des patients SMD dépendants des transfusions à long terme. Les directives actuelles mentionnent l’option de la chélation du fer, en particulier chez les patients dépendants des transfusions et présentant des SMD-Risko de bas niveau ou intermédiaires, une concentration de ferritine de >1000 mcg/l et une espérance de vie de >1-2 ans [10].
Les agents de stimulation de l’érythropoïèse comme alternative à la transfusion
L’érythropoïétine et la darbopoïétine recombinantes font partie du répertoire standard des patients atteints de SMD à faible risque et dont la production d’EPO endogène n’augmente pas de manière adéquate ; ces agents ont également fait l’objet d’une promotion intensive pour leur utilisation chez les patients atteints de tumeurs. Chez des patients sélectionnés, ils peuvent réduire la fréquence des transfusions et améliorer la qualité de vie. Cependant, il existe des preuves que dans les tumeurs solides, la stimulation, par exemple, des récepteurs de l’érythropoïétine sur les cellules tumorales et les effets hors cible peuvent avoir un impact négatif sur l’évolution de la maladie, même si les données à ce sujet sont complexes et controversées. De plus, les agents stimulant l’érythropoïèse (ESA) augmentent le risque d’événements thromboemboliques.
Selon le label de l’European Medical Agency (EMA), leur utilisation n’est indiquée qu’en cas d’anémie associée à la chimiothérapie à partir d’une Hb ≤10 g/dl ; l’objectif est de maintenir la concentration d’hémoglobine stable ou de l’augmenter de 2 g/dl au maximum. En cas d’administration avec un objectif d’Hb >12 g/dl, l’attention est attirée sur une augmentation de la mortalité. En situation adjuvante, les ASE doivent être utilisés avec prudence [11].
Je remercie mes collègues Dr Christina Appenzeller et Prof. Dr Christoph Driessen pour leur relecture critique du manuscrit.
Littérature :
- Fontana S, Rigamonti V : Transfusion de produits sanguins. Forum Med Suisse 2013 ; 13(05) : 89-93.
- Fopp M, Wernli M : La sécurité de la transfusion sanguine aujourd’hui. Forum Med Suisse 2006 ; 6 : 139-144.
- Klein HG, et al : Red blood cell transfusion in clinical practice. Lancet 2007 ; 370 (9585) : 415-426.
- Carson JL, et al : Seuils de transfusion et autres stratégies pour guider la transfusion de globules rouges allogéniques. Cochrane Database Syst Rev 2012 ; 4 : CD002042.
- National Clinical Practice Guidelines in Oncology : Cancer- and chemotherapy-induced anemia 2.2.01. www.nccn.org/professionals/physician_gls/pdf/anemia.pdf (consulté le 27.02.15)
- Berger MD, et al : Réduction significative des besoins en transfusion de globules rouges en passant d’une politique de transfusion en double unité à une politique en simple unité chez les patients recevant une chimiothérapie intensive ou une transplantation de cellules souches. Haematologica 2012 ; 97(1) : 116-122.
- Williamson LM, et al : The impact of universal leukodepletion of the blood supply on hemovigilance reports of posttransfusion purpura and transfusion-associated graft-versus-host disease. Transfusion 2007 ; 47(8) : 1455-1467.
- Bundesärztekammer : Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten – 4e édition actualisée et révisée, 2014. www.bundesaerztekammer.de/downloads/QLL_Haemotherapie_2014.pdf (consulté le 27.02.2015)
- Treleaven J, et al : Guidelines on the use of irradiated blood components prepared by the British Committee for Standards in Haematology blood transfusion task force. British Journal of Haematology 2010 ; 152 : 35-51.
- Malcovati L, et al : Diagnostic et traitement des syndromes myélodysplasiques primaires chez l’adulte : recommandations de l’European Leukemia Net. Blood 2013 ; 122(17) : 2943-2964.
- Schrijvers D, et al : Agents stimulant l’érythropoïèse dans le traitement de l’anémie chez les patients cancéreux : ESMO Clinica Practice Guidelines for use. Ann Oncol 2010 ; 21 Suppl 5 : v244-247.
- Salama A, Welte M : Thérapie par les érythrocytes. In : Transfusionsmedizin und Immunhämatologie, Berlin Heidelberg New York 2010, 311-319.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(3-4) : 15-18