Les patients souffrant de syndrome du côlon irritable présentent des réactions d’intolérance aux aliments. Un régime Low FODMAP ou un régime sans gluten peut considérablement atténuer ces symptômes.
Chez les patients souffrant du syndrome du côlon irritable (SCI), la barrière intestinale, la motilité, la sécrétion et/ou la sensibilité viscérale sont perturbées. Souvent, le SDR est associé à une altération de l’équilibre immunitaire entérique, les processus micro-inflammatoires ou neuro-immunologiques dans la muqueuse intestinale entraînant une prolifération locale de cellules immunitaires et/ou de cellules EC [1].
“Yurdagül Zopf, responsable de la médecine nutritionnelle à l’hôpital universitaire d’Erlangen (Allemagne), “mais que des processus inflammatoires qui ne se produisent pas chez les personnes en bonne santé ont lieu dans le cadre du syndrome de l’intestin irritable”. Des études histologiques ont montré que les patients souffrant de RDS ont des taux élevés de lymphocytes intraépithéliaux, de mastocytes et de cellules EC. Les biopsies de la muqueuse ont également montré une densité accrue de fibres nerveuses [2–4]. En outre, les patients souffrant de RDS présentaient des taux significativement plus élevés de sérotonine, d’histamine et de tryptase lors des mesures de concentration des médiateurs [5]. Ce profil de médiateur muqueux modifié active le système nerveux entérique et les nerfs afférents primaires (nociceptifs) [1].
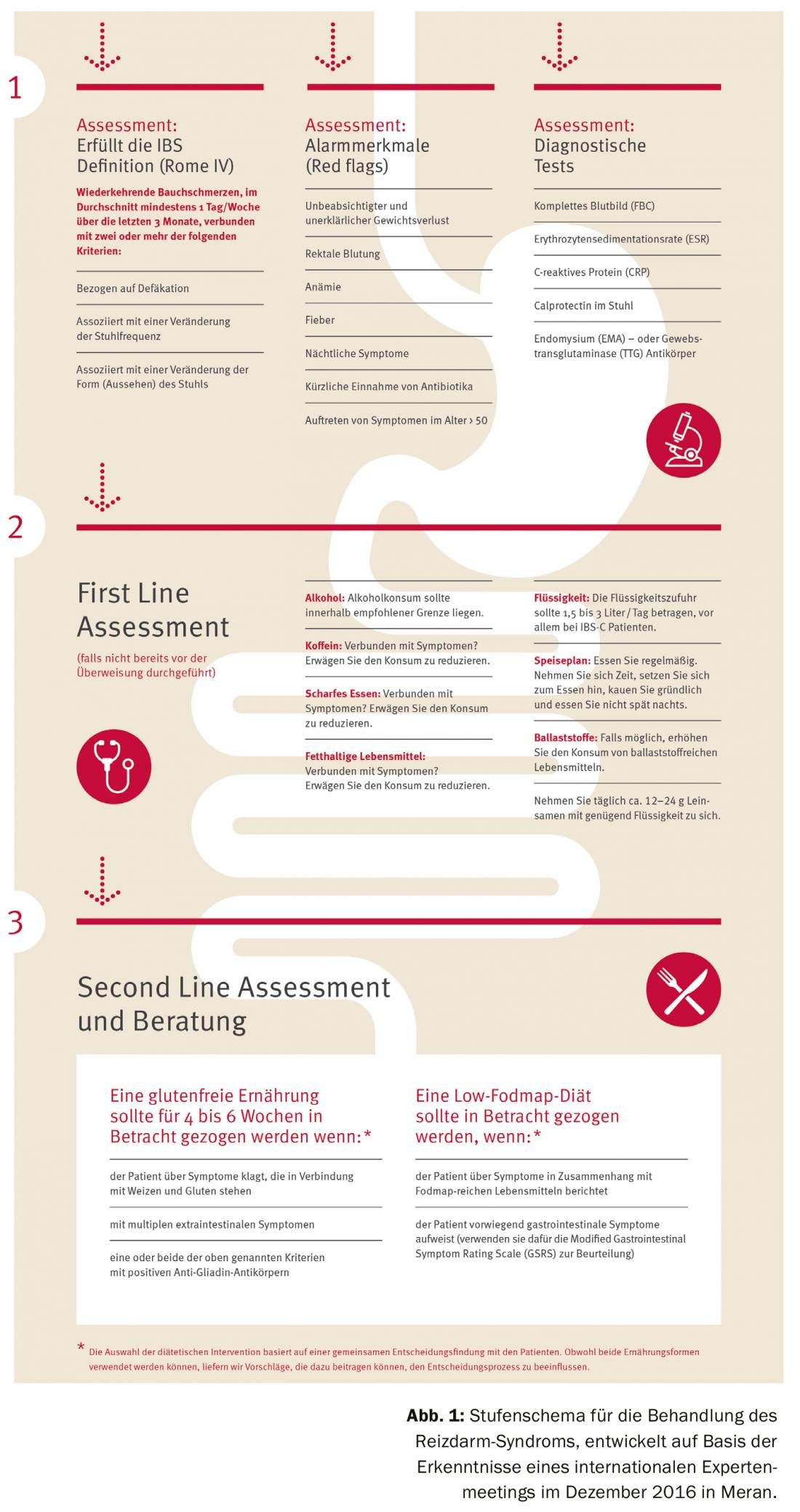
Le diagnostic se fait par exclusion. Les moyens diagnostiques sont la mesure des agents pathogènes dans les selles (diagnostic microbien et virologique avec focalisation sur les déplacements liés à l’inflammation ; œufs de vers), l’iléocoloscopie avec biopsies étagées, l’œsophagogastroduodénoscopie avec biopsies duodénales et les tests respiratoires au lactose, au fructose et au sorbitol H2. Les diagnostics de laboratoire avancés comprennent les électrolytes sériques, la rétention rénale, les enzymes hépatiques et pancréatiques, la TSH, la glycémie/HbA1c, les anticorps cœliaques (AC à la transglutaminase) et la calprotectine A dans les selles.
Régulation par l’alimentation
L’étiopathogénie du RDS est complexe et varie d’un individu à l’autre. En conséquence, il existe de nombreuses approches thérapeutiques qui s’orientent principalement vers le traitement du symptôme principal. Celles-ci comprennent des mesures pharmacologiques (par ex. laxatifs, spasmolytiques, antidépresseurs, lopéramide), la phytothérapie, l’hygiène psychologique et le sport ainsi que la nutrition [6].
L’alimentation joue justement un rôle important dans la régulation du RDS (figure 1). En effet, diverses études ont montré que les patients souffrant de RDS réagissent à différents aliments. Les femmes ont tendance à souffrir plus souvent de réactions d’intolérance que les hommes, ce qui peut s’expliquer par la densité plus élevée de mastocytes chez les femmes. Mais les réactions d’intolérance se produisent indépendamment du sexe, du type de SDR, de l’anxiété éventuelle ou du lieu de traitement (hôpital ou ambulatoire) [7].
La tolérance aux fibres alimentaires a été bien étudiée. Il est important de consommer des fibres solubles plutôt que des fibres insolubles, car ces dernières peuvent aggraver les symptômes : L’hémicellulose (contenue dans le blé et le seigle, par exemple) entraîne une augmentation de la production de gaz. “Le patient présente des symptômes plus importants qu’avant et devient même incompétent pour d’autres modulations alimentaires au fil du temps”, prévient le professeur Zopf.
Il est également confirmé que la prévalence des allergies et des intolérances est plus élevée chez les patients souffrant de RDS [8]. Bien que seules les allergies induites par les IgE puissent être détectées par diagnostic, les patients présentant une activité accrue de la tryptase, de l’histamine et des mastocytes dans l’intestin ont un risque plus élevé de réactions immunologiques.
Un régime sans gluten aide aussi les patients RDS
Une protéine en particulier est souvent au centre de l’attention : le gluten. Il convient ici de différencier les personnes qui ne supportent effectivement pas le gluten – car un régime pauvre en gluten n’est pas automatiquement plus sain pour tout le monde.
Un régime sans gluten à vie est la base du traitement de la maladie cœliaque. Les patients souffrant d’une intolérance au gluten/blé bénéficient également d’un régime alimentaire adapté de cette manière, alors qu’il n’est pas recommandé pour les personnes en bonne santé, car selon les études actuelles, il n’y a pas de bénéfice clinique pour les personnes en bonne santé.
Chez de nombreux patients souffrant de RDS, les troubles sont déclenchés ou aggravés par le blé ou le gluten. Dans ces cas, un régime sans gluten entraîne une nette amélioration des symptômes, comme le montre l’étude IBS (GIBS) publiée en 2017. Dans cette étude, 34% des patients atteints de RDS ont vu leurs symptômes s’améliorer de manière statistiquement significative et cliniquement pertinente suite à un régime sans gluten de quatre mois. L’adhésion au changement de régime alimentaire s’est maintenue chez de nombreux sujets après l’étude : Une très forte proportion (tous les répondeurs, 55% des non-répondeurs) a continué à suivre un régime sans gluten [9].
FODMAP – respectez le niveau de tolérance individuel !
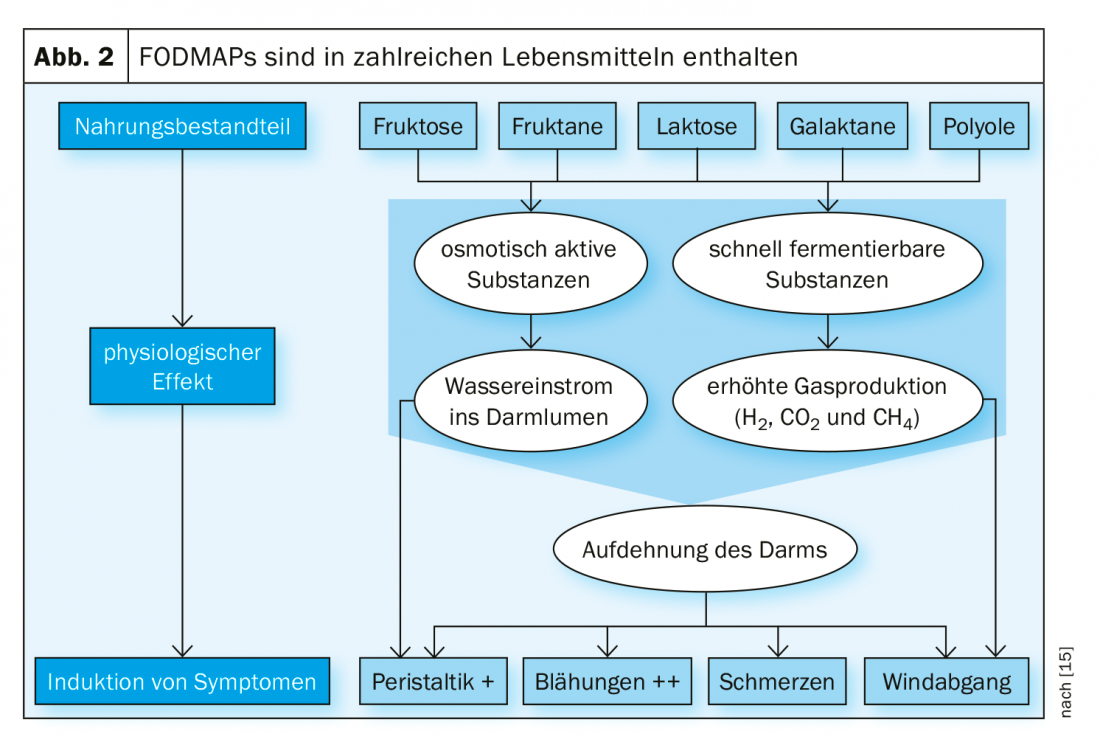
Les FODMAPs – oligosaccharides, di- et monosaccharides fermentescibles et polyols – sont peu ou pas absorbés dans l’intestin grêle. Les processus osmotiques et la fermentation entraînent une augmentation de l’afflux d’eau et de la formation de gaz. La malabsorption de ces glucides est normale, de nombreuses personnes ne ressentent aucun effet négatif lorsqu’elles consomment des FODMAP. En revanche, les patients souffrant de RDS présentent parfois des symptômes importants en réponse aux FODMAP, notamment des ballonnements, des douleurs et des malaises, des flatulences, une modification des selles et/ou une léthargie (Fig. 2). Ils réagissent par une production de gaz beaucoup plus importante que les témoins sains [10]. Un régime à faible teneur en FODMAP entraîne une amélioration des symptômes chez 68 à 76% des patients [11].
Le professeur Zopf souligne l’importance d’une approche adaptée à chaque individu : “Chacun d’entre nous a un niveau de tolérance différent aux FODMAP. Un régime FODMAP ne signifie pas une réduction à zéro. Il faut détecter le seuil qui est supportable pour chacun”. Un régime Low FODMAP ne doit donc pas toujours être suivi sous sa forme maximale. Il peut suffire de réduire ne serait-ce que des parts.
Dans tous les cas, pour éviter la malnutrition, il est important que le régime soit suivi par un thérapeute nutritionniste professionnel. Celui-ci guide le patient à travers trois étapes :
- Régime d’élimination
- Réintroduire (pour vérifier quelles substances posent problème)
- Adaptation
L’une des préoccupations liées au régime Low FODMAP est la réduction des bifidobactéries qui en découle [12]. Une telle modification de la flore intestinale est compréhensible, d’autant plus que les FODMAP produisent différentes substances qui maintiennent l’intégrité muqueuse. Cependant, une étude ultérieure a montré qu’un traitement probiotique simultané pouvait stabiliser la population de bifidobactéries [13].
Un changement de régime alimentaire a également des effets positifs sur les niveaux de sérotonine et de PYY modifiés chez les patients RDS [14].
Source : Zopf Y : “Influence de l’alimentation sur le SCI”. Exposé dans le cadre du symposium satellite Dr. Schär “L’alimentation en cas de côlon irritable”, DGIM 2019, Wiesbaden (D).
Littérature :
- Layer P, et al : S3-Leitlinie Reizdarmsyndrom : Definition, Pathophysiologie, Diagnostik und Therapie. Ligne directrice conjointe de la Société allemande des maladies digestives et métaboliques (DGVS) et de la Société allemande de neurogastroentérologie et de motilité (DGNM). Z Gastroenterol 2011 ; 49(2) : 237-293.
- Akbar A, et al : Increased capsaicin receptor TRPV1-expressing sensory fibers in irritable bowel syndrome and their correlation with abdominal pain. Gut 2008 ; 57(7) : 923-929.
- Guilarte M, et al : Les patients atteints de SII à prédominance diarrhéique présentent une activation des cellules du mastère et une hyperplasie dans le jéjunum. Gut 2007 ; 56(2) : 203-209.
- Spiller RC : Syndrome de l’intestin irritable post-infectieux. Gastroenterology 2003 ; 124(6) : 1662-1671.
- Buhner S, et al : Activation des neurones entériques humains par les surnageants de spécimens de biopsie colique provenant de patients atteints du syndrome de l’intestin irritable. Gastroentérologie. 2009 ; 137(4) : 1425-1434.
- Schaub N, Schaub N : Syndrome du côlon irritable. Aperçus et perspectives 2012. SMF 2012 ; 12(25) : 505-513.
- Simrén M : Altering the Gastrointestinal Flora in Patients with Functional Bowel Disorders : A Way Ahead ? Therap Adv Gastroenterol 2009 ; 2(4 Suppl) : 5-8.
- Boettcher E, Crowe SE : Dietary proteins and functional gastrointestinal disorders. Am J Gastro-enterol 2013 ; 108(5) : 728-736.
- Barmeyer C, et al : La réponse à long terme à un régime sans gluten comme preuve de la sensibilité au blé non celtique chez un tiers des patients atteints de syndrome de l’intestin irritable à prédominance diarrhéique et de type mixte. Int J Colorectal Dis 2017 ; 32(1) : 29-39.
- Ong DK, et al : La manipulation des carbohydrates à chaîne courte dans l’alimentation modifie le schéma de production de gaz et la genèse des symptômes dans le syndrome de l’intestin irritable. J Gastroenterol Hepatol 2010 ; 25(8) : 1366-1373.
- Tuck CJ, et al : Fermentable oligosaccharides, disaccharides, monosaccharides and polyols : role in irritable bowel syndrome. Expert Rev Gastroenterol Hepatol 2014 ; 8(7) : 819-834.
- Staudacher HM, et al : Fermentable Carbohydrate Restriction Reduce Luminal Bifidobacteria and Gastrointestinal Symptoms in Patients with Irritable Bowel Syndrome. J Nutrition Disease 2012 ; 142(8) : 1510-1518.
- Staudacher HM, et al : A Diet Low in FODMAPs Reduces Symptoms in Patients With Irritable Bowel Syndrome and A Probiotic Restores Bifidobacterium Species : A Randomized Controlled Trial. Gastroenterology 2017 ; 153(4) : 936-947.
- Mazzawi T, El-Salhy M : Effet du régime alimentaire et des conseils diététiques individuels sur les cellules endocrines gastro-intestinales chez les patients atteints du syndrome de l’intestin irritable (revue). Int J Mol Med 2017 ; 40(4) : 943-952.
- Beatrice Schilling : Concept FODMAP. https://fodmap.ch/de/fodmap-konzept, dernière consultation le 13.08.2019.
- Leiß O : Fiber, Food Intolerances, FODMAPs, Gluten and Functional Intestinal Disorders – Update 2014. Z Gastroenterol 2014 ; 52(11) : 1277-1298.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(8) : 40-41