Les anticorps monoclonaux casirivimab/imdevimab et sotrovimab ont reçu une autorisation de Swissmedic en décembre dernier et en janvier. Un autre médicament prometteur pour le traitement des patients atteints de Covid-19 devrait bientôt être mis sur le marché en Suisse. Le molnupiravir est un antiviral administré par voie orale qui doit être utilisé à un stade précoce des symptômes du Covid-19, comme le montrent les données d’études récentes.
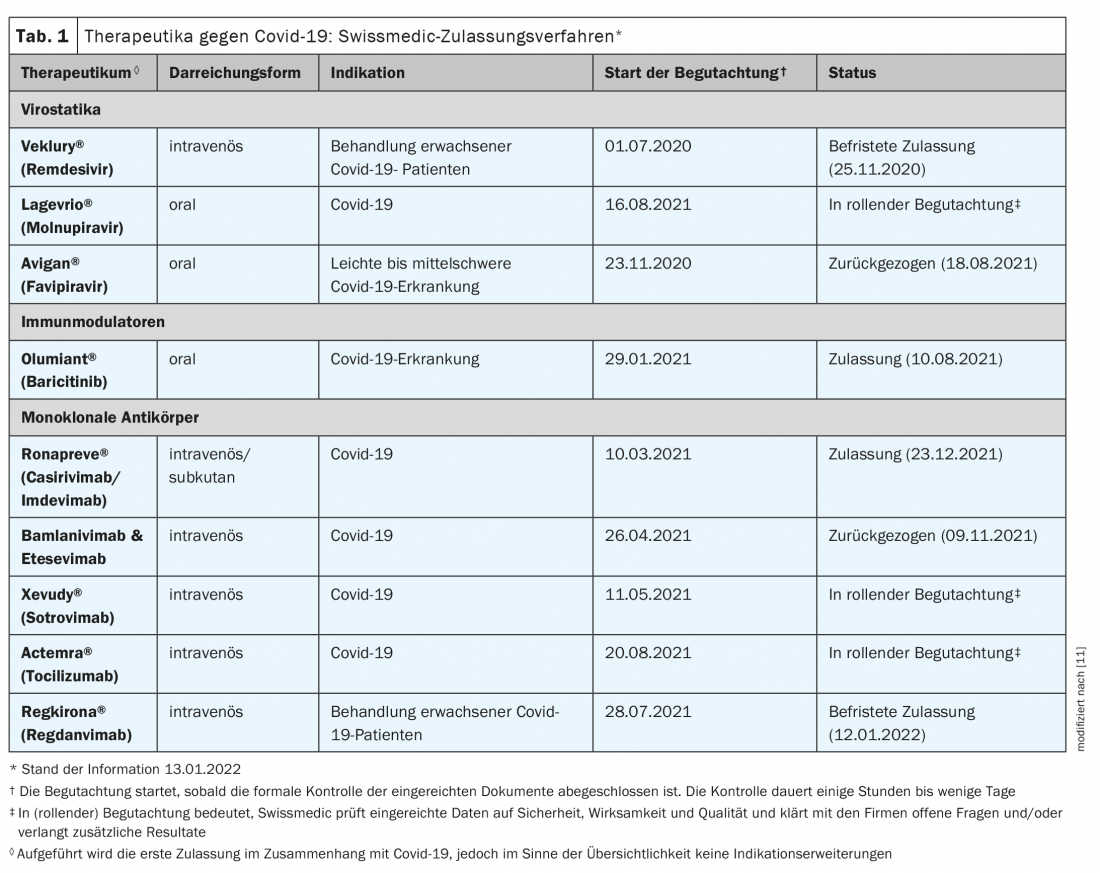
La vaccination est le principal outil de protection contre les infections, les formes graves et les hospitalisations [1]. Cependant, pour ceux qui sont infectés, il est essentiel de disposer de traitements sûrs et efficaces à base de covid-19. Les candidats médicaments prometteurs contribuent notamment à réduire les besoins d’hospitalisation et à prévenir les évolutions graves à l’hôpital. Les trois catégories de médicaments suivantes répondent à ces critères : anticorps monoclonaux antiviraux, substances orales antivirales et immunomodulateurs [1]. Alors que les premiers visent à empêcher les virus de pénétrer dans les cellules de l’organisme ou de s’y multiplier, les immunomodulateurs sont utilisés à un stade avancé de la maladie pour atténuer les réactions de défense de l’organisme [2]. L’OFSP échange régulièrement avec la task force scientifique sur les traitements existants et les nouveaux traitements contre le Covid-19. Les demandes d’autorisation actuellement évaluées par Swissmedic sont présentées dans le tableau 1 [3,15].
Premier médicament oral pour le traitement des patients ambulatoires
L’Office fédéral de la santé publique a conclu un contrat de réservation du médicament antiviral molnupiravir (Lagevrio®) sur recommandation de la taskforce scientifique Covid-19. Le molnupiravir, disponible sous forme de comprimés, est un inhibiteur de l’ARN polymérase et fait partie des agents antiviraux. Le médicament est déjà autorisé au Royaume-Uni depuis novembre 2021 et une demande d’autorisation d’urgence a été déposée aux États-Unis au cours de la même période [2]. Une étude clinique a démontré son efficacité chez des patients Covid-19 non hospitalisés présentant un risque élevé d’évolution grave de la maladie, la fenêtre temporelle semblant déterminante pour le succès du traitement. [4,5] (encadré). Le médicament peut déjà être utilisé en Suisse pendant la procédure d’autorisation de mise sur le marché en cours (état de l’information : 15.01.2022) après une adaptation de l’ordonnance Covid-19 3 qui doit encore être effectuée. Le gouvernement fédéral prendra en charge les coûts du traitement dans le secteur ambulatoire jusqu’à ce qu’il soit remboursé par l’assurance maladie obligatoire [3].

Sotrovimab et casirivimab/imdevimab désormais officiellement approuvés
L’autorisation officielle de Swissmedic a été accordée le 14 janvier 2022 pour Xevudy® (sotrovimab) et le 23 décembre 2021 pour Ronapreve® (casirivimab et imdevimab) [6]. Les deux sont des anticorps monoclonaux administrés par voie intraveineuse, indiqués chez les adultes et les adolescents de plus de 12 ans (poids corporel d’au moins 40 kg) pour le traitement du Covid-19, lorsqu’une oxygénothérapie ou une hospitalisation n’est pas nécessaire et qu’il existe un risque élevé de développer une évolution grave du Covid-19. Ronapreve® est également le seul médicament autorisé en Suisse pour la prévention du Covid-19 lorsque d’autres maladies ou traitements ne permettent pas d’obtenir une réponse immunitaire adéquate à la vaccination contre le Covid-19. Cependant, au moment de l’autorisation de mise sur le marché, aucune information n’était disponible sur l’efficacité de la variante omicron [6].
Remdesivir – Quoi de neuf ?
Le Remdesivir (Veklury®) est déjà disponible en Suisse depuis 2020 pour le traitement du Covid-19. L’utilité de cette molécule, initialement développée pour traiter le virus Ebola, a fait et fait toujours l’objet d’un débat controversé. Une publication de nouvelles données d’étude parue en décembre 2021 dans le New England Journal of Medicine indique que chez les patients non hospitalisés présentant un risque élevé de progression du Covid-19, un traitement de trois jours par Remdesivir est associé à un risque réduit d’hospitalisation ou de décès par rapport au placebo [7]. L’étude a porté sur des patients atteints de Covid-19 non hospitalisés, dont les symptômes étaient apparus au cours des sept derniers jours et qui présentaient au moins un facteur de risque de progression de la maladie. Les patients ont été randomisés pour recevoir le traitement par Remdesivir (n=279) ou par placebo (n=283). Le Remdesivir a été administré par voie intraveineuse à la dose de 200 mg le jour 1 et de 100 mg les jours 2 et 3. Deux patients du groupe Remdesivir et 15 du groupe placebo ont subi des hospitalisations ou des décès liés au Covid-19 (0,7% vs 5,3% ; hazard ratio : 0,13). Au 28e jour, respectivement 1,6% et 8,3% des patients du groupe Remdesivir et du groupe placebo ont présenté une consultation médicale liée au Covid-19 (rapport de risque : 0,19). Aucun décès n’est survenu avant le 28e jour. 42,3% et 46,3% des patients ont présenté des événements indésirables dans les groupes placebo et verum, respectivement.
Et qu’en est-il de Paxlovid® ?
Utilisé à un stade précoce de la maladie de Covid, ce médicament administré par voie orale peut, selon les connaissances actuelles, atténuer considérablement l’évolution de la maladie. Dans des études, Paxlovid® (nirmatrelvir plus ritonavir) a réduit de 89% le risque d’hospitalisation et de décès chez des patients adultes à haut risque de covid-19 non hospitalisés, s’ils étaient traités avec ce médicament pendant cinq jours dans les trois jours suivant le début des symptômes [8]. La FDA américaine a accordé une autorisation d’urgence pour le Paxlovid® à la fin du mois de décembre 2021 pour les patients de plus de 12 ans atteints de la maladie de Corona et présentant des symptômes légers à modérés et un risque élevé de développer une maladie grave [10]. L’Agence européenne des médicaments (EMA) soutient l’utilisation de Paxlovid® pour le traitement des adultes atteints de Covid-19 qui n’ont pas besoin d’oxygène supplémentaire et qui présentent un risque accru d’évolution grave de la maladie [9].
Littérature :
- “Questions et réponses sur la liste des dix candidats thérapeutiques COVID-19”, 22.10.2021, https://ec.europa.eu (dernière consultation 15.01.2022)
- “Médicaments thérapeutiques contre l’infection à coronavirus Covid-19”, 11.01.2022, www.vfa.de/de/arzneimittel-forschung (dernière consultation 15.01.2022)
- “Coronavirus : la Confédération signe un contrat pour réserver un médicament”, www.bag.admin.ch, (dernière consultation 15.01.2022)
- Jayk Bernal A, et al ; Groupe d’étude MOVe-OUT. Molnupiravir pour le traitement oral du Covid-19 chez les patients non hospitalisés. N Engl J Med. 2021 Dec 16 : NEJMoa2116044.
- “L’étude de phase 3 confirme l’efficacité du molnupiravir chez les malades COVID-19 non hospitalisés”, Deutsche Gesellschaft für Neurologie, 07.01.2022, https://dgn.org/neuronews (dernière consultation 15.01.2022)
- “Swissmedic autorise “Ronapreve(R)” pour les patients atteints de Covid-19″ , 27.12.2021, www.swissmedic.ch (dernière consultation 15.01.2022)
- Gottlieb RL, et al ; GS-US-540-9012 (PINETREE) Investigators. Remdesivir précoce pour prévenir la progression vers le Covid-19 sévère chez les patients hors traitement. N Engl J Med. 2021 Dec 22. doi : 10.1056/NEJMoa2116846.
- “Un million d’emballages du médicament Pfizer-Covid-19 : le gouvernement allemand achète du Paxlovid”, www.deutsche-apotheker-zeitung.de (dernière consultation 15.01.2022)
- “L’EMA soutient l’utilisation du Paxlovid en cas d’urgence”, www.aerzteblatt.de/, (dernière consultation 15/01/2022)
- “Pfizer Receives U.S. FDA Emergency Use Authorization for Novel COVID-19 Oral Antiviral Treatment”, www.pfizer.com/news (dernière consultation 15.01.2022)
- “État des autorisations de mise sur le marché pour la lutte contre le Covid-19”, www.swissmedic.ch (dernière consultation 15.01.2022)
- “BIO COVID-19 Therapeutic Development Tracker”, www.bio.org (dernière consultation 15.01.2022)
- Whitley R : Molnupiravir – A Step toward Oral Bioavailable Therapies for Covid-19. N Engl J Med. 2021 Dec 16 : NEJMe2117814.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(1) : 40-41
InFo PNEUMOLOGIE & ALLERGOLOGIE 2022 ; 4(1) : 34-35
CARDIOVASC 2022 ; 21(1) : 34-35












