Une revue a rassemblé les résultats de quatre études randomisées en double aveugle contrôlées par placebo ou par référence d’un traitement combiné Sabal-Urtica chez des hommes de plus de 50 ans souffrant de LUTS associé à l’HBP. La préparation phytothérapeutique s’est avérée être une alternative valable aux médicaments synthétiques. Son profil d’effets secondaires avantageux est un atout, notamment pour les traitements à long terme.
Environ la moitié des hommes de plus de 50 ans présentent des modifications tissulaires bénignes dans la prostate sous la forme d’une augmentation des cellules du tissu conjonctif, des muscles et/ou des cellules épithéliales (hyperplasie bénigne de la prostate, HBP). En raison de l’hyperplasie de l’organe, la compression de l’urètre peut entraîner une augmentation de la résistance à l’écoulement de la vessie – une obstruction bénigne de la prostate (BPO). L’HBP est la principale cause des symptômes du tractus urinaire inférieur (LUTS), qui comprennent les troubles de la vessie, de la miction et de la vidange de la vessie [1]. Les antagonistes des récepteurs adrénergiques α1, les inhibiteurs de la 5α-réductase et les phytothérapeutes sont notamment utilisés comme traitement de première ligne des troubles LUTS associés à l’HBP [2].
Il y a un intérêt croissant pour les options de traitement phytothérapeutique, notamment parce que certains patients sont insatisfaits des effets indésirables des médicaments de synthèse [3]. Un traitement par antagonistes des récepteurs adrénergiques α1 et par inhibiteurs de la 5α-réductase peut par exemple s’accompagner d’effets secondaires sexuels tels que des troubles de l’érection et de l’éjaculation [4]. En outre, un risque relativement élevé d’effets secondaires d’origine vasculaire est généralement rapporté pour la plupart des antagonistes des récepteurs α-adrénergiques [5]. Les effets secondaires cardiovasculaires tels que l’hypotension, accompagnée de vertiges ou de syncopes, touchent principalement les hommes âgés – c’est-à-dire le principal groupe de patients LUTS/BPH nécessitant un traitement médicamenteux [6–8].
Le médicament PRO 160/120 (Prostaplant®-F) est une alternative phytothérapeutique prometteuse pour le traitement du LUTS. La préparation combinée contient comme principaux principes actifs pharmacologiques 160 mg d’extrait de fruits de palmier nain (Serenoa repens ou Sabal serrulata) et 120 mg d’extrait sec de racines d’ortie (Urtica dioica) (encadré) [9].
| Mécanismes d’action du PRO 160/120 La préparation phytopharmaceutique combinée d’extraits de sabal (extrait de palmier nain) et d’urtica (racine d’ortie) présente des effets synergiques. Entre autres, il provoque la conversion de la testostérone en dihydrotestostérone et l’activité aromatase [18]. La relaxation du tissu prostatique gonflé entraîne une diminution de la pression sur l’urètre. Grâce à son action anti-inflammatoire, PRO 160/120 réduit l’irritation de la prostate [19]. Il a été démontré que l’extrait de palmier nain inhibe la 5α-réductase sans présenter d’activité de liaison aux androgènes [20,21] et provoque in vitro une inhibition non compétitive des récepteurs adrénergiques α1 humains [22]. De plus, les récepteurs muscariniques du bas appareil urinaire sont inhibés de manière sélective [23,24]. L’extrait de racine d’ortie inhibe l’activité Na+, K+-ATPase de la membrane prostatique, ce qui peut limiter le métabolisme et la croissance des cellules de la prostate [25]. De plus, des effets antiprolifératifs, antiphlogistiques et anti-œdémateux ont été rapportés pour les deux agents [27,28]. |
Score international des symptômes de la prostate (I-PSS)
Dans les études incluses dans la revue, l’amélioration des symptômes a été évaluée par l’International Prostate Symptom Score (I-PSS) [10–13]. Il s’agit d’un instrument de mesure fiable et valide fréquemment utilisé pour évaluer les LUTS associés à l’HBP, avec sept questions sur la miction notées chacune de 0 à 5 [2,14]. Les questions portent généralement sur le mois précédent. Dans chacune des quatre études [10–13], une amélioration de plus de trois points du score total I-PSS a été obtenue, ce qui est considéré comme un changement cliniquement significatif [16]. Les paramètres suivants ont été relevés comme autres critères d’évaluation : volume de temps urinaire ou volume de temps urinaire, temps de débit urinaire, débit urinaire moyen, débit urinaire maximal, volume mictionnel, durée mictionnelle (temps de vidange de la vessie), volume urinaire résiduel, volume prostatique, qualité de vie. En outre, les événements indésirables et les signaux de sécurité du diagnostic de laboratoire ont été enregistrés.
Aperçu des principaux résultats de l’étude
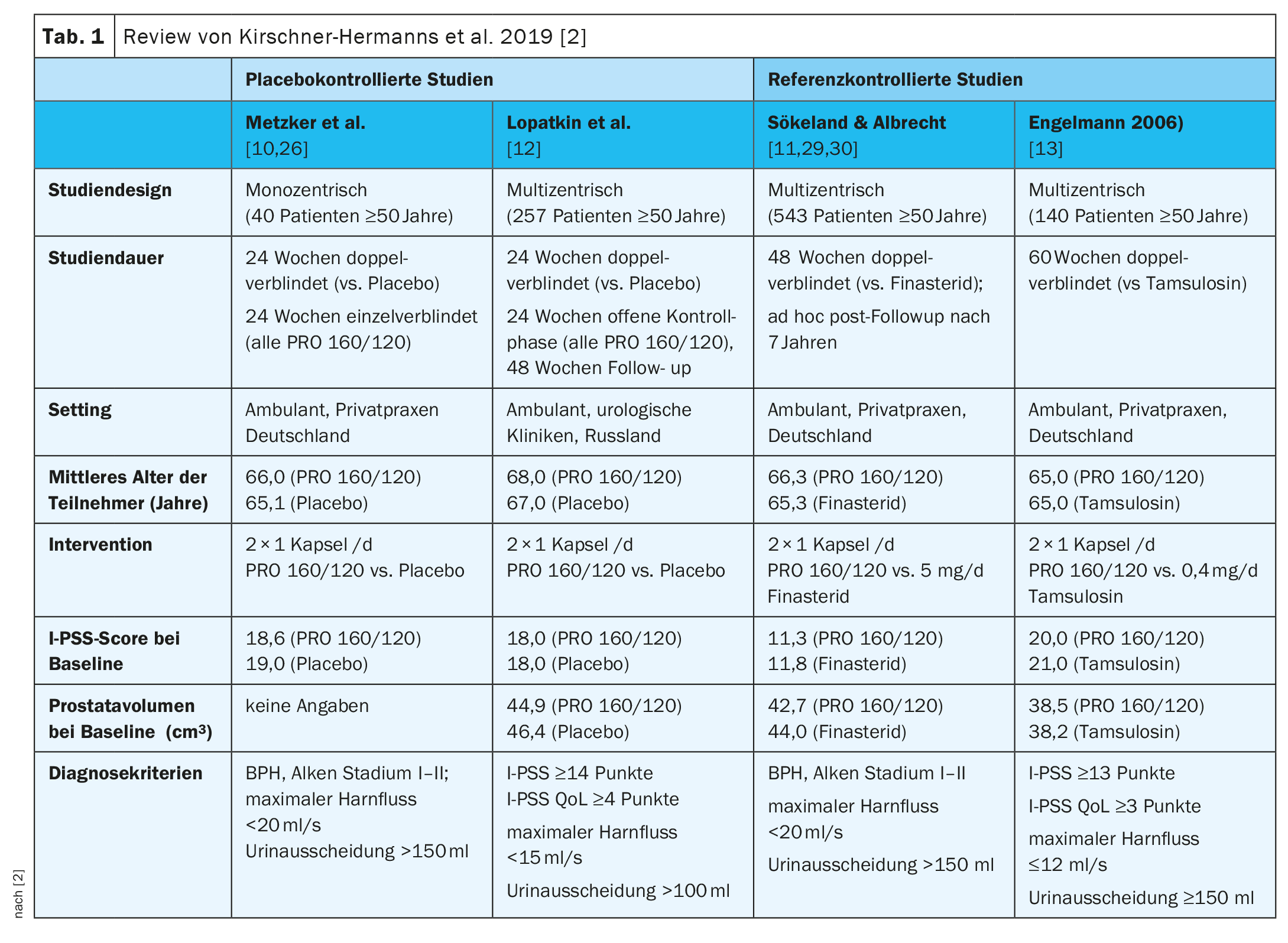
Les données clés des quatre études sont présentées dans le tableau 1 [2,10–13]. Chez Metzker et al. et Lopatkin et al. il s’agissait d’études contrôlées par placebo et chez Engelmann et al. ainsi que Sökeland & Albrecht pour des études contrôlées par référence [2,10–13].
Metzker et al (n=40) [10]: Au cours de la phase de traitement en double aveugle, l’I-PSS moyen est passé des valeurs initiales de 18,6 points dans le groupe PRO 160/120 et 19,0 points dans le groupe placebo à 11,1 et 17,6 points respectivement à la semaine 24 (p=0,002 ; test U bilatéral). Une évaluation post-hoc de ces résultats, centrée sur les items I-PSS évaluant les symptômes dits irritatifs, a montré qu’il y avait une amélioration statistiquement significative de l’envie d’uriner et de la fréquence des mictions sous PRO 160/120 pendant cette phase de traitement [26]. Au cours de la phase de traitement en simple aveugle qui a suivi, l’I-PSS a également diminué chez les patients qui sont passés du placebo au traitement PRO 160/120. Cependant, à la semaine 48, il y avait toujours un avantage en faveur du groupe qui était dans le bras de traitement actif (PRO 160/120) dans les deux phases de l’étude (p=0,009 ; test U bilatéral).
Lopatkin et al. (n=257) [12]: Après la phase de traitement en double aveugle, une différence de groupe statistiquement significative a été observée dans la diminution de l’I-PSS en faveur du PRO 160/120 ; -6 points dans le bras traitement et -4 points dans le bras placebo (p<0,01, test U unilatéral stratifié). À la fin de la phase de contrôle, l’I-PSS a diminué de 2 points supplémentaires chez les anciens patients sous placebo (qui étaient désormais également traités par le PRO 160/120) et d’un point supplémentaire chez les patients traités par le PRO 160/120 depuis le début de l’étude. Cette différence entre les deux groupes de traitement était également statistiquement significative (p=0,01, test U stratifié unilatéral). A la fin de la phase de contrôle, la réduction de l’I-PSS moyen dans les deux groupes de traitement était de sept points par rapport à la valeur initiale, ce qui indique que les patients anciennement sous placebo ont bénéficié du traitement par le PRO 160/120 dans la même mesure que les patients déjà traités par le PRO 160/120 depuis le début du traitement en double aveugle [15]. Après la phase de contrôle, 213 patients (PRO 160/120 : 106 ; placebo : 107) ont participé à l’extension ouverte de l’étude qui a suivi (semaines 49-96) [17]. Chez les patients sans score I-PSS de base manquant (PRO 160/120 : 106 ; placebo : 103), une réduction médiane supplémentaire du score de 1 point a été observée dans chaque groupe, ce qui a entraîné une réduction globale médiane de 9 points dans les deux groupes par rapport au score initial. Cela correspond à une réduction de 52,9% du score total I-PSS par rapport aux valeurs initiales.
Sökeland & Albrecht (n=543) [11]A la fin de l’étude, les symptômes des patients traités par le PRO 160/120 se sont améliorés de manière similaire à ceux des patients traités par le finastéride, l’I-PSS passant de 11,3 ± 6,5 points (PRO 160/120) ou 11,8 ± 6,6 points (finastéride) au début de l’étude à 8,2 ± 5,8 points (PRO 160/120) et 8,0 ± 5,7 points (finastéride) à la semaine 24 et 6,5 ± 5,8 points (PRO 160/120) et 6,2 ± 5,2 points (finastéride) à la semaine 48 (moyennes ± SD). L’amélioration de la qualité de vie selon le score C de l’AUA était également similaire par rapport au finastéride. L’augmentation du débit urinaire maximal sous PRO 160/120 (+1,9 ml/s) et finastéride (+2,4 ml/s) s’est avérée thérapeutiquement comparable dans une plage d’équivalence de ±1,5 ml/s (p=0,037 ; test t modifié pour hypothèses décalées).
Engelmann et al. (n=140) [13]: Le score total IPSS s’était amélioré de 9 points en moyenne dans les deux groupes à la fin du traitement, alors qu’il était d’environ 20 points au départ. Au total, 32,4% des patients traités par PRO 160/120 et 27,9% des patients traités par tamsulosine étaient répondeurs (c.-à-d. score total IPSS ≤7 à la fin du traitement ; p=0,034, test de non-infériorité de Farrington-Manning ; seuil de non-infériorité de 10%). Dans une analyse de sous-groupe par valeur initiale de l’I-PSS, le PRO 160/120 et la tamsulosine ont eu une efficacité comparable chez les patients présentant des symptômes modérés (I-PSS à la ligne de base ≤19 points) et chez les patients présentant des symptômes sévères (I-PSS à la ligne de base ≥20 points). La qualité de vie des patients s’est améliorée de 2 points en médiane dans le groupe PRO 160/120 et de 1 point dans le groupe tamsulosine (valeurs initiales : 3 points et 4 points respectivement ; médianes).
Littérature :
- Ligne directrice S2e Diagnostic et traitement du syndrome bénin de la prostate (BPS), numéro d’enregistrement : 043-034, version longue 5.0 – mise à jour février 2023.
- Kirschner-Hermanns R, Funk P, Leistner N : WS PRO 160 I 120 mg (a combination of sabal and urtica extract) in patients with LUTS related to BPH. Ther Adv Urol 2019 Oct 11;11:1756287219879533.
- Geavlete P, Multescu R, Geavlete B : Extrait de Serenoa repens dans le traitement de l’hyperplasie prostatique bénigne. Ther Adv Urol 2011 ; 3 : 193-198.
- Mirone V, et al : Traitement actuel de l’hyperplasie prostatique bénigne : impact sur la fonction sexuelle et gestion des événements indésirables sexuels associés. Int J Clin Pract 2011 ; 65 : 1005-1013.
- Nickel JC, Sander S, Moon TD : A meta-analysis of the vascular-related safety profile and efficacy of alpha-adrenergic blockers for symptoms related to benign prostatic hyperplasia. Int J Clin Pract 2008 ; 62 : 1547-1559.
- Logan IC, Witham MD : Efficacité des traitements de l’hypotension orthostatique : une revue systématique. Age Ageing 2012 ; 41 : 587-594.
- Man in’t Veld AJ : HBP symptomatique et hypertension : la comorbidité affecte-t-elle la qualité de vie ? Eur Urol 1998 ; 34(Suppl. 2) : 29-36.
- Schimke L, Schimke J : Implications urologiques des chutes chez les personnes âgées : symptômes du bas appareil urinaire et médicaments alpha-bloquants. Urol Nurs 2014 ; 34 : 223-229.
- Information sur les médicaments, www.swissmedicinfo.ch,(dernière consultation 15.09.2023)
- Metzker H, Kieser M, Hölscher U : Efficacité d’une préparation combinée Sabal-Urtica dans le traitement de l’hyperplasie bénigne de la prostate (HBP). Urologue B 1996 ; 36 : 292-300.
- Sökeland J, Albrecht J : Association d’extraits de sabal et d’urtica vs. finastéride dans l’HBP (stades I à II selon Alken). Comparaison de l’efficacité thérapeutique dans une étude en double aveugle d’un an. Urologue A 1997 ; 36 : 327-333.
- Lopatkin N, et al. : Efficacité et sécurité à long terme d’une association de sabal et d’extrait d’urtica pour les symptômes du tractus urinaire inférieur – un essai multicentrique contrôlé par placebo, en double aveugle. World J Urol 2005 ; 23 : 139-146.
- Engelmann U, et al : Efficacité et sécurité d’une association de sabal et d’extrait d’urtica dans les symptômes du tractus urinaire inférieur. Une étude randomisée en double aveugle versus tamsulosine. Recherche sur les médicaments 2006 ; 56 : 222-229.
- McConnell J, et al. (Eds) : Dysfonctionnement du tractus urinaire inférieur chez l’homme. Évaluation et gestion. In : Actes de la 6e Consultation internationale sur les nouveaux développements dans le cancer de la prostate et les maladies de la prostate, Paris, France, 24-27 juin 2005. Publications sur la santé, 2006.
- Sivkov A, et al. : Efficacité et sécurité à long terme d’une combinaison d’extraits de sabal et d’urtica dans le LUTS – un essai multicentrique contrôlé par placebo, en double aveugle. Urologue A 2001 ; 40(Suppl. 1) : S19.
- Barry MJ, et al : Benign prostatic hyperplasia specific health status measures in clinical research : how much change in the American Urological Association symptom index and the benign prostatic hyperplasia impact index is perceptible to patients ? J Urol 1995 ; 154 : 1770-1774.
- Lopatkin et al. : Efficacité et sécurité d’une combinaison de Sabal et d’extrait d’Urtica dans les symptômes du tractus urinaire inférieur – suivi à long terme d’un essai multicentrique contrôlé par placebo, en double aveugle. Int Urol Nephrol 2007 ; 39 : 1137-1146.
- Madersbacher S, et al : Association entre les prescriptions de PRO 160/120 et l’incidence des complications de l’hyperplasie prostatique bénigne en Allemagne : une étude de cohorte rétrospective. Postgrad Med 2023 ; 135(2) : 149-154.
- Koch E : Extraits de fruits de palmier à huile (Sabal serrulata) et de racines de petite vipère (Urtica dioica) : alternatives viables dans le traitement médical de l’hyperplasie prostatique bénigne et des symptômes associés des voies urinaires inférieures. Planta Med 2001 ; 67(6) : 489-500.
- Casarosa C, et al. : Lacunes dans les effets d’un extrait lyposterolic de Serenoa repens sur les niveaux plasmatiques de testos-terone, follicle-stimulating hormone, et luteinizing hormone. Clin Ther 1988 ; 10 : 585-588.
- Düker EM, Kopanski L, Schweikert HU : Inhibition de l’activité de la 5α-réductase par des extraits de Sabal serrulata. Planta Med 1989 ; 55 : 587.
- Goepel M, et al : Saw palmetto extracts potently and noncompetitively inhibit human 1-adrenoceptors in vitro. Prostate 1999 ; 38 : 208-215.
- 23. Abe M, et al : Pharmacologically relevant receptor binding characteristics and 5α-reductase inhibitory activity of free fatty acids contained in saw palmetto extract. Biol Pharm Bull 2009 ; 32 : 646-650.
- Suzuki M, et al : Muscarinic and alpha 1-adrenergic receptor binding characteristics of saw palmetto ex-tract in rat lower urinary tract. Urologie 2007 ; 69 : 1216-1220.
- Hirano T, Homma M, Oka K : Effets des extraits de racine de garance et de leurs composants stéroïdiens sur la Na+, K+-ATPase de l’hyperplasie prostatique bénigne. Planta Med 1994 ; 60 : 30-33.
- Popa G, Hägele-Kaddour H, Walther C : Efficacité symptomatique d’une préparation combinée Sabal-Urtica dans le traitement du syndrome de la prostate bénigne. Résultats d’une étude en double aveugle contrôlée par placebo. MMW Fortschr Med 2005 ; 147(Originalien III) : 103-108.
- Koch E, Biber A : Effets pharmacologiques des extraits de sabal et d’urtika comme base pour un traitement médicamenteux rationnel de l’hyperplasie bénigne de la prostate. Urologue B 1994 ; 34 : 90-95.
- Lichius JJ, et al. : Effet antiprolifératif d’une fraction polysaccharidique d’un extrait méthanolique à 20% de racines de gentiane stingentes sur les cellules épithéliales de la prostate humaine (LNCaP). Pharmacie 1999 ; 54 : 768-771.
- Sökeland J : Combined sabal and urtica extract compared with finasteride in men with benign prostatic hyperplasia : analysis of prostate volume and therapeutic outcome. BJU Int 2000 ; 86 : 439-442.
- Sökeland J, Schläfke S : Effets à long terme du PRO 160/120 chez les patients atteints d’HBP. Uro-News Rapport de thérapie actuel 2007 ; 164 : 2-3.