Le traitement de l’asthme chez l’enfant repose aujourd’hui sur un suivi étroit du patient, incluant une formation à l’autogestion. Mais est-ce vraiment de l’asthme ? Une question à se poser en premier lieu. Les taux de surdiagnostic sont élevés.
Une analyse rétrospective de quatre centres académiques aux Pays-Bas a révélé que l’asthme chez les enfants âgés de 6 à 18 ans était surdiagnostiqué dans plus de la moitié des cas, avec par conséquent des traitements inutiles et des conséquences sur la qualité de vie [1]. “Dans la pratique quotidienne, il y a toujours des cas où l’on ne sait pas très bien si les symptômes sont dus à l’asthme ou à d’autres causes. Nicolas Regamey, pneumologue à l’hôpital pour enfants de Lucerne. Cette dernière est due au fait que les enfants ferment paradoxalement leurs cordes vocales lorsqu’ils respirent, c’est-à-dire qu’ils inspirent “mal”. En clinique, cela se traduit par un stridor inspiratoire d’apparition aiguë avec dyspnée à l’effort physique, au stress, aux odeurs ou aux allergènes. Après quelques minutes, les symptômes disparaissent soudainement. Les jeunes adolescentes sont particulièrement touchées. Sur le plan thérapeutique, il suffit généralement d’une information, combinée à des exercices vocaux ou à une orthophonie.
Diagnostic de l’asthme
La première chose à faire pour diagnostiquer l’asthme est de rechercher des signes cliniques (aperçu 1), auxquels s’ajoute la preuve d’une broncho-obstruction variable/réversible (clinique, spirométrie). Les tests d’allergie ou la mesure de l’inflammation allergique des voies respiratoires (FeNO) sont utiles, mais ils ne sont ni spécifiques ni sensibles.

La provocation à la méthacholine est bien adaptée à l’exclusion de l’asthme, moins à sa confirmation. Les tests d’effort peuvent être utilisés à cet effet. Ils sont soit réalisables librement (“free running test”), c’est-à-dire que le jeune patient fait le tour de la maison ou monte les escaliers une fois et que le médecin recueille des signes subjectifs, procède à un examen clinique (essoufflement, toux, respiration sifflante, pouls, tension artérielle), effectue une mesure de la SpO2 et une spirométrie avant/après. “Au LUKS, nous effectuons un test d’effort standardisé, appelé Exercise-induced Athma Test”, a déclaré le conférencier. Dans ce cas, les patients sont soumis à un effort sur tapis roulant pendant six à huit minutes dans un air sec avec un taux d’humidité inférieur à 50%, suivi d’une spirométrie après 5, 10, 15, (30) minutes. Une chute du VEMS de 10% (15%) est diagnostique pour un asthme d’effort. “Souvent, les jeunes ferment pendant la phase de refroidissement”, a expliqué le professeur Regamey.
Les diagnostics différentiels de l’asthme sont nombreux. Comme nous l’avons mentionné, il peut s’agir d’un simple déconditionnement physique (notamment en cas d’obésité) ou d’un dysfonctionnement des cordes vocales/d’une dyscoordination respiratoire. Il faut également penser aux infections respiratoires banales et répétées (fréquentation de la crèche, exposition à la fumée de tabac). Le “postnasal drip”, le “cough hypersensitivity syndrome” (toux non spécifique prolongée) et le reflux gastro-œsophagien sont également des diagnostics différentiels importants.
Objectifs de la thérapie
“Maintenant que l’asthme a été diagnostiqué, que vais-je et dois-je traiter ? La pharmacothérapie doit être aussi efficace, sûre et simple que possible.
Efficacité : “Nous ne pouvons pas guérir l’asthme, il faut le dire clairement aux parents”, a conseillé le professeur Regamey. En principe, le traitement a pour objectif de contrôler les symptômes, d’éviter les exacerbations (car les épisodes répétés entraînent un remodelage des voies aériennes) et donc d’empêcher une obstruction fixe, le tout avec le moins d’effets secondaires possible. “Ne conseillez en aucun cas à un enfant asthmatique de ne pas faire de sport à l’école. Il est important de ne pas limiter les activités”, a expliqué l’orateur. Le contrôle des symptômes doit être ajusté en conséquence, de sorte qu’il n’y ait pas de symptômes diurnes ou moins de deux fois par semaine. La nuit, l’absence de symptômes doit être recherchée afin d’éviter les réveils nocturnes. L’utilisation des “releveurs” devrait être limitée à deux utilisations par semaine au maximum.
Dans ce contexte, il convient de mentionner le schéma SMART (Symbicort® as Maintenance And Reliever Therapy) – un stéroïde (budésonide) associé à un LABA à action rapide (formotérol). A la posologie de base relativement faible (en général 2×/j) s’ajoutent des doses supplémentaires selon les besoins (jusqu’à 6×/j à partir de 6 ans et 10×/j à partir de 12 ans). C’est également possible avec Flutiform®.
Toutefois, cela n’est possible qu’au niveau 3 selon le schéma graduel des GINA Guidelines (qui s’applique également aux enfants). Auparavant, au niveau 1, les SABA peuvent être utilisés si nécessaire, et à partir du niveau 2, ils peuvent être combinés à des CSI à faible dose en tant que contrôleurs. Le montelukast, un antagoniste des leucotriènes administré par voie orale, est une alternative pour les jeunes enfants et ceux qui craignent les stéroïdes. Outre le schéma SMART, les guidelines recommandent, à partir du niveau 3, des CSI à doses moyennes chez les enfants (surtout entre six et onze ans). Dans les étapes supérieures (à partir de l’étape 4), la dose de CSI combinée à des LABA est ensuite encore augmentée si l’effet est insuffisant.
Un asthme mal contrôlé pendant l’enfance est un facteur de risque de mauvaise fonction pulmonaire à l’âge adulte. Ces patients commencent donc leur vie future avec un handicap : Le déclin physiologique de la fonction pulmonaire avec l’âge, mais aussi, bien sûr, les influences néfastes telles que le tabagisme, etc. ont chez eux des conséquences bien plus fatales que chez ceux qui commencent leur vie d’adulte avec une fonction pulmonaire normale (Fig. 1).
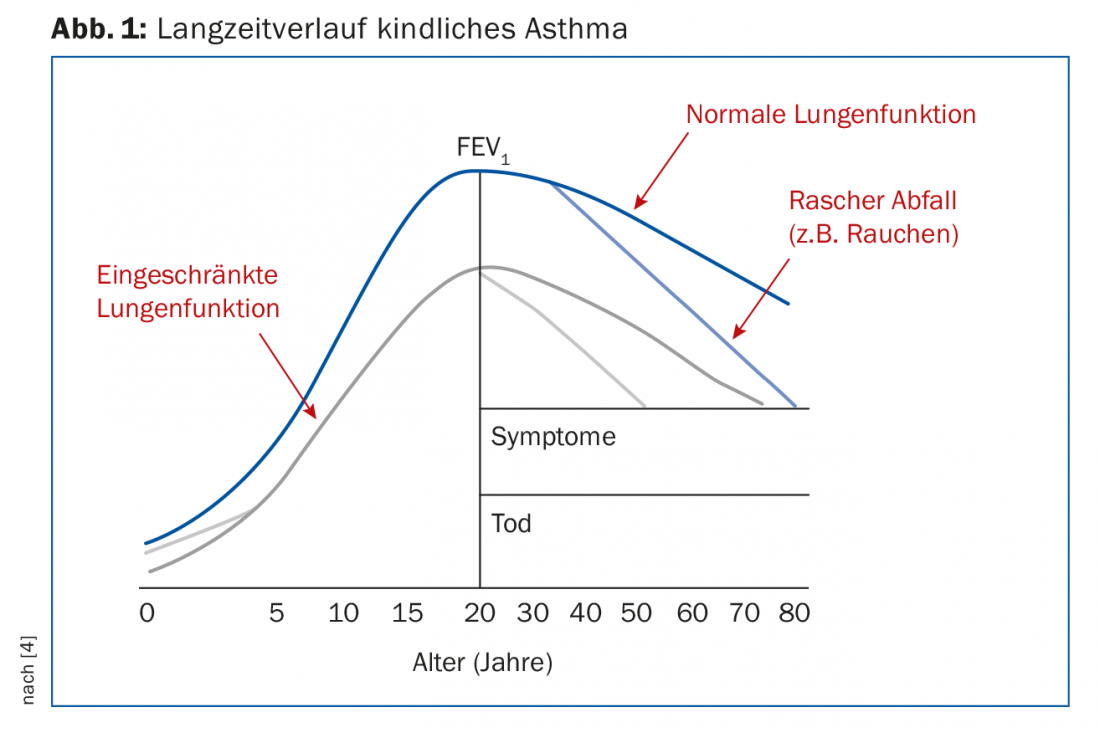
Sécurité : les corticostéroïdes en particulier ne jouissent généralement pas d’une bonne réputation auprès de la population. Cependant, dans de nombreux cas, les avantages de la thérapie dépassent les inconvénients/effets secondaires. Un effet secondaire possible souvent discuté chez l’enfant est le retard de croissance avec réduction consécutive de la taille, bien que, selon une étude menée avec le budésonide, ce retard soit relativement faible (env. -1,2 cm, surtout chez les filles) [2]. Le traitement sans stéroïdes par voie orale avec le montelukast peut sembler plus attrayant dans ce cas et, en effet, l’adhérence peut être meilleure chez certains patients qui ont de profondes réserves sur les CSI (y compris en ce qui concerne leur manipulation). Dans ce cas, il faut toutefois tenir compte des effets secondaires neuropsychiatriques [3]. Il est donc essentiel d’évaluer sans a priori les différentes options de traitement avec les parents et les enfants.
Simplicité : les aérosols-doseurs doivent toujours être appliqués avec une chambre d’amorçage chez les enfants (avec un masque chez les plus petits). La coordination est ainsi facilitée. Une fois activé, l’aérosol est ralenti et reste dans la chambre jusqu’à l’inhalation. Les dépôts indésirables de la substance active au niveau oropharyngé sont réduits, mais l’utilisation de ces dispositifs est plutôt compliquée et nécessite un nettoyage régulier (en raison d’une éventuelle contamination bactérienne). Il s’agit d’inspirer lentement et profondément à partir de la préchambre pendant plusieurs respirations.
Pour les enfants un peu plus âgés, mais pas en cas de crise d’asthme sévère, les inhalateurs de poudre sèche sont envisageables. Les exemples incluent Diskus®, Turbuhaler® ou Ellipta®. La coordination ne pose pas de problème ici. La manipulation est relativement simple, mais un débit d’inhalation plus élevé est nécessaire et même une petite expiration dans le système peut entraîner une agglutination. Le principe de base est d’inspirer fortement et profondément, puis de retenir sa respiration.
“L’inhalation correcte nécessite une bonne formation et un suivi régulier. De toute façon, cela aide énormément si les enfants sont informés de leur affection, de la manière de la gérer correctement et de l’autogestion. Dans ce contexte, les formations aha ! sont recommandées”, a déclaré l’orateur.
Prévention et suivi
Outre la pharmacothérapie et l’éducation des patients, la gestion optimale de l’asthme passe également par la prévention, c’est-à-dire l’évitement des allergènes et des déclencheurs. Il ne faut donc pas oublier le diagnostic d’allergie. Les acariens jouent le rôle le plus important et sont mieux traités par un assainissement ciblé que par une désensibilisation. Toutefois, dans d’autres cas, elle peut être tout à fait indiquée.
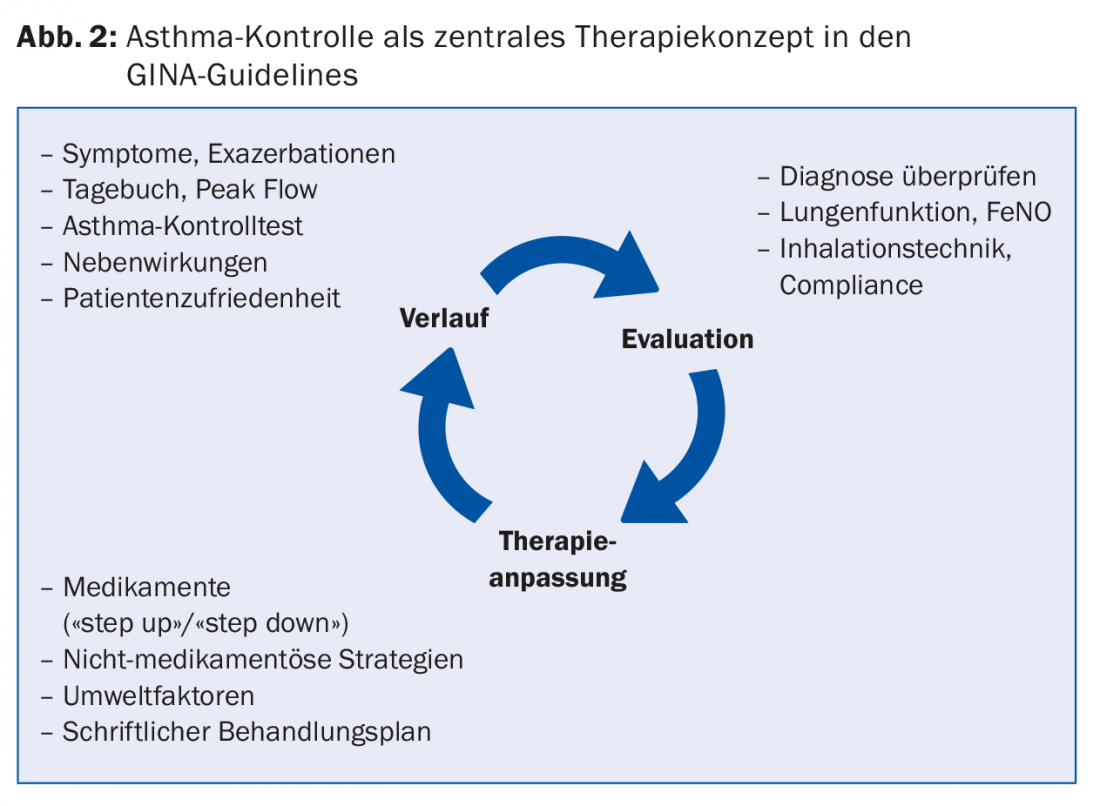
L’examen des stratégies non médicamenteuses et des facteurs environnementaux fait partie du suivi trimestriel de l’asthme (Fig. 2). L’évolution du traitement y est enregistrée et évaluée. S’il y a un potentiel d’amélioration, on peut adapter le traitement médicamenteux/non médicamenteux et le consigner dans le plan de traitement écrit. Cette dernière est utile, car les enfants écoutent généralement “à moitié” pendant la consultation et les adultes peuvent être distraits par le comportement de leur enfant. Le plan de traitement écrit est affiché sur le réfrigérateur, par exemple, et indique le traitement de base, la réserve avant l’effort physique, les adaptations en cas d’infection des voies respiratoires et le traitement d’urgence.
Source : 11e cycle de printemps, 7-9 mars 2018, Lucerne
Littérature :
- Looijmans-van den Akker I, van Luijn K, Verheij T : Overdiagnosis of asthma in children in primary care : a retrospective analysis. Br J Gen Pract 2016 Mar ; 66(644) : e152-157.
- Kelly HW, et al : Effet des glucocorticoïdes inhalés dans l’enfance sur la taille adulte. N Engl J Med 2012 Sep 6 ; 367(10) : 904-912.
- Ernst P, Ernst G : Neuropsychiatric adverse effects of montelukast in children. Eur Respir J 2017 Aug 17 ; 50(2). pii : 1701020.
- Stocks J, Hislop A, Sonnappa S : Développement précoce des poumons : effet à long terme sur la santé et les maladies respiratoires. Lancet Respir Med 2013 Nov ; 1(9) : 728-742.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(4) : 45-47











