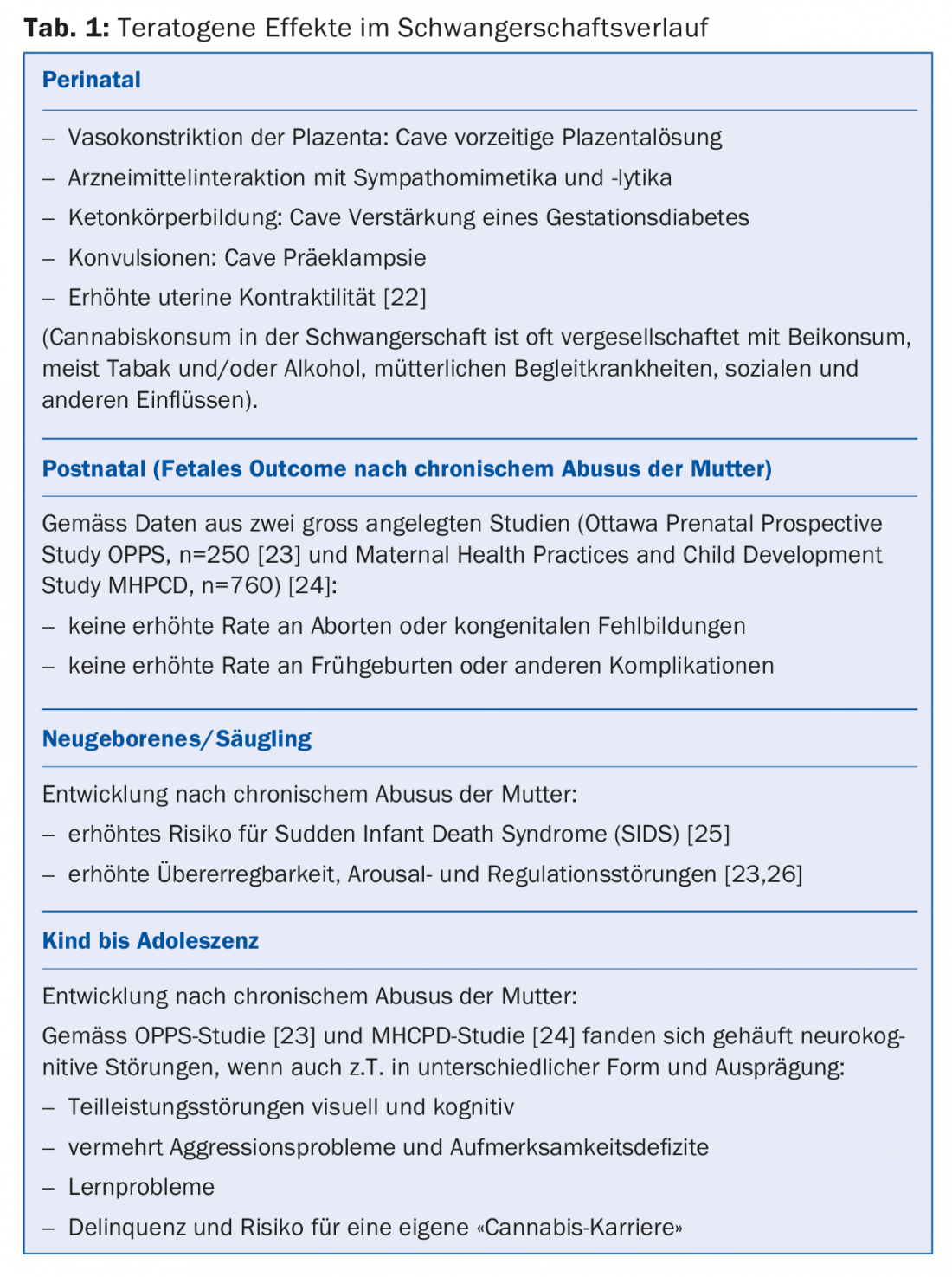
La consommation de cannabis a des effets potentiellement nocifs sur le plan périnatal. Cependant, le taux d’avortements, de malformations congénitales, de naissances prématurées ou d’autres complications n’est pas augmenté. L’abus chronique de cannabis par la mère est associé à un risque plus élevé de syndrome de mort subite du nourrisson chez les nourrissons et peut entraîner des troubles de l’éveil et de la régulation chez les enfants.
Cannabis est une plante annuelle utile et ornementale appartenant à la famille du chanvre. Les botanistes font la distinction entre le chanvre ordinaire (C. sativa) et le chanvre indien (C. sativa var. indica). Les produits comprennent des fibres de chanvre, des huiles et des graines. Les extraits de chanvre suivants sont considérés comme des stupéfiants ou des drogues psychoactives (en se liant aux récepteurs cannabinoïdes CB1 et CB2) :
- Marijuana : pétales et bractées séchées ; c’est la résine sécrétée par les écailles des glandes qui est responsable des effets. La marijuana est principalement fumée. Pour chaque “joint”, environ 0,2 g de fleur sont mélangés au tabac.
- Haschisch : la résine séchée est fumée, mâchée ou mangée. 200 mg de haschisch correspondent aux effets de 1 g de marijuana. La résine est un mélange d’au moins 40 cannabinoïdes.
Parmi les substances actives, l’acide cannabidiolique (0,3-0,7%) ou son produit de dégradation, le delta-9-tétrahydrocannabinol (Δ9THC ou THC ; 0,1-0,5%), aux effets psychotropes, sont importants [1]. Dans l’ensemble, la teneur en THC des variétés de plantes plus modernes devrait augmenter [2]. Les cannabinoïdes synthétiques “Spice” sont environ 500 fois plus puissants [3]. Aux États-Unis, la marijuana était considérée comme l’analgésique le plus courant jusqu’en 1898. Depuis 1928 (Conférence sur l’opium), le cannabis fait partie des opiacés et est illégal. Depuis 2004, une légalisation croissante a de nouveau eu lieu, par exemple dans de nombreux États américains et au Canada pour l’utilisation du cannabis à des fins médicales [2,5]. L’âge d’or du chanvre en Europe se situe autour de 1700 (produits nautiques, textiles, papier), les premières traces d’utilisation du chanvre (en Asie) remontent à 10 000 ans avant JC. Entre 1850 et 1930, plus de 100 médicaments différents à base de cannabis ont été créés en Suisse [4]. Aujourd’hui, il y a de grandes tentatives de légalisation, notamment à des fins médicales.
Données épidémiologiques
La consommation de cannabis est en augmentation ces dernières décennies, tant aux États-Unis qu’en Europe, et concerne les hommes dans les trois quarts des cas. Selon les statistiques, la prévalence est presque deux fois plus élevée aux États-Unis (environ 8%) qu’en Europe (environ 4%) [15,18,19].
Données sur la prévalence de la consommation de cannabis (nicotine) pendant la grossesse :
- États-Unis : grossesse totale : 5,2% (16%), premier trimestre : 10,7% (23,2%), deuxième trimestre : 2,8% (13,6%), troisième trimestre : 2,3% (11,1%) [20].
- Suisse : des données de 2008 montrent que la fréquence de la consommation de cannabis avant le début de la grossesse passe de 5,4% à 2,1% (lorsque la grossesse est connue) et diminue à 1,5% après l’accouchement [21].
Pharmacocinétique du THC
L’absorption de tétrahydrocannabinol (THC) par inhalation ou par voie orale produit un effet au bout de 30 à 90 minutes, qui dure de quatre à huit heures. Le Δ9-THC est principalement oxydé en 11-hydroxy-Δ9-THC (11-OH-Δ9 THC) (psychoactif) chez l’homme et est ensuite métabolisé en 11-Nor-9-carboxy-Δ9-THC (11-COOH-THC, THC-COOH, acide carboxylique THC, non psychoactif). Plus de 100 métabolites différents du Δ9-THC ont été identifiés chez l’homme et l’animal, presque tous ne sont pas psychoactifs. La métabolisation se fait essentiellement dans le foie et par les enzymes du cytochrome P450 2C9, 2C19 et 3A4 [6].
Les effets psychiques se produisent entre 30 μg/kg et 50 μg/kg par voie intraveineuse, 50 μg/kg par inhalation de fumée et 120 μg/kg par voie orale. En cas d’inhalation de fumée de 5 à 7 mg, la composante sédative prédomine, tandis qu’à ≥15 mg, c’est la vigilance qui prédomine [7]. Dans le plasma sanguin, le THC est principalement lié aux protéines. L’élimination plasmatique se développe en plusieurs phases : deux à trois plus courtes (de quelques minutes à quelques heures) et une longue terminale. La demi-vie terminale est estimée à 21 heures en moyenne. Après cinq jours, environ 80% à 90% du THC est excrété sous forme de métabolites, environ deux tiers dans les selles et un cinquième dans l’urine [8].
Il n’existe pas de données cinétiques spécifiques pour la grossesse. Le passage placentaire est rapide, les concentrations sériques fœtales dépassent les concentrations maternelles [9]. La quantité absorbée par le lait maternel par tétée chez l’enfant correspond à environ 0,8% de la quantité absorbée par la mère [10]. La détection chez la mère se fait dans l’urine, le sérum (de plusieurs jours à un mois) et les cheveux (de plusieurs mois à plusieurs années) ; la détection chez le nouveau-né se fait dans le méconium (deuxième et troisième trimestres) ou dans les cheveux (troisième trimestre).
Effets du THC en cas d’usage chronique
- Maladies respiratoires et circulatoires chroniques dues à des niveaux élevés de monoxyde de carbone (environ cinq fois plus élevés qu’après une cigarette de tabac pur). [11]
- Changements psychiques : Sédation, euphorie, perte de contact avec la réalité, anxiété ; altération du caractère [12]; à long terme : paranoïa, hallucinations, psychose
- Performances cognitives limitées [13,14]
- Perte de contrôle des impulsions [15]
- Perte de coordination motrice
- Activation du système nerveux sympathique : vasoconstriction, bronchodilatation, augmentation de la fréquence cardiaque et de la lipolyse.
- Faible potentiel de dépendance en raison du développement de la tolérance, drogue d’accès à l’héroïne !
- Composantes sociales : Chômage plus élevé [13,14,16], moins bonne contraception [17]
Connaissances relatives à l’allaitement
Environ 40 à 80% des mères continuent à consommer après la naissance. Un enfant allaité absorbe environ 0,8% de la dose maternelle [10], cette dose est jusqu’à huit fois plus élevée chez les consommatrices chroniques [27]. Le cannabis inhibe la production de lait (la prolactine diminue) [28].
Les recommandations pour l’allaitement varient. Aux États-Unis, par exemple, les recommandations sont très différentes. L’AAP (American Academy of Pediatrics) déconseille l’allaitement, l’Academy of Breastfeeding autorise l’allaitement [31], le centre de toxicomanie de Baltimore lance un avertissement sévère [32]. En Suisse, il n’existe pas de recommandations au niveau national. L’éducation des femmes qui viennent d’accoucher est une mesure importante. L’allaitement est autorisé en Suisse dans le cas d’une consommation légère sans consommation associée. L’allaitement est contre-indiqué en cas de forte consommation de cannabis en raison de la réduction de l’attention de la mère envers l’enfant et de la sédation de l’enfant (SIDS) (recommandations de l’Hôpital universitaire pour enfants des deux Bâle UKBB).
En ce qui concerne les conséquences pour le nourrisson allaité, les données empiriques sont plutôt limitées. Il existe des preuves de retard de développement moteur chez les nourrissons âgés d’un an [29], de difficulté à boire, de sédation en cas de consommation régulière et importante par la mère [30], ainsi que de syndrome de mort subite du nourrisson (SMSN).
Messages Take-Home
- La consommation de cannabis pendant la grossesse est associée à des problèmes importants pour la mère et l’enfant. Des données sûres sur les effets nocifs sur la mère ou sur le déroulement de la grossesse et sur le fœtus servent de guide pour le diagnostic étendu des malformations, qui est indiqué dans tous les cas.
- Le fait que le cannabis soit rarement la seule substance consommée, mais qu’il s’agisse le plus souvent d’une consommation mixte, constitue probablement un facteur aggravant. Outre tous les effets potentiels, la prise en charge d’une femme enceinte consommant des drogues ne doit pas non plus ignorer que l’état général de la femme enceinte est souvent réduit.
- Les femmes enceintes consommant des drogues nécessitent donc un suivi et des conseils intensifs de la part des obstétriciens, généralement en collaboration avec d’autres disciplines médicales, y compris la psychiatrie sociale.
Littérature :
- Garcia GL, et al. : Fixation des récepteurs cannabinoïdes et niveaux d’ARNm dans plusieurs régions du cerveau de rats adultes mâles et femelles exposés périnatalement au delta9-tétrahydrocannabinol. Drug Alcohol Depend 1999 ; 55 : 127-136.
- Warner TD, Roussos-Ross D, Behnke M : It’s not your mother’s marijuana : effects on maternal-fetal health and the developing child. Clin Perinatol 2014 ; 41 : 877-894.
- Psychoyos D, Vinod KY : Marijuana, Spice “herbal high”, et développement neuronal précoce : implications pour le rescheduling et la légalisation. Drug Test Anal 2013 ; 5 : 27-45.
- Fankhauser M : Le haschisch comme médicament. L’importance du Cannabis sativa dans la médecine occidentale. Société suisse d’histoire de la pharmacie (SGGP/SSHP), Langnau : 2002, ISBN 3-9520758-9-2.
- Metz TD, Stickrath EH : Marijuana use in pregnancy and lactation : a review of the evidence. Am J Obstet Gynecol 2015 ; 213 : 761-778.
- Gustafson RA, et al : Pharmacocinétique urinaire du 11-nor-9-carboxy-delta9-tétrahydrocannabinol après administration orale contrôlée de delta9-tétrahydrocannabinol. J Anal Toxicol 2004 ; 28 : 160-167.
- Chiang CN, Rapaka RS : Pharmacokinetics and Disposition of Cannabinoids. NIDA Res Monogr 1987 ; 79 : 173-188.
- Heuberger JA, et al : Population pharmacokinetic model of THC integrates oral, intravenous, and pulmonary dosing and characterizes short- and long-term pharmacokinetics. Clin Pharmacokinet 2015 ; 54 : 209-219.
- Bailey JR, et al : JrFetal disposition of delta 9-tetrahydrocannabinol (THC) during late pregnancy in the rhesus monkey. Toxicol Appl Pharmacol 1987 ; 90 (2) : 315-321.
- Djulus J, Moretti M, Koren G : Marijuana use and breastfeeding. Can Fam Physician 2005 ; 51 (3) : 349-350.
- Macleod J, et al. : Cannabis, tabagisme, et fonction pulmonaire : une étude observationnelle transversale dans une population de pratique générale. Br J Gen Pract 2015 ; 65 : e89-95.
- Gilman JM, et al : L’usage de cannabis est quantitativement associé à des anomalies du noyau accumbens et de l’amygdale chez les jeunes utilisateurs récréatifs adultes. J Neurosci 2014 ; 34 (16) : 5529-5538.
- Auer R, et al : Association between lifetime marijuana use and cognitive function in middle age : The coronary artery risk development in young adults (CARDIA) Study. JAMA Intern Med 2016 ; 176 (3) : 352-361.
- Pedersen W, Skardhamar T : Cannabis and crime : findings from a longitudinal study. Addiction 2010 ; 105 (1) : 109-118.
- Ansell EB, et al. : Effets de la consommation de marijuana sur l’impulsivité et l’hostilité dans la vie quotidienne. Drug Alcohol Depend 2015 ; 148 : 136-142.
- Meier MH, et al : Les consommateurs de cannabis persistants présentent un déclin neuropsychologique de l’enfance à la quarantaine. Proc Natl Acad Sci U S A 2012 ; 109(40) : E2657-64.
- Morrison LF, et al : Facteurs de protection, indicateurs de risque, et cohérence contraceptive chez les femmes de l’université. J Obstet Gynecol Neonatal Nurs 2016 ; 45 (2) : 155-165.
- National Institute on Drug Abuse (NIH). Marjuana. www.drugabuse.gov/drugs-abuse/marijuana, dernière consultation 18.10.2018
- Centre européen de surveillance des drogues et des toxicomanies. Rapport européen sur les drogues 2017 : Tendances et évolutions. www.emcdda.europa.eu/publications/edr/trends-developments/2017_en, dernière consultation 18.10.2018
- Abus de substances et administration des services de santé mentale. Résultats de l’enquête nationale 2013 sur la consommation de drogues et la santé : résumé des conclusions nationales. www.samhsa.gov/data/sites/default/files/NSDUHresultsPDFWHTML2013/Web/NSDUHresults2013.pdf, dernière consultation 18.10.2018
- Grob A, Lemola S : Dépistage de la consommation de substances dans le cadre des soins prénatals. Étude réalisée pour le compte de l’Office fédéral de la santé publique (OFSP) en 2008.
- Murthy NVA, Melville GN, Wynter HH : Réponses contractiles du muscle lisse utérin à l’acétylcholine et à l’extrait de marijuana. Int J Gynaecol Obstet 1983 ; 21 (3) : 223-226.
- Fried PA : The Ottawa Prenatal Prospective Study (OPPS) : méthodological issues and findings – it’s easy to throw the baby out with the bath water. Life Sci 1995 ; 56 (23-24) : 2159-2168.
- Goldschmidt L, et al : Initiation précoce à la marijuana : le lien entre l’exposition prénatale à la marijuana, les comportements de la petite enfance, et les rôles négatifs à l’âge adulte. Neurotoxicol Teratol 2016 ; 58 : 40-45.
- Klonoff-Cohen H, Lam-Kruglick P : Maternal and paternal recreational drug use and sudden infant death syndrome. Arch Pediatr Adolesc Med 2001 ; 155 (7) : 765-770.
- de Moraes Barros MC, et al : L’exposition à la marijuana pendant la grossesse altère le neurocomportement au début de la période néonatale. J Pediatr 2006 ; 149 (6) : 781-787.
- Perez-Reyes M, Wall ME : Présence de delta9-tétrahydrocannabinol dans le lait humain. N Engl J Med 1982 ; 307 (13) : 819-820.
- Murphy LL, et al : Fonction des récepteurs cannabinoïdes dans la régulation neuroendocrinienne de la sécrétion hormonale. Neurobiol Dis 1998 ; 5 : 432-446.
- Astley SJ, Little RE : Maternal marijuana use during lactation and infant development at one year. Neurotoxicol Teratol 1990 ; 12 (2) : 161-168.
- Liston J : Breastfeeding and the use of recreational drugs–alcohol, caffeine, nicotine and marijuana. Breastfeed Rev 1998 ; 6 (2) : 27-30.
- Reece-Stremtan S, Marinelli KA : ABM clinical protocol #21 : guidelines for breastfeeding and substance use or substance use disorder, revised 2015. Breastfeed Med 2015 ; 10(3) : 135-141.
- Jansson LM, Bunik M, Bogen DL : Lactation and the marijuana-using mother. Breastfeed Med 2015 ; 10 (6) : 342-343.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(11) : 23-25