Jusqu’à présent, les tests moléculaires dans le cancer du poumon non à petites cellules (NSCLC) sont principalement réservés aux patients de stade IV. L’introduction de thérapies ciblées à des stades tumoraux plus précoces pourrait toutefois bientôt changer la donne – une grande opportunité, mais aussi de nombreux défis pour la pratique clinique quotidienne.
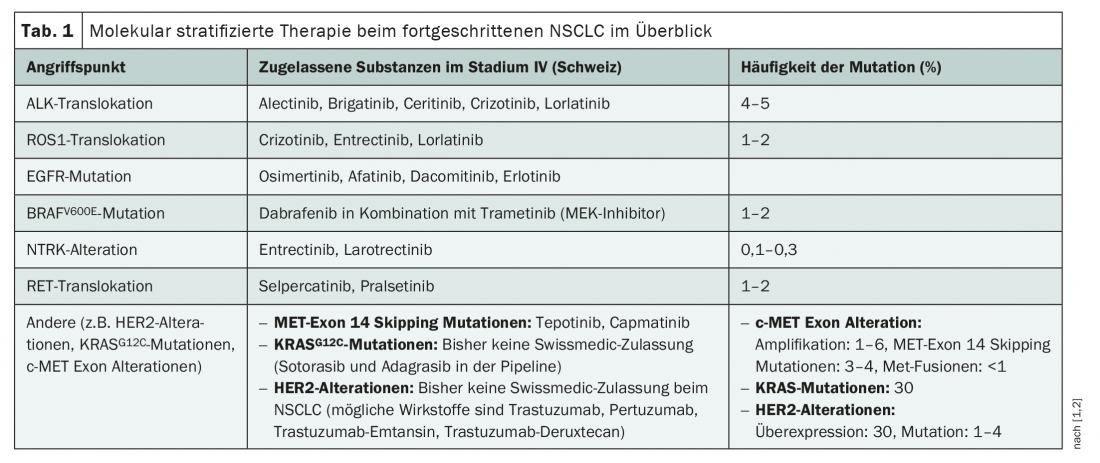
Il existe déjà de nombreuses possibilités de traitement ciblé du NSCLC avec des thérapies qui ciblent spécifiquement ROS1, ALK, EGFR, BRAF, mais aussi TRK et RET (tab. 1). Cependant, à l’exception de l’osimertinib, un inhibiteur de l’EGFR, ils ne sont autorisés en Suisse que pour le traitement des tumeurs localement avancées et métastatiques [1]. En conséquence, le diagnostic des mutations pertinentes pour le traitement n’est largement recommandé qu’au stade IV, avant le début d’un traitement de première ligne [2]. Dans tous les cas, les translocations ALK, les mutations BRAFV600E, les mutations des exons 18-21 de l’EGFR, les fusions NTRK, les translocations RET et les translocations ROS1 doivent être prises en compte [2] – car il existe des traitements approuvés pour ces modifications. Cependant, la thérapie ciblée du NSCLC évolue rapidement, et avec elle les tests moléculaires. D’une part, celle-ci pourrait s’enrichir de nouvelles cibles dans un avenir proche, car plusieurs nouvelles substances sont dans le pipeline. D’autre part, les médicaments oncologiques ciblés sont de plus en plus testés pour une utilisation néoadjuvante et adjuvante à des stades tumoraux plus précoces – avec succès, comme le prouve la récente autorisation de l’osimertinib dans le cadre d’un traitement adjuvant. La conséquence logique est qu’une classification moléculaire des tumeurs pourrait être utile dès les tumeurs de stade I-III.
D’autres points d’attaque en ligne de mire
Actuellement, de nombreuses mutations de Driver sont sous les feux de la rampe, en plus des mutations connues. Ainsi, plusieurs molécules ciblées, visant notamment HER2 ou KRAS, pourraient être prochainement autorisées. Ce n’est qu’en avril, respectivement en juin de cette année, que les inhibiteurs MET hautement spécifiques capmatinib et tepotinib ont été mis sur le marché suisse pour le traitement du NSCLC métastatique avec une mutation de l’exon 14 du récepteur de la tyrosine kinase MET [1]. Cette altération génétique touche tout de même 3 à 4 % des patients atteints de NSCLC et est associée à un pronostic défavorable [2].
Dans l’étude pivot VISION, qui a porté sur 152 patients pour la plupart prétraités et porteurs d’une mutation du gène MET exon-14 skipping, le tepotinib a entraîné un taux de réponse objective de 44,7% avec une survie sans progression (PFS) médiane de 8,9 mois [1]. Pour le capmatinib, le taux de réponse objective dans l’étude d’homologation GEOMETRY-mono-1 était même de 67,9% et la PFS médiane de 9,69 mois. Des données supplémentaires sur la survie globale et la comparaison de l’efficacité avec le traitement standard par immunochimiothérapie sont attendues. Ce qui est d’ores et déjà certain, c’est qu’un test de dépistage des mutations de l’exon-14 de MET Skipping élargira probablement le standard de diagnostic à l’avenir.
Les mutations KRAS et les aberrations HER2 pourraient également bientôt être ajoutées au diagnostic moléculaire du NSCLC. Aucun traitement spécifique n’a encore été autorisé en Suisse pour ces cibles, mais les choses bougent dans le pipeline. Ainsi, le sotorasib et l’adagrasib ont été les premiers inhibiteurs de KRASG12C à être développés et sont actuellement en phase d’essais cliniques. Une demande d’autorisation de mise sur le marché dans l’UE pour le sotorasib a été déposée et est attendue cette année, tandis que l’agence américaine des médicaments (FDA) a déjà donné son approbation préliminaire pour le traitement des patients prétraités avec la mutation KRASG12C [3,4]. Environ 13% des patients atteints de NSCLC pourraient bénéficier d’une mise sur le marché – c’est la fréquence de la mutation KRASG12C [3]. L’étude de phase II CodeBreak 100 a montré un taux de réponse de 37,1% au sotorasib chez 124 patients prétraités avec une mutation KRASG12C, avec une PFS médiane de 6,8 mois et un OS médian de 12,5 mois [5]. Contrairement au KRAS, il existe déjà des agents tels que le trastuzumab, le pertuzumab et les conjugués anticorps-médicament trastuzumab emtansine et trastuzumab deruxtecan pour cibler HER2. Bien que leur utilisation soit étudiée dans quelques études cliniques sur le NSCLC, il n’existe à ce jour aucune comparaison directe avec l’immunochimiothérapie et aucune autorisation de Swissmedic pour le NSCLC [1,2].
Thérapie adjuvante et néoadjuvante en mutation
Outre l’élargissement de la caractérisation moléculaire du NSCLC, son importance dans les stades tumoraux plus précoces pourrait également augmenter. L’osimertinib ouvre le bal. Ainsi, l’inhibiteur de l’EGFR a été autorisé cette année en Suisse pour le traitement adjuvant des patients atteints de NSCLC non épidermoïde avec délétion de l’exon 19 de l’EGFR ou mutation de substitution de l’exon 21 (L858R) après résection complète de la tumeur [1]. L’étude ADAURA, dans laquelle un traitement adjuvant de trois ans dans les stades II et IIIA après une résection R0 a entraîné une amélioration significative de la survie sans maladie par rapport au placebo (HR 0,17 ; p<0,001) [2], a servi de base à cette étude. La plupart des participants à l’étude ont également reçu une chimiothérapie adjuvante. La nouvelle option de traitement ciblé adjuvant représente un espoir pour les patients atteints de NSCLC avec mutation de l’EGFR – et nécessite une sélection appropriée des patients.
Il est probable que d’autres agents ciblés soient approuvés dans le cadre d’un traitement adjuvant et néoadjuvant. Il est donc nécessaire de mettre en place des stratégies de tests moléculaires équitables et cohérentes. Alors que de nombreuses lignes directrices n’incluent pas encore de recommandation pour l’analyse moléculaire dans les stades tumoraux I-III, les lignes directrices du National Comprehensive Cancer Net works (NCCN) et le Asian Thoracic Oncology Research Group, les Canadian Consensus Recommendations, les Chinese guidelines for diagnosis and treatment of primary lung cancer et le consensus de la Society for Translational Medicine recommandent au moins un test EGFR. Cela a du sens non seulement au vu de la nouvelle option thérapeutique, mais aussi parce que les mutations de l’EGFR sont des mutations dites tronquées : Elles sont présentes dès le début et leur prévalence ne varie guère d’un stade à l’autre. Outre les inhibiteurs de l’EGFR, des inhibiteurs de l’ALK tels que l’alectinib sont actuellement à l’essai dans le traitement néoadjuvant, adjuvant et d’entretien du NSCLC. Les guidelines seront toujours un peu en retard sur ces développements – et leur mise en œuvre dans la pratique clinique quotidienne prendra à nouveau un certain temps. Il est donc d’autant plus important d’évaluer chaque patient individuellement et, compte tenu des nombreuses nouvelles possibilités, de penser au-delà des structures figées.
Source : Aggarwal C, et al. : Molecular testing in stage I-III non-small cell lung cancer : Approaches and challenges. Cancer du poumon. 2021 ; 162 : 42-53.
Littérature :
- Information sur les médicaments de Swissmedic : www.swissmedicinfo.ch (dernier accès le 25.11.2021).
- Griesinger F, et al. : Lignes directrices Onkopedia : Cancer du poumon, non à petites cellules (NSCLC). Mise à jour juillet 2021. www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html (dernier accès le 25.11.2021).
- Whitlock Burton K : La FDA approuve le sotorasib en tant que première thérapie ciblée pour le NSCLC avec mutations KRAS G12C. 03.06.2021. www.univadis.de (dernier accès le 25.11.2021).
- DGHO : Demande de modèle NUB Sotorasib 2021/2022. www.dgho.de (dernier accès le 25.11.2021).
- Skoulidis F, et al : Sotorasib pour les cancers du poumon avec mutation KRAS p.G12C. New England Journal of Medicine. 2021 ; 384(25) : 2371-2381.
InFo ONCOLOGIE & HÉMATOLOGIE