La distinction entre la néphropathie à IgA et la néphrite lupique chez les patients atteints de lupus érythémateux disséminé (LED) a des implications pronostiques et thérapeutiques importantes.
Des médecins chinois ont décrit un cas de lupus érythémateux systémique avec néphropathie à IgA et glomérulonéphrite aiguë progressive et ont expliqué la relation
entre les deux.
En raison d’une perte d’appétit et d’une fatigue qui duraient depuis une semaine, un homme de 72 ans s’est présenté à l’équipe du Dr Zhifeng Jiang, Hôpital Xiaogan, Université de Wuhan, Chine [1]. Le patient souffrait d’hypertension depuis des années, mais n’avait pas d’autres problèmes de santé chroniques et ne prenait pas régulièrement de médicaments. Il n’y avait pas de phénomène de Raynaud, pas de gonflement des doigts, pas d’éruption cutanée, pas de douleurs articulaires, pas de toux ni de respiration sifflante. Sa pression artérielle était de 138/94 mmHg et il avait des œdèmes bilatéraux dans les membres inférieurs. La peau du visage n’était pas endommagée, les doigts des deux mains n’étaient pas enflés et les articulations n’étaient pas déformées ou douloureuses. Les tests de laboratoire ont révélé des anticorps antinucléaires (positifs), des leucocytes, des globules rouges, une thrombocytopénie, une diminution du complément C3, un dysfonctionnement rénal et une positivité anti-SM. Les résultats de l’échographie rénale ont révélé une augmentation de l’échogénicité des deux parenchymes rénaux et la tomodensitométrie thoracique a montré un petit épanchement pleural.
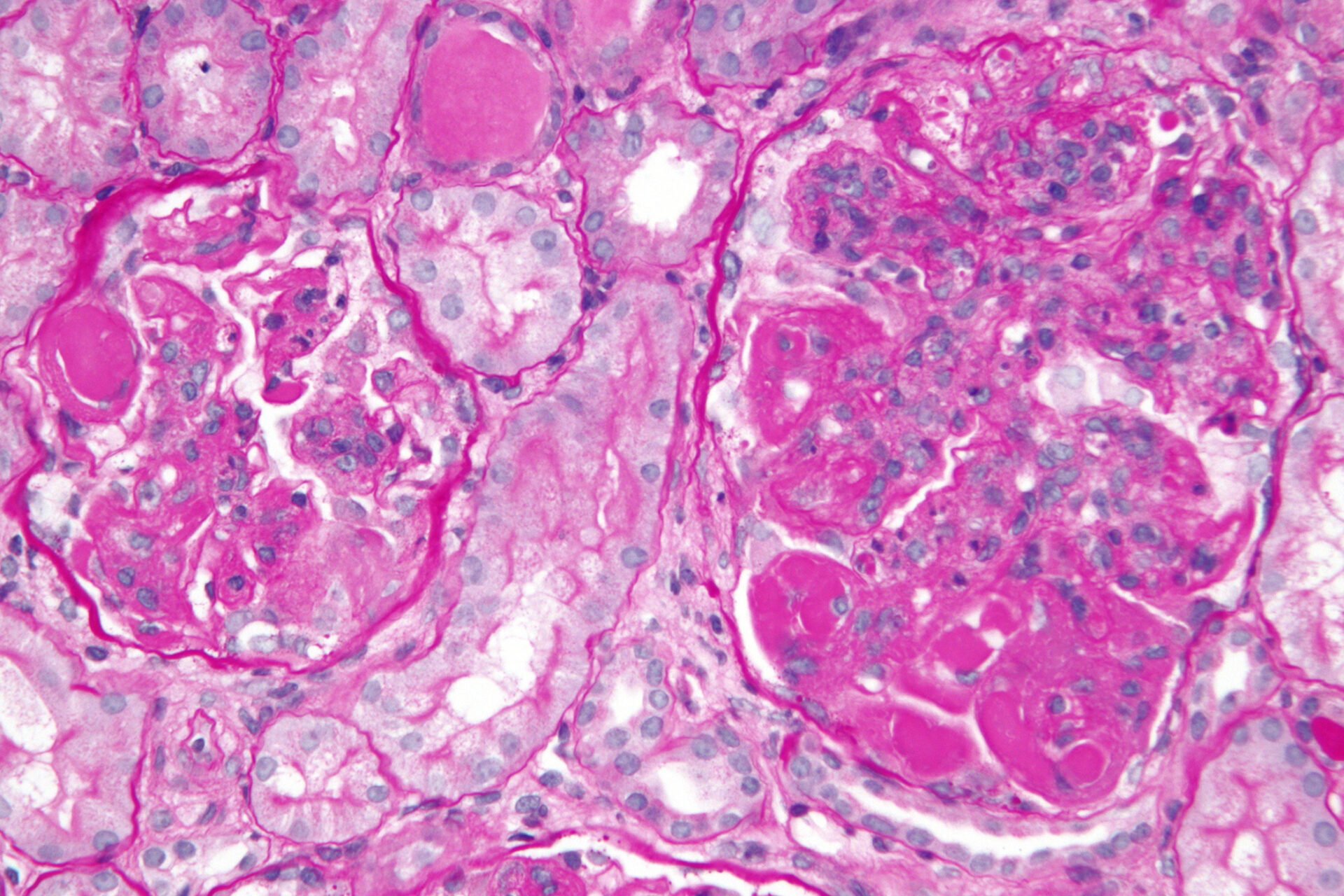
Après l’admission, la fonction rénale du patient a continué à se détériorer et l’excrétion quotidienne d’urine était inférieure à 50 ml/jour. Deux jours plus tard, la créatinine sérique est montée à 1108 μmol/l, et le troisième jour après l’admission, un cathéter de dialyse temporaire a été placé dans la veine jugulaire interne droite et une hémodialyse a été effectuée. Les résultats d’une biopsie rénale (après trois dialyses) ont montré un grand nombre de croissants cellulaires et, bien qu’une grande quantité de dépôts d’IgA ait été trouvée dans la zone mésangiale sous immunofluorescence, il n’y avait pas de dépôts denses en électrons sous l’épithélium, la membrane basale et l’endothélium. En microscopie électronique, des dépôts denses en électrons ont été observés dans la région du mésangium (Fig. 1A-D).
Le LED et la néphropathie à IgA peuvent coexister
Les médecins ont diagnostiqué un LED avec néphropathie à IgA ainsi qu’une glomérulonéphrite aiguë.
Le dixième jour après l’admission, un traitement pulsé à haute dose de glucocorticoïdes (succinate de méthylprednisolone sodique 500 mg pendant 3 jours) et des pulsations de cyclophosphamide (600 mg une fois par jour pendant 2 jours) ont été administrés.
Ensuite, le succinate de méthylprednisolone sodique 60 mg, une fois par jour, a été administré.
L’hydroxychloroquine ou les inhibiteurs de l’enzyme de conversion de l’angiotensine n’ont pas été utilisés.
Après environ une semaine, une analyse sanguine de routine a montré que les plaquettes étaient de 140 × 109/l, l’hémoglobine et le complément C3 de 0,14 g/l.
Lors du suivi à 3 mois, le patient présentait toujours une anurie, la fonction rénale ne s’était pas rétablie et il a continué à être dialysé.
Par ailleurs, la fonction rénale ne s’est pas rétablie après l’administration de glucocorticoïdes et d’une thérapie pulsée à base de cyclophosphamide, ce qui montre que le lupus érythémateux systémique et la néphropathie à IgA peuvent coexister.
Le LED avec néphropathie à IgA et néphrite en croissant est rare, le lien entre les deux maladies n’est pas clair et il n’existe pas de recommandations de traitement claires pour ces patients, écrivent les auteurs chinois.
Plusieurs cas de néphropathie à IgA confirmée histologiquement chez des patients atteints de lupus érythémateux disséminé et de néphropathie à IgA prouvée par biopsie rénale chez des patients atteints de lupus inactif ont été rapportés.
Les poussées de néphropathie à IgA dues à des lésions inflammatoires systémiques sont une caractéristique fréquente chez ces patients.
La plupart des personnes atteintes présentent des taux de complément normaux, mais dans certains cas, on observe des taux réduits, probablement en raison d’une activité lupique extrarénale.
Le Dr. Jiang et ses collègues soulignent que chez leur patient, après un traitement de choc à base de glucocorticoïdes et de cyclophosphamide à haute dose, l’augmentation de la concentration en C3 du complément et du nombre de plaquettes étaye le diagnostic de lupus érythémateux disséminé, mais que l’absence d’amélioration de la fonction rénale du patient plaide en faveur de l’indépendance de la néphropathie à IgA et du LED ; Parallèlement, la fonction rénale du patient s’est rapidement détériorée et plusieurs croissants cellulaires sont apparus au microscope optique, ce qui indique que le patient a fait une poussée aiguë et a évolué vers une insuffisance rénale au stade terminal.
Il n’existe actuellement aucun plan de traitement recommandé pour une néphropathie à IgA associée à une glomérulonéphrite aiguë progressive. L’absence de succès après un traitement de choc à base de glucocorticoïdes et de cyclophosphamide à haute dose dans ce cas suggère que ces patients ont un mauvais pronostic sous un traitement classique par glucocorticoïdes et immunosuppresseurs. Le sparsentan est une nouvelle molécule non immunosuppressive unique ; il a été rapporté que le sparsentan peut réduire la protéinurie et retarder la détérioration de la fonction rénale chez les patients atteints de néphropathie à IgA associée à la formation de corps falciformes. Cependant, l’utilisation dans la néphropathie à IgA avec néoglomérulonéphrite aiguë n’a pas été rapportée ; dans de tels cas, le sparsentan pourrait être applicable à l’avenir, bien que des études cliniques supplémentaires soient nécessaires.
En cas d’apparition simultanée d’un lupus érythémateux disséminé et d’une néphropathie à IgA, il n’y a pas de consensus pour savoir si la néphropathie à IgA et le LED sont indépendants ou non. Il est possible qu’à l’avenir, d’autres cas et davantage de biopsies permettent de clarifier ce point, constatent les auteurs. En outre, ils concluent qu’un lupus érythémateux systémique avec des lésions rénales n’est pas nécessairement une néphrite lupique et que le diagnostic de néphrite lupique doit être confirmé par une biopsie.
Littérature :
- Jiang Z, Feng A : Un rapport de cas de lupus érythémateux disséminé avec néphropathie à IgA et néphrite crescendo. AIM Clinical Cases 2023 ; 2 : e230157 ; doi : 10.7326/aimcc.2023.0157.
InFo RHEUMATOLOGIE 2024 ; 6(1) : 24-25
Photo de couverture : @Nephron, wikimedia