Le méthylphénidate est utilisé depuis des décennies dans le traitement du TDAH. Il existe différentes hypothèses sur la manière exacte dont ce psychostimulant déploie ses effets. L’une d’entre elles porte sur le fait que le méthylphénidate affecte la neurotransmission dopaminergique dans le noyau accumbens et les réseaux neuronaux associés. Pour en savoir plus, une équipe de chercheurs a mené une étude d’imagerie.
Le méthylphénidate (MPH) est la substance active de choix pour le traitement du syndrome d’hyperactivité avec déficit de l’attention (TDAH) cliniquement pertinent [1]. Ritalin® est le nom de marque de la préparation MPH la plus ancienne et la plus répandue. Les autres médicaments utilisés en Suisse qui contiennent également la substance active MPH sont Medikinet MR®, Equasym®, Focalin® et Concerta® [2]. On distingue les préparations à courte et à longue durée d’action. Au début du traitement, on utilise souvent une préparation de MPH à courte durée d’action, par exemple le comprimé de Ritaline® de 10 mg. Le MPH sous cette forme est rapidement absorbé par l’organisme et commence à agir après environ 30 minutes. Après 3-4 heures, l’effet s’estompe rapidement. Il est également possible de délivrer des stimulants sous une forme à longue durée d’action. Dans ce cas, le principe actif est libéré du comprimé avec un certain retard et l’effet est maintenu pendant 7 à 14 heures maximum, selon la préparation. Les données relatives à la durée d’action ne sont toutefois qu’indicatives et le traitement peut être adapté au mieux aux besoins de l’enfant [3].
Examen IRM en crossover design
Des chercheurs ont mené une étude croisée randomisée, contrôlée par placebo et en double aveugle à l’hôpital universitaire de Fukui (Japon) [4]. L’âge moyen des 27 enfants atteints de TDAH était de 10,6 ans (écart-type 1,8 ; fourchette d’âge : 7,3-15,5 ans). Chez les 49 témoins sans TDAH, l’âge moyen était de 11,1 ans (écart-type : 2,3 ; fourchette d’âge : 6,1-15,6 ans). Les critères d’inclusion sont indiqués dans l’encadré. Les enfants atteints de TDAH ont été scannés deux fois par imagerie par résonance magnétique fonctionnelle au repos dans des conditions de méthylphénidate et de placebo. Au cours du premier rendez-vous, ils ont reçu du MPH (1,0 ± 0,1 mg/kg) ou un placebo (lactose) à libération osmotique (OROS), comme dans les études précédentes en double aveugle. Cinq à huit heures après l’administration, lorsque la concentration de MPH dans le sang est maximale, les enfants ont subi un examen IRMf au repos et ont effectué un test de performance continu standardisé en dehors du scanner IRM. Lors du deuxième rendez-vous (dans un délai de 1 à 6 semaines après le premier rendez-vous), les enfants atteints de TDAH ont subi un scanner IRMf au repos et ont effectué le test de performance après avoir pris le deuxième médicament : les enfants qui avaient pris OROS-MPH lors du premier rendez-vous ont reçu le placebo lors du deuxième rendez-vous en double aveugle et vice versa.
Le groupe de contrôle, c’est-à-dire les participants à l’étude ne souffrant pas de TDAH, a passé le même scanner IRMf au repos une fois sans OROS-MPH ou placebo.

Il a été démontré que le méthylphénidate module l’activité neuronale
Il s’est avéré que le méthylphénidate (MPH) augmentait l’activité neuronale spontanée dans le noyau accumbens et dans les réseaux de mode salienz et de mode par défaut (“Default Mode”) [4].
- Dans les tests de performance, le MPH a significativement réduit les erreurs d’omission, le temps de réaction moyen et la variabilité de réponse intra-individuelle (IIRV, Intraindividual response variability) dans le groupe TDAH (p<0,001 dans les deux cas).
- La modulation de l’activité neuronale spontanée induite par le méthylphénidate dans le réseau “mode par défaut” a prédit l’effet du traitement en termes de variabilité de la réponse intra-individuelle (IIRV) (r=-0,46, p=0,016).
- En ce qui concerne les effets du MPH sur l’activité neuronale spontanée dans le noyau accumbens, l’amplitude des fluctuations à basse fréquence (ALFF) dans le noyau accumbens droit était significativement plus élevée dans la condition TDAH-MPH que dans la condition TDAH-placebo (p<0,05, corrigé par Bonferroni, d=0,55 de Cohen).
- L’ALFF était significativement plus élevée dans les réseaux de saillance (SN) et dans le réseau de “mode par défaut” (DMN) dans la condition TDAH-MPH que dans la condition TDAH-placebo (SN : p<0,05, Cohen’s d=0,57 ; DMN : p<0,01, Cohen’s d=0,66 ; dans les deux cas, Bonferroni corrigé). Il n’y avait pas de différence significative dans le réseau frontopariétal gauche et droit (p>0,05). Une analyse de régression linéaire multiple a montré que seule la modulation MPH du modèle de similarité ALFF au sein du réseau “mode par défaut” était significativement associée aux effets des médicaments sur la variabilité intra-individuelle de la réponse (tableau 1). Cela indique qu’il s’agit d’un mécanisme d’action neurobiologique crucial.
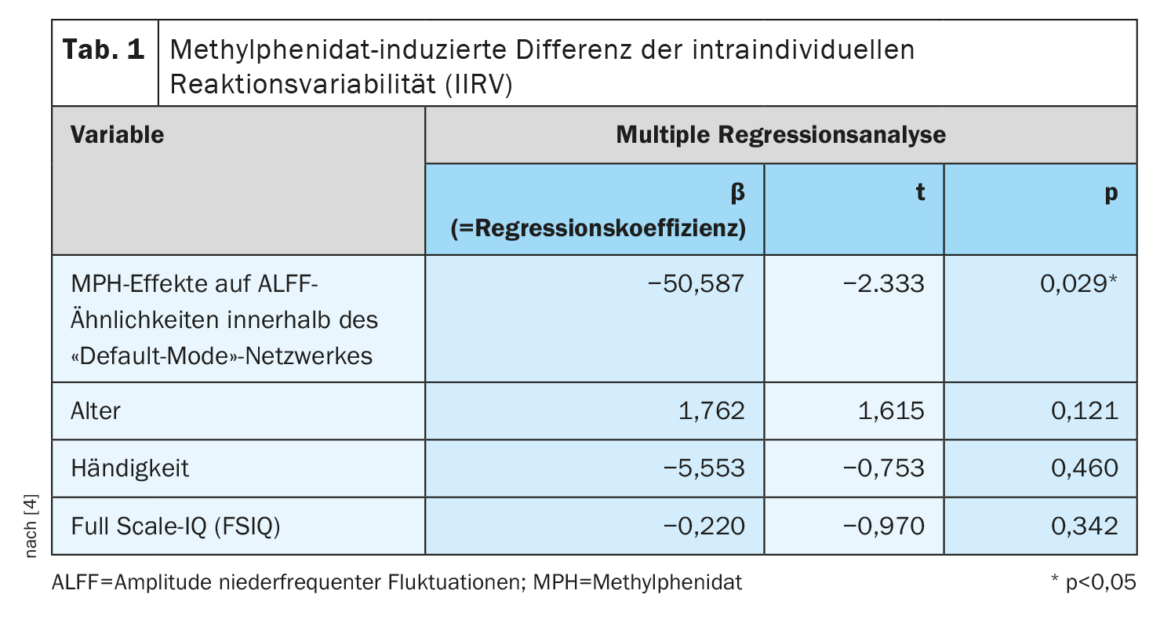
Ces résultats élargissent la compréhension actuelle des mécanismes neurobiologiques qui sous-tendent le traitement MPH chez les enfants atteints de TDAH et, selon les auteurs de l’étude, des biomarqueurs cliniquement utiles pourraient en être dérivés à l’avenir pour évaluer le succès du traitement.
Littérature :
- Praxis Suchtmedizin Schweiz, www.praxis-suchtmedizin.ch/praxis-suchtmedizin/index.php/de/medikamente/einleitung-mh, (dernière consultation 10.02.2023)
- Swissmedic: Arzneimittelinformation, www.swissmedicinfo.ch, (dernière consultation 10.02.2023)
- «Die medikamentöse Behandlung von Kindern und Jugendlichen mit einer Aufmerksamkeitsdefizit-Hyperaktivitätsstörung ADHS», März 2022,
www.pukzh.ch/sites/default/assets/File/
Informationen%20Stimulanzien%20und%20Ritalin.pdf, (dernière consultation 10.02.2023) - Mizuno Y, et al.: Methylphenidate Enhances Spontaneous Fluctuations in Reward and Cognitive Control Networks in Children With Attention-Deficit/Hyperactivity Disorder. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging, available online 23 October 2022, www.sciencedirect.com/science/article/pii/S2451902222002476, (dernière consultation 10.02.2023)
HAUSARZT PRAXIS 2023; 18(2): 24–25
InFo NEUROLOGIE & PSYCHIATRIE 2023; 21(2): 30–31