Son hétérogénéité fait que l’asthme est aujourd’hui considéré comme un terme générique plutôt que comme une maladie à part entière. Il comprend plusieurs aspects et caractéristiques qui peuvent se chevaucher, ce qui rend la prise en charge de l’asthme difficile et nécessite un phénotypage précis. Mais attention : une fois diagnostiqué, le phénotype ne doit pas rester gravé dans la pierre – il peut évoluer au cours de la vie.
Pour établir une distinction fondamentale, on se base aujourd’hui sur l’étendue de l’inflammation de type 2 et on fait la différence entre l’asthme T2 élevé et l’asthme T2 faible. Fabio L.M. Ricciardolo, Département d’asthme sévère et de maladies pulmonaires rares, Hôpital universitaire San Luigi Gonzaga, Turin, et ses collègues [1].
La classification des phénotypes d’asthme en T2-high et T2-low est actuellement basée sur la prédisposition atopique et au moins un des biomarqueurs suivants : immunoglobulines E sériques élevées (IgE), taux élevé de monoxyde d’azote exhalé fractionné (FeNO) et éosinophilie dans le sang (B-EOS) et/ou les crachats (S-EOS).
T2-high-asthma
Les phénotypes T2-high ont une réponse immuno-inflammatoire commune, alimentée par les lymphocytes Th2 (immunité adaptative) et les ILC (cellules lymphoïdes innées) du groupe 2 (ILC2, immunité innée). Les caractéristiques de l’inflammation T2 sont les cytokines T2 telles que l’IL-5, l’IL-4, l’IL-13, l’IL-9, la prostaglandine D2 (PGD2) et les éosinophiles, dont l’expression élevée peut être détectée dans les voies respiratoires (lumière ou paroi bronchique) et dans le sang périphérique des patients. En fait, le terme d’asthme éosinophile est considéré comme synonyme d’asthme T2-high, englobe les phénotypes allergiques et non allergiques et touche environ 50% des patients souffrant d’asthme sévère.
L’asthme allergique se développe après l’exposition à différents aéroallergènes qui provoquent l’activation des cellules dendritiques (DC). Les DC de la couche sous-épithéliale agissent comme des cellules présentatrices d’antigènes et peuvent reconnaître et traiter les allergènes. Une fois activées, elles entrent dans la phase dite précoce puis tardive de la réaction allergique.
En plus de l’inflammation des voies respiratoires, l’asthme aigu T2 s’accompagne de modifications structurelles des voies respiratoires (remodelage). Parmi ces changements figure la métaplasie des cellules de Becher, qui entraîne une augmentation de la production de mucus et la formation de bouchons de mucus qui en résulte. Une étude récente a montré que les bouchons de mucus étaient plus nombreux dans les voies respiratoires des patients souffrant d’asthme sévère et d’inflammation T2, les éosinophiles jouant un rôle clé dans la formation des bouchons.
Asthme allergique à début précoce
Les déclencheurs et symptômes typiques de l’asthme qui survient dans l’enfance sont les allergènes et autres stimuli environnementaux tels que les infections virales, les polluants, les oxydants et la fumée de cigarette. Elle provoque une cascade immunitaire et inflammatoire responsable d’une bronchoconstriction aiguë. Cet asthme à début précoce (early onset asthma, EOA) est généralement caractérisé par une atopie avec la présence d’IgE circulantes spécifiques des allergènes et se caractérise par ce que l’on appelle la “marche atopique”, qui consiste en une progression de la dermatite atopique vers la rhinite allergique et l’asthme.
L’EOA peut persister tout au long de la vie. Les études portant sur les déterminants de cette persistance ont mis en évidence le tabagisme maternel pendant la grossesse, les infections des voies respiratoires supérieures et inférieures, l’atopie, la respiration sifflante provoquée par les infections à rhinovirus et l’éosinophilie sanguine dans la petite enfance comme facteurs de risque de diminution de la fonction pulmonaire, d’asthme et d’asthme sévère pendant l’enfance scolarisée, l’adolescence et l’âge adulte.
Asthme non allergique à début tardif
L’asthme non allergique débute à l’âge adulte et peut être défini comme un asthme à début tardif (late onset asthma, LOA). Comme l’asthme allergique, le LOA se caractérise par une signature immunitaire et inflammatoire T2 marquée et se distingue par l’absence d’atopie et de signalisation IgE qui en résulte.
Le LOA peut se manifester à différents degrés de gravité, la forme sévère entraînant une fonction pulmonaire moins bonne, une obstruction plus importante des voies respiratoires et une éosinophilie plus élevée malgré un traitement par de fortes doses de corticostéroïdes inhalés (CSI), écrivent les auteurs. Des concentrations élevées d’ILC2 ont été trouvées dans les voies respiratoires et le sang périphérique de patients souffrant d’asthme sévère non allergique, caractérisé par une éosinophilie incontrôlée dans les crachats et une résistance aux stéroïdes, ce qui suggère un mécanisme impliquant potentiellement l’IL-33.
Asthme analgésique
L’asthme dû aux analgésiques (en anglais Aspirin-exacerbated respiratory disease, AERD) est étroitement lié aux symptômes respiratoires qui se développent rapidement après la prise d’analgésiques tels que l’acide acétylsalicylique ou un inhibiteur non stéroïdien de la cyclooxygénase-1 (COX-1). Les réactions aux AINS, l’asthme et les polypes nasaux sont des caractéristiques du syndrome (triade de Samter). Chez les adultes comme chez les enfants, l’hypersensibilité aux analgésiques peut être précédée soit par de l’asthme allergique, soit par une rhinite allergique, mais l’AERD n’est pas considérée comme une maladie allergique car elle ne produit pas d’anticorps IgE spécifiques. Environ 8 à 26% des patients atteints de SRC et de polypes nasaux ont également un DAER, tandis que la prévalence est d’environ 7% chez tous les patients asthmatiques et deux fois plus élevée chez les patients souffrant d’asthme sévère.
T2 faible asthme
L’asthme T2 faible comprend toutes les formes d’asthme sans les caractéristiques de l’asthme T2 élevé. Le profil d’inflammation des voies respiratoires permet de distinguer l’asthme neutrophile (neutrophilie des crachats avec faible éosinophilie), l’asthme mixte (forte neutrophilie des crachats et éosinophilie) et l’asthme paucigranulocytaire (faible neutrophilie des crachats et éosinophilie). L’asthme de bas grade T2 peut varier en sévérité, les phénotypes mixtes et neutrophiles étant plus susceptibles de présenter une sévérité et des taux d’exacerbation plus élevés. Il n’existe pas encore de molécules validées pour les biomarqueurs, bien que des études menées sur des échantillons de sang/voies respiratoires de patients asthmatiques montrent des résultats encourageants, selon le professeur Ricciardolo et ses collègues.
Les causes d’inflammation des voies respiratoires à neutrophiles comprennent les infections bactériennes et virales, ces dernières étant à l’origine des exacerbations de l’asthme. Une fréquence plus élevée d’exacerbations et une incidence plus élevée de SRC et d’infections virales ont été observées chez les patients présentant une inflammation des neutrophiles.
Chez les patients asthmatiques exposés à de fortes doses de CSI et/ou à un traitement à long terme par corticostéroïdes oraux (OCS), la prise de corticostéroïdes peut entraîner un phénotype non éosinophile. Cependant, des études ont montré que les patients présentant un phénotype moléculaire, y compris les patients souffrant d’asthme éosinophile sévère, étaient plus susceptibles de prendre des OCS que les patients présentant un phénotype moléculaire neutrophile. De plus, plusieurs études de biopsies bronchiques ont montré un statut réduit ou stable des neutrophiles après un traitement par corticostéroïdes.
Asthme du fumeur
La fumée de tabac peut déclencher des processus pathogéniques et conduire à un phénotype associé à un certain nombre de caractéristiques : détérioration accélérée de la fonction pulmonaire, mauvais contrôle de l’asthme, exacerbations plus fréquentes, qualité de vie réduite, taux d’hospitalisation plus élevés et risque accru de maladies concomitantes telles que le cancer. Il a été signalé que l’asthme chez les fumeurs est associé à une faible inflammation T2.
La résistance aux stéroïdes associée au tabagisme et l’exclusion des fumeurs asthmatiques de la plupart des essais cliniques constituent un défi majeur dans le traitement de ce phénotype.
Asthme induit par l’obésité
L’asthme dû à l’obésité a généralement une forme sévère, dans laquelle les patients sont souvent résistants aux stéroïdes. Les modifications des caractéristiques cliniques et fonctionnelles, telles que l’hyperréactivité des voies respiratoires (AHR), peuvent être améliorées par une perte de poids. L’obésité est un état pathologique caractérisé par une inflammation systémique impliquant des macrophages. On pense que les macrophages sont responsables de l’inflammation du tissu adipeux, ce qui entraîne la libération de TNF-α, de leptine et d’IL-6 dans la circulation sanguine. 62 % des patients asthmatiques obèses présentent de faibles taux plasmatiques d’IL-6. Une étude a montré que des niveaux élevés d’IL-6 étaient associés à un asthme sévère et à des troubles métaboliques, à la fois chez les patients obèses et non obèses.
L’asthme chez les personnes âgées
On parle d’asthme du sujet âgé lorsque la maladie se manifeste pour la première fois après l’âge de 65 ans. Ces patients ont un taux de morbidité et de mortalité plus élevé. Les raisons en sont multiples, notamment les comorbidités, la perception insuffisante des symptômes de l’asthme, le déclin cognitif potentiel et les effets néfastes de la polypharmacothérapie. Les processus de vieillissement, qui modifient la structure et la physiologie des poumons, ont également un impact sur l’asthme et son développement. Les changements liés à l’âge comprennent un rétrécissement des voies respiratoires périphériques, une dilatation alvéolaire, une rigidité accrue de la paroi thoracique, une diminution de la force des muscles respiratoires et une diminution de la fonction pulmonaire. La physiopathologie exacte de ce phénotype n’est pas claire, ce qui rend son traitement très difficile, écrivent les auteurs. Des études supplémentaires seraient nécessaires pour clarifier le lien éventuel avec la corticorésistance chez les patients asthmatiques âgés.
Asthme post-ménopausique
Dans l’enfance, l’asthme touche une plus grande proportion de garçons. Cela change à l’âge adulte, où la proportion de femmes est plus élevée. Outre les facteurs génétiques, cette évolution est également attribuée aux hormones : Des concentrations élevées d’œstrogènes et de progestérone peuvent moduler l’expression et l’activité des cellules immunitaires, des cytokines inflammatoires et des glucocorticoïdes, ce qui entraîne l’induction d’une réaction Th2 avec les éosinophiles et une augmentation du FeNO en phase prémenstruelle. Cela contribue probablement à la gravité et à l’aggravation des symptômes de l’asthme, aux exacerbations et aux hospitalisations pendant la menstruation, la périménopause et la grossesse.
Des études sur l’asthme à la ménopause ont montré un risque accru d’asthme chez les femmes minces prenant un traitement hormonal substitutif, ainsi qu’une fonction pulmonaire réduite et des symptômes d’asthme accrus chez les femmes ménopausées par rapport aux patientes préménopausées. Des recherches supplémentaires seraient nécessaires pour étudier les mécanismes internes de l’asthme post-ménopausique.
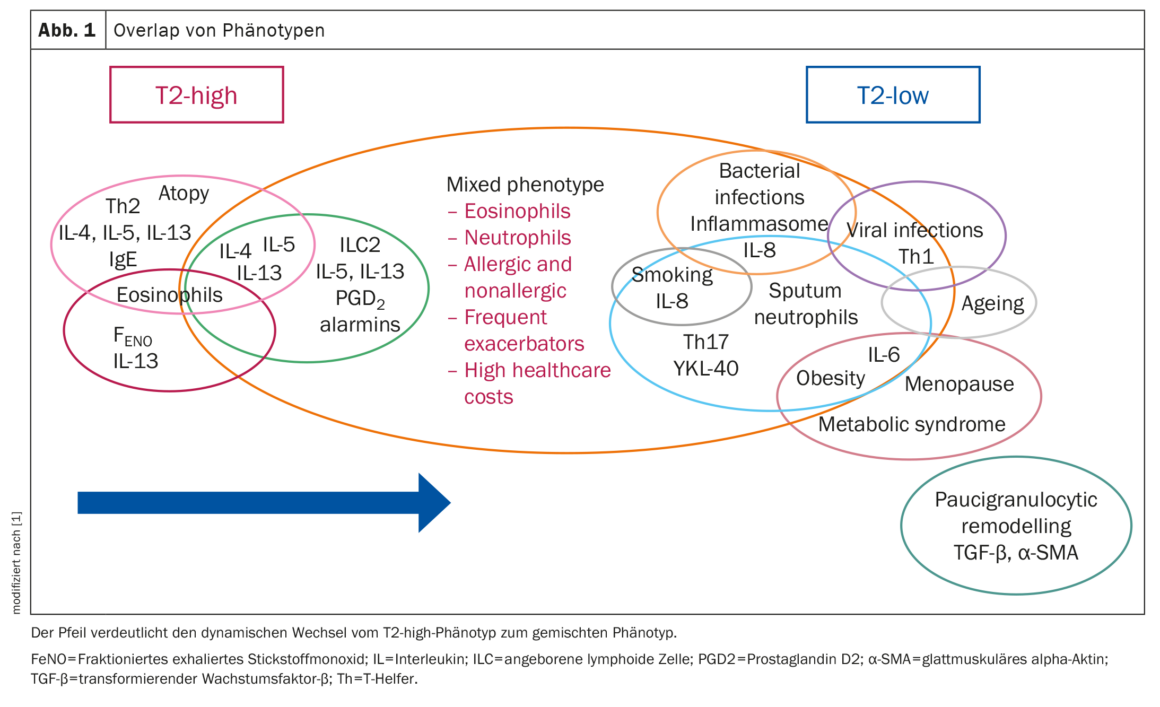
Superposition des phénotypes
L’identification du phénotype de l’asthme est essentielle pour le traitement de la maladie, expliquent le professeur Ricciardolo et al. Cependant, il peut y avoir des enchevêtrements de plusieurs voies de signalisation moléculaires et des chevauchements entre différents phénotypes, ce qui peut entraîner des résultats cliniques inattendus. Plusieurs études ont fourni des preuves d’une interaction entre des voies qui étaient jusqu’à présent considérées comme s’excluant mutuellement (figure 1).
Dans une étude, des chevauchements ont été observés chez >70% des patients, avec des combinaisons de phénotypes liés à la T2, non liés à la T2 et mixtes T2/non liés à la T2, le dernier groupe présentant les plus mauvais résultats cliniques. Des chevauchements du phénotype T2 ont été observés dans différentes combinaisons de sous-types allergiques, éosinophiles et T2-high. Le phénotype allergique était le phénotype unique le plus fréquent, mais aussi celui qui apparaissait le plus souvent en même temps que d’autres phénotypes. L’EOA persistant et les allergies étaient associés au risque le plus élevé de développer une BPCO, tandis que le LOA et les allergies étaient associés à un risque plus élevé de multimorbidité, y compris le diabète, l’obésité et les maladies cardiovasculaires.
L’asthme et les comorbidités apparentées peuvent éventuellement partager des mécanismes moléculaires, des expositions communes ou des prédispositions génétiques communes, suggèrent les auteurs. Des comorbidités (BPCO, RGO, maladies cardiovasculaires), habituellement associées à une faible signature inflammatoire T2, peuvent ainsi se développer chez des patients dont l’état T2 était initialement élevé.
Les changements et les éventuelles évolutions vers un autre phénotype peuvent entraîner un mauvais contrôle clinique, une insensibilité aux stéroïdes et une aggravation de la gravité. Lorsqu’ils définissent le phénotype de l’asthme sur la base des biomarqueurs actuels, les médecins devraient donc être plus prudents et rechercher également les chevauchements entre les différents phénotypes, en particulier chez les patients asthmatiques insensibles aux stéroïdes et difficiles à traiter, concluent les chercheurs.
Littérature :
- Ricciardolo FLM, Guida G, Bertolini F, et al : Phenotype overlap in the natural history of asthma. European Respiratory Review 2023 ; 32 : 220201 ; doi : 10.1183/16000617.0201-2022.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2024 ; 6(1) : 36-38