Les infections dues au syndrome du pied diabétique sont fréquentes, entraînent une morbidité élevée et nécessitent souvent de longues hospitalisations avec de multiples interventions chirurgicales, pouvant aller jusqu’à la perte d’un membre. L’étiologie est multifactorielle, les maladies vasculaires périphériques, la neuropathie et l’immunopathie jouant les rôles les plus importants. Le traitement nécessite une approche systématique et multidisciplinaire. Les signes cliniques classiques sont souvent absents ou n’apparaissent qu’à un stade avancé. Des prélèvements de la plaie et, si nécessaire, de l’os sont nécessaires pour commencer un traitement antimicrobien. Les interventions chirurgicales sont nécessaires pour les plaies moyennement ou gravement avancées ou en cas d’atteinte systémique. Le débridement est alors la procédure la plus importante et doit inclure tous les compartiments affectés. L’amputation et/ou la fermeture de la plaie ne doivent être effectuées que lorsque l’état du patient est stable et que la stratégie de traitement est définie. Un diagnostic précoce est très important pour limiter l’étendue des dommages tissulaires. Les soins postopératoires sont indispensables pour éviter les rechutes et les complications.
Les ulcères infectés du pied chez les patients atteints de diabète sucré sont une cause majeure de morbidité, associée à une qualité de vie réduite, à la nécessité d’un traitement spécialisé des plaies, à un traitement antimicrobien et à des interventions chirurgicales fréquentes. De même, ils sont la cause la plus fréquente d’hospitalisation liée au diabète et de perte de membres inférieurs. Dans une grande étude rétrospective de patients souffrant d’ulcères diabétiques des pieds, l’infection augmente le risque d’amputation mineure de 50% par rapport aux plaies non infectées. Environ 15% des patients diabétiques développent des ulcérations des pieds au cours de leur vie et environ deux tiers d’entre elles évoluent vers des cas compliqués d’ostéomyélite. C’est pourquoi un diagnostic précoce et un plan de traitement précis sont de la plus haute importance pour éviter la progression de l’infection et l’amputation. Dans ce court article, nous nous concentrerons sur les lignes directrices actuelles en matière de diagnostic et de traitement.
Les trois principaux facteurs de risque sont les maladies vasculaires périphériques, la neuropathie et l’immunopathie. Plus précisément, une sensibilité réduite ou totalement abolie, combinée à des traumatismes mineurs, entraîne des lésions tissulaires répétitives. Cela entraîne une infection et, en raison de la réduction de la circulation sanguine et du système immunitaire compromis, une moins bonne guérison. La physiopathologie est simple : des niveaux élevés de glucose sanguin entraînent des modifications métaboliques des nerfs (glycolisation des protéines et diminution du transport axonal), réduisent la phagocytose des leucocytes et exposent donc aux événements infectieux. C’est pourquoi une approche multidisciplinaire est toujours nécessaire et fait appel à différentes disciplines : chirurgie vasculaire, angiologie, orthopédie, chirurgie plastique, neurologie ainsi que diététique, kinésithérapie et, bien sûr, internistes et diabétologues.
Diagnostic
Le diagnostic des infections des tissus mous chez ces patients n’est pas toujours facile, car les symptômes typiques sont souvent peu prononcés ou absents : La réponse inflammatoire peut être limitée (ischémie et/ou neuropathie) et souvent la douleur est faible ou inexistante (neuropathie). Les signes systémiques apparaissent souvent tardivement et dans des cas très graves, lorsqu’un choc septique est déjà présent ou que le pronostic vital est engagé. Les signes locaux tels que l’œdème, l’échauffement et la douleur (malgré la neuropathie) font suspecter une infection. L’échantillonnage microbiologique est alors obligatoire pour confirmer le diagnostic et mettre en place un traitement. Des analyses de sang doivent toujours être effectuées (CRP, procalcitonine, leucocytes…). La sensibilité la plus élevée est souvent offerte par une hyperglycémie incontrôlée malgré le traitement.
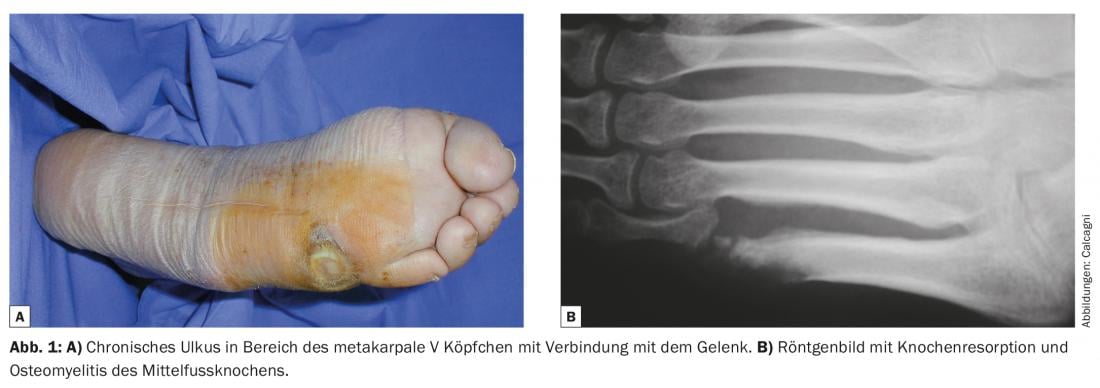
Le diagnostic complémentaire comprend un examen neurologique à la recherche d’une neuropathie et/ou d’une compression nerveuse périphérique concomitante. Dès qu’une implication osseuse est suspectée, une IRM doit être effectuée avant le début du traitement antibiotique, car une biopsie osseuse (pour culture bactérienne et histologie) est nécessaire si des signes d’ostéomyélite apparaissent. Des radiographies conventionnelles sont également nécessaires pour exclure des problèmes osseux ou articulaires aigus (fractures, luxations) ou des pathologies dégénératives (comme l’arthropathie de Charcot) (Fig. 1). Enfin, un bilan angiologique doit être réalisé pour évaluer la perfusion artérielle. Pour ce faire, il est recommandé d’utiliser des méthodes non invasives (Doppler) et, si une revascularisation périphérique est nécessaire, un diagnostic invasif (angiographie par scanner ou IRM, angiographie directe).
Une fois le diagnostic posé, la classification en degrés de gravité peut aider à planifier la stratégie de traitement. Le tableau 1 présente la classification de l’Infectious Disease Society of America (IDSA), basée sur les signes cliniques locaux et l’état général du patient.
Traitement
La stratégie de traitement dépend de la gravité de l’infection. Le tableau 2 présente les recommandations de l’IDSA.
Le patient doit être stabilisé en ce qui concerne son diabète, tous les autres systèmes d’organes anormaux (cœur, reins…) nécessitent également un traitement. L’antibiothérapie doit être adaptée à l’antibiogramme des germes détectés. Il existe de nombreuses recommandations dans la littérature concernant la durée et la forme de l’antibiothérapie, mais il n’y a pas de preuves claires et le traitement doit donc être basé sur les signes cliniques.

Si un débridement chirurgical est indiqué (Fig. 2), Pour obtenir le meilleur résultat, le chirurgien doit avant tout éviter la propagation de l’infection et une éventuelle progression de la nécrose – ceci par l’incision de tous les compartiments impliqués, le débridement des zones nécrosées, le prélèvement d’échantillons osseux pour la microbiologie et l’histologie, l’hémostase méticuleuse et un traitement postopératoire intensif. Le chirurgien doit être conscient des structures des compartiments du pied et de la jambe (profond et superficiel) et des voies de propagation typiques d’une infection. Cela se produit généralement le long des tendons qui ont la plus faible résistance tissulaire. Les articulations et les os infectés doivent être débridés abondamment ou, selon la situation vasculaire locale, amputés.

Le moment de l’opération dépend de l’état général du patient. Si un choc septique menace, il faut inciser et débrider en urgence. Les amputations définitives peuvent généralement être planifiées secondairement. Dans la plupart des cas, un débridement répété est nécessaire pour créer des plaies propres et vitales. La thérapie par pression négative (NPWT) est souvent très utile pour protéger les plaies du dessèchement et de la nécrose, mais elle ne peut pas vraiment guérir une infection. Seul un débridement précis, aussi souvent que nécessaire, peut stabiliser la situation et, avec une amélioration des conditions associées, conduire finalement à une cicatrisation complète de la plaie. Cependant, la thérapie par pression négative est extrêmement efficace pour réduire la taille des plaies et obtenir une stimulation du tissu de granulation. Elle est souvent la seule possibilité d’obtenir une fermeture définitive de la plaie chez les patients dont l’état vasculaire est très mauvais, même si cela peut prendre des mois.
La dernière étape est la fermeture définitive de la plaie, qui doit respecter les règles de la chirurgie plastique reconstructive. Les petites plaies superficielles cicatrisent généralement de manière secondaire, tandis que les plaies plus importantes et plus profondes peuvent nécessiter des couvertures en peau fendue, voire en lambeaux complexes. Ces décisions doivent à nouveau être prises en tenant compte de tous les facteurs (plaie, âge, état des vaisseaux, comorbidités).
Traitement postopératoire
Le traitement des ulcères du pied diabétique est souvent long et difficile, c’est pourquoi un traitement cohérent doit être poursuivi même après la sortie de l’hôpital ou d’un centre de soins ambulatoires. Les soins de la peau, les bandages de compression (si nécessaire), les soins des pieds et l’adaptation des chaussures sont importants pour maintenir les résultats obtenus et éviter une rechute.
Littérature :
- Ahmad J : Le pied diabétique. Diabetes Metab Syndr. 2016 ; 10(1) : 48-60. doi:10.1016/j.dsx.2015.04.002.
- van Baal JG : Traitement chirurgical du pied diabétique infecté. Clin Infect Dis. 2004 ; 39 Suppl 2(Supplément 2) : S123-S128. doi:10.1086/383273.
- La Fontaine J, et al : Concepts actuels dans la prise en charge chirurgicale des infections aiguës du pied diabétique. Foot (Edinb). 2014 ; 24(3) : 123-127. doi:10.1016/j.foot.2014.05.003.
- Noor S, et al. : Comprendre l’infection du pied diabétique et sa prise en charge. Diabetes Metab Syndr. June 2016. doi:10.1016/j.dsx.2016.06.023.
- Wallace GF : Débridement des infections invasives du pied diabétique. Clin Plast Surg. 2007 ; 34(4) : 731-734. doi:10.1016/j.cps.2007.07.009.
- Lignes directrices de l’IDSA : Lipsky et.al. : Diagnostic et traitement des infections du pied diabétique, CID 2004 : 39.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(10) : 27-30












