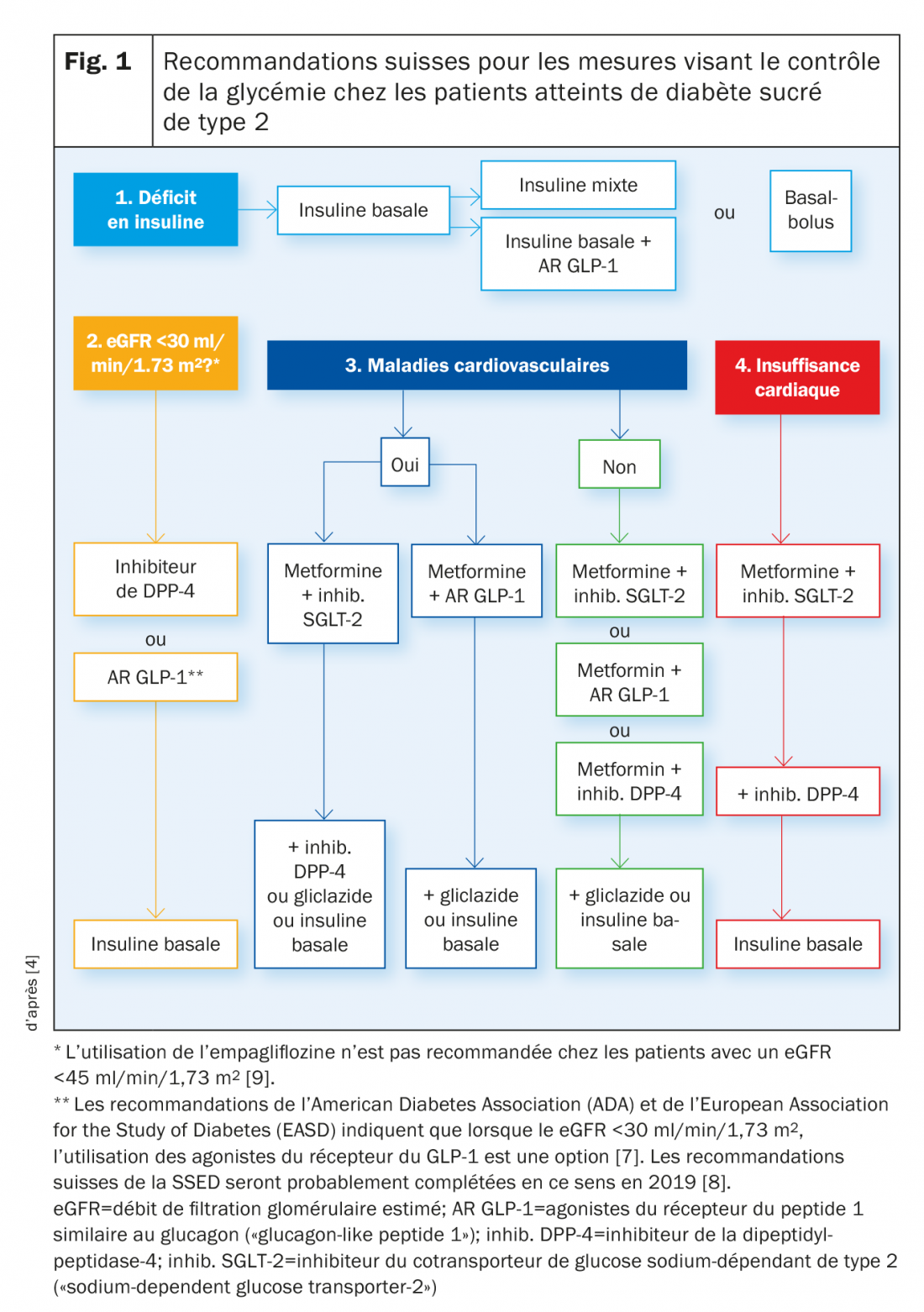
Pour le traitement du diabète de type 2, des classes de médicaments avec différents mécanismes d’action sont disponibles. La présence d’une insuffisance rénale, d’une maladie cardiovasculaire, d’une insuffisance cardiaque ou d’un déficit en insuline peut limiter le choix du traitement.
En Suisse, environ 5% de la population souffre de diabète et la proportion d’hommes (5,5%) est légèrement supérieure à celle des femmes (3,9%) [1]. Environ 90% des personnes touchées souffrent de diabète de type 2 (DT2) [2]. Par rapport à la population globale, la prévalence de cette maladie est particulièrement élevée parmi les patients avec une insuffisance cardiaque. Chez les patients insuffisants cardiaques hospitalisés, elle atteint environ 40% [3]. Ce phénomène est dû entre autres au chevauchement des facteurs de risque, à la physiopathologie et aux comorbidités [3]. Une particularité cruciale commune aux deux pathologies est qu’elles sont souvent accompagnées par une limitation de la fonction rénale [3]. Le DT2 et l’insuffisance cardiaque sont en effet associés au développement et à l’aggravation de maladies rénales chroniques, ce qui participe à un pronostic défavorable [3]. En raison de la relation entre le DT2, l’insuffisance cardiaque et les troubles rénaux, le besoin de traitements antidiabétiques présentant des propriétés cardioprotectrices et néphroprotectrices se fait de plus en plus sentir [3].
Classes de médicaments disponibles et recommandations de la SSED
Pour le traitement du DT2, différentes classes de médicaments avec différents mécanismes d’action sont disponibles (tab. 1). Selon les recommandations de la Société Suisse d’Endocrinologie et de Diabétologie (SSED), la metformine est le médicament de choix pour le traitement de première intention, auquel d’autres médicaments disponibles peuvent être associés précocement en fonction de leur mécanisme d’action et de leurs effets indésirables [4]. Différents autres facteurs, comme la présence d’une insuffisance rénale, d’une maladie cardiovasculaire, d’une insuffisance cardiaque ou d’un déficit en insuline, peuvent cependant limiter le choix du traitement [4].
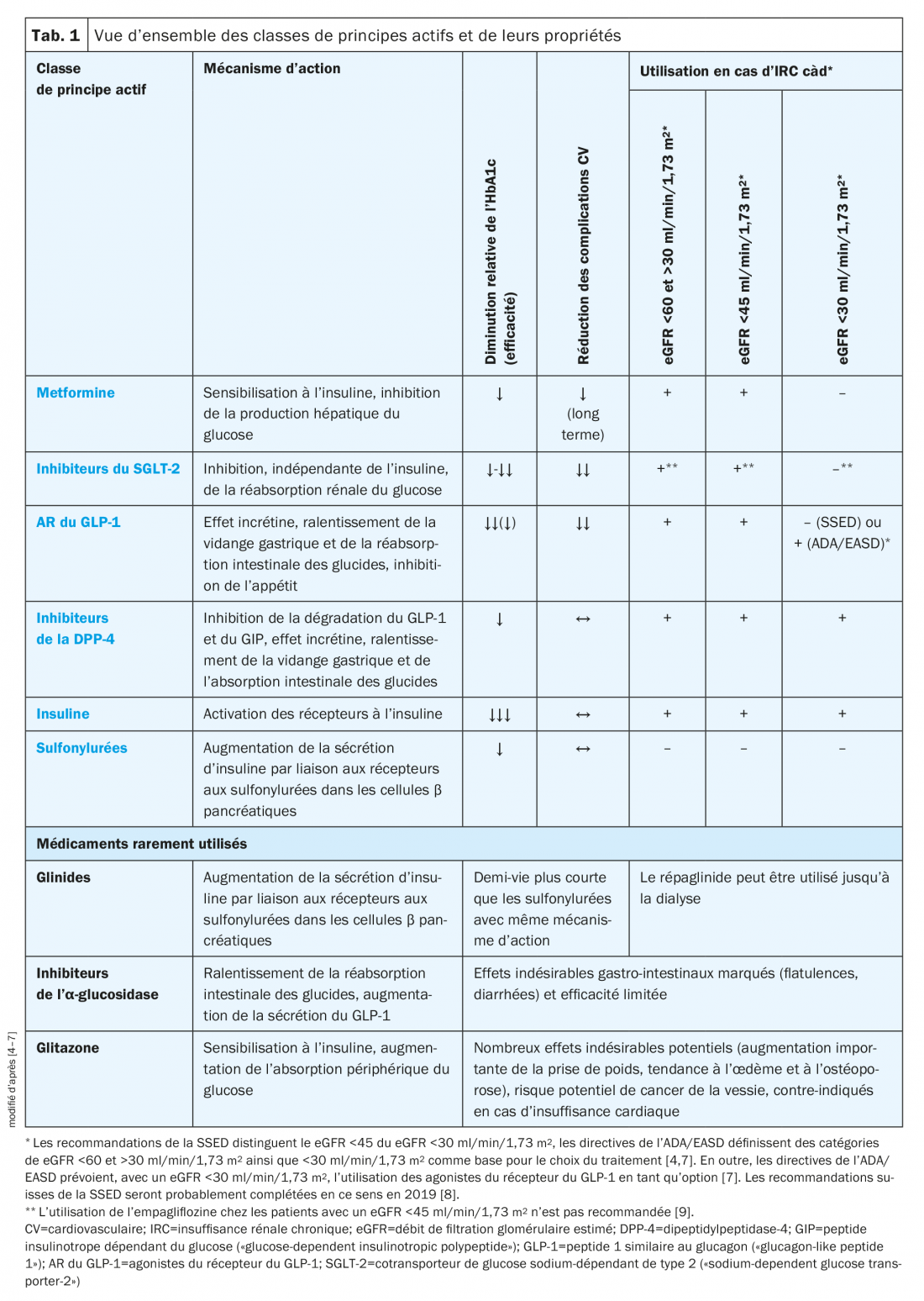
En cas de déficit en insuline, selon les recommandations de la SSED, l’insuline basale est le traitement de choix, suivi par l’insuline mixte et les insulines co-formulées, l’insuline basale en association avec un agoniste du récepteur au peptide 1 similaire au glucagon (glucagon-like peptide 1) (AR du GLP-1) ou un traitement basal-bolus.
Chez les patients insuffisants rénaux, le spectre des médicaments utilisables est également très limité. Alors que, chez les patients insuffisants rénaux modérés (débit de filtration glomérulaire estimé, eGFR <60 ml/min mais >30 ml/min/1,73 m2), les sulfonylurées à action longue ne peuvent pas être utilisées. En cas d’insuffisance rénale sévère (eGFR <30 ml/min/1,73 m2), seuls les inhibiteurs de la dipeptidylpeptidase-4 (DPP-4), les agonistes du récepteur du GLP-1 et l’insuline sont envisageables [4,9]. Pour tous les inhibiteurs de la DPP-4, à l’exception de la linagliptine, un ajustement de la posologie est nécessaire; tous les inhibiteurs de la DPP-4, sauf la saxagliptine, peuvent être utilisés jusqu’à la dialyse. Si le traitement ne conduit pas à l’obtention de la valeur cible individuelle de l’HbA1c dans les trois mois, il faut utiliser de l’insuline basale.
Concernant le risque cardiovasculaire, il existe également des différences entre les classes de médicaments. Ainsi, la metformine en utilisation de longue durée et en cas de maladie cardiovasculaire existante, les inhibiteurs du cotransporteur de glucose sodium-dépendant de type 2 (sodium-dependent glucose transporter-2, SGLT-2) et les agonistes du récepteur du GLP-1 sont associés à une réduction des complications cardiovasculaires et même de la mortalité globale [4]. Selon les recommandations de la SSED, il faut donc, chez les patients souffrant de maladies cardiovasculaires, utiliser en premier lieu la metformine puis une association précoce avec un inhibiteur du SGLT-2 ou un AR du GLP-1. Si la valeur HbA1c individuelle n’est pas atteinte, l’association de metformine et d’un inhibiteur du SGLT-2 peut être complétée par un inhibiteur de la DPP-4, le gliclazide ou l’insuline basale. En cas de traitement initial par la metformine plus inhibiteur de la DPP-4, peuvent être également ajoutés le gliclazide ou l’insuline basale.
Chez les personnes sans maladies cardiovasculaires, le traitement par la metformine en association avec un inhibiteur du SGLT-2, un AR du GLP-1 ou un inhibiteur de la DPP-4 est possible. Ce dernier peut être remplacé au besoin par le gliclazide ou l’insuline basale.
En cas d’insuffisance cardiaque, un traitement par la metformine plus un inhibiteur du SGLT-2 est en premier lieu indiqué. Si cela est indispensable, un inhibiteur de la DPP-4 peut ensuite être utilisé en plus. Si ce schéma ne conduit pas au résultat thérapeutique souhaité, l’insuline basale doit être utilisée (fig. 1) [4].
Le point sur le cœur
Inhibiteurs du SGLT-2: Outre leur effet antidiabétique primaire, les inhibiteurs du SGLT-2 présentent différentes propriétés pouvant influencer positivement le pronostic cardiovasculaire [10]. Ainsi, au cours de différentes études à visée cardiovasculaire menées auprès de patients avec DT2, des effets positifs sur des événements cardiovasculaires ont été montrés. Au cours de l’étude EMPA-REG OUTCOME menée auprès de patients avec une maladie cardiovasculaire établie, l’empagliflozine a été supérieure au traitement par placebo en termes de critère d’évaluation principal cardiovasculaire combiné (données compilées, tab. 2). En outre, l’empagliflozine a réduit la mortalité cardiovasculaire, la mortalité globale (HR 0,68; IC à 95% 0,57–0,82; p<0,001) et le risque d’hospitalisation pour insuffisance cardiaque (HR 0,65; IC à 95% 0,50–0,85; p=0,002) [10,11]. Pour le critère combiné «hospitalisation ou décès pour cause d’insuffisance cardiaque», l’empagliflozine a également montré un effet positif (HR 0,61; IC à 95% 0,47–0,79; p<0,001) [12]. Sur la base de ces données, l’empagliflozine est recommandée par Swissmedic pour «la prévention d’événements cardiovasculaires chez des patients atteints d’un diabète de type 2 et d’une maladie cardiovasculaire déjà manifeste» [9].
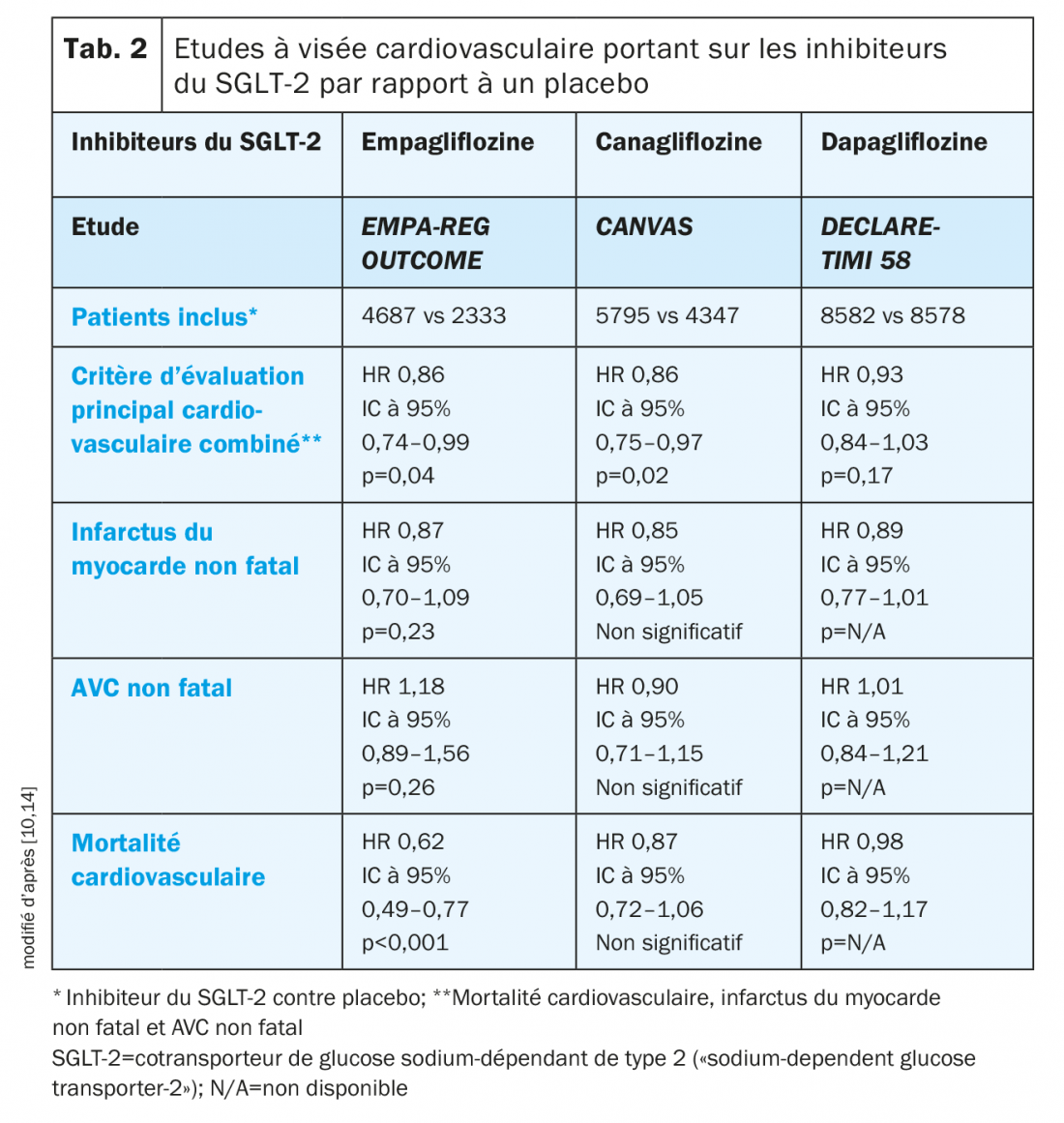
Dans le cadre du programme d’études CANVAS chez des patients avec maladie cardiovasculaire ou des facteurs de risque correspondants, la canagliflozine a également montré une réduction du critère d’évaluation principal cardiovasculaire combiné, mais, pour la mortalité cardiovasculaire, le seuil de significativité n’a pas été atteint [10,13]. En outre, une élévation du risque d’amputation a été enregistrée [13].
Les données récemment présentées de l’étude DECLARE-TIMI 58 montrent que les patients avec une maladie cardiovasculaire ou des facteurs de risque correspondants et traités par dapagliflozine ont présenté une réduction statistiquement significative des hospitalisations pour insuffisance cardiaque (2,5% contre 3,3% sous placebo; p<0,005), ainsi que du critère combiné «hospitalisation pour insuffisance cardiaque ou mortalité cardiovasculaire» (4,9% contre 5,8% sous placebo; p=0,005). En outre, la dapagliflozine a atteint la non-infériorité, mais pas la supériorité par rapport au placebo concernant les événements cardiovasculaires sévères. Contrairement à la canagliflozine, une élévation du risque d’amputation n’a pas été notée [14]. Il faut en outre souligner que les patients participant à l’étude DECLARE-TIMI 58 montraient des valeurs de eGFR nettement meilleures que ceux dans les études EMPA-REG OUTCOME et CANVAS en raison de critères d’exclusion différents. Ce point a participé à la mortalité plus faible dans l’étude DECLARE-TIMI 58 [11,13,14].
Agonistes du récepteur du GLP-1: Au cours de l’étude ELIXA, la non-infériorité du lixisénatide (AR du GLP-1) par rapport au placebo en termes de critère d’évaluation principal cardiovasculaire combiné a été montrée mais aucun effet positif sur le résultat cardiovasculaire n’a été mis en évidence (tab. 3) [15].
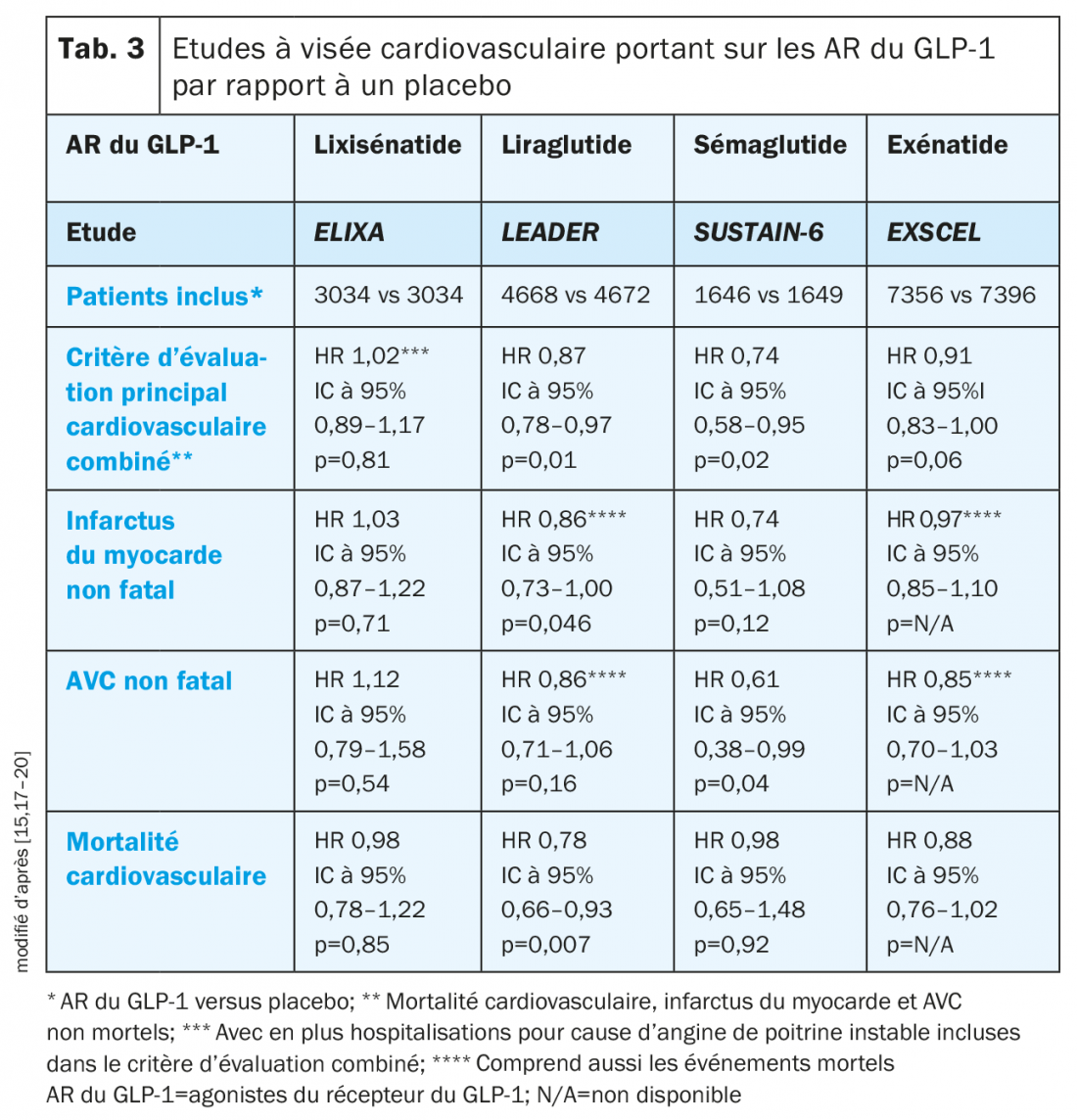
A l’inverse, au cours de l’étude LEADER, la non-infériorité du liraglutide par rapport au placebo a été montrée mais aussi une réduction significative de la mortalité cardiovasculaire chez les patients avec une maladie cardiovasculaire ou des facteurs de risque correspondants. La mortalité globale a été également significativement réduite, alors qu’aucune différence n’a été mise en évidence pour les hospitalisations pour insuffisance cardiaque [15]. Sur la base de ces résultats, le liraglutide est indiqué par Swissmedic pour la «prévention des événements cardiovasculaires chez les patients atteints du diabète sucré de type 2 et d’une maladie cardiovasculaire déjà établie» [16].
La non-infériorité du sémaglutide par rapport au placebo a été confirmée pour le critère MACE 3 points et une supériorité éventuelle a été montrée (MACE 3 points: réduction de 26%; p<0,001 pour la non-infériorité; p=0,02 pour la supériorité), bien que l’étude n’ait pas été conçue pour l’évaluation d’une supériorité. En outre, une réduction significative des AVC et infarctus du myocarde non mortels a été montrée mais sans effet sur la mortalité cardiovasculaire ou globale [17].
Un traitement hebdomadaire par l’exénatide n’a pas été inférieur au placebo au cours de l’étude EXSCEL, mais une différence en termes de mortalité cardiovasculaire, de survenue des infarctus du myocarde ou des AVC non mortels ou des hospitalisations pour insuffisance cardiaque, n’a pas été mise en évidence [15, 17–20].
Inhibiteurs de la DPP-4: Au cours d’études préliminaires, des effets cardiaques et vasculaires positifs ont été notés avec les inhibiteurs de la DPP-4 et les premiers résultats des études de phase II et III suggèrent une réduction des événements cardiovasculaires grâce à ces molécules [10]. Au cours des études à visée cardiovasculaire, la non-infériorité de l’alogliptine, de la saxagliptine, de la sitagliptine et de la linagliptine par rapport au placebo a été montrée (tab. 4). Il faut souligner ici qu’au cours de ces études, des patients recevant déjà le traitement «standard of care» pour le DT2 et le risque cardiovasculaire étaient inclus [10].
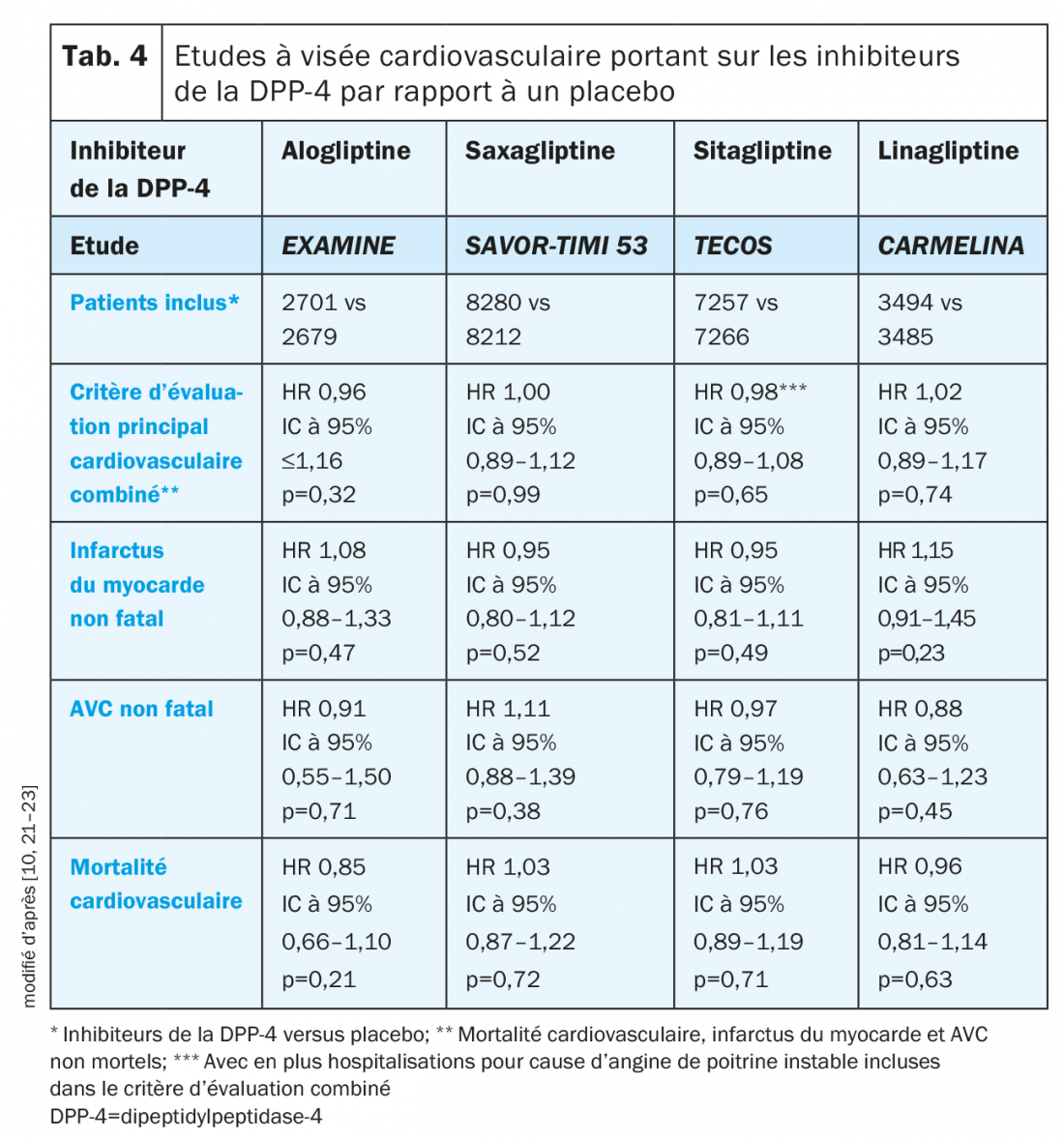
Une question qui reste en suspens sur l’utilisation des inhibiteurs de la DPP-4 concerne l’influence de ces molécules sur la survenue de l’insuffisance cardiaque. Dans le cadre de l’étude EXAMINE, une tendance non significative en faveur d’un taux d’hospitalisations pour insuffisance cardiaque plus élevé sous alogliptine a été enregistrée (1,07; IC à 95% 0,79–1,46; p=0,657) [10,24]. Dans une analyse post-hoc cependant, aucune influence sur le critère combiné «décès cardiovasculaires et hospitalisations pour insuffisance cardiaque» n’a été notée (HR 1,00; IC à 95% 0,82–1,21) [24].
Au cours de l’étude SAVOR-TIMI 53, le nombre de patients hospitalisés pour insuffisance cardiaque a été significativement plus important dans le groupe sous saxagliptine que sous placebo (3,5% contre 2,8%; HR 1,27; IC à 95% 1,07–1,51; p=0,007) [22]. Le risque d’insuffisance cardiovasculaire a été le plus élevé parmi les patients avec un DT2 et une augmentation du peptide natriurétique, une insuffisance cardiaque antérieure ou une maladie rénale chronique au début de l’étude [25].
Contrairement à deux études antérieures, l’étude TECOS n’a pas mis en évidence de différence au niveau du taux d’hospitalisations entre les groupes sous sitagliptine et sous placebo (HR 1,00; IC à 95% 0,83–1,20; p=0,98) [10,26].
La linagliptine n’a également pas conduit, au cours de l’étude CARMELINA, à une augmentation du taux d’hospitalisations pour insuffisance cardiaque (HR 0,90; IC à 95% 0,74–1,08; p=0,2635) [21].
Le point sur les reins
Inhibiteurs du SGLT-2: L’empagliflozine ainsi que la canagliflozine et la dapagliflozine ont présenté des propriétés potentiellement néphroprotectrices au cours des études, même si les populations de patients aient été différentes dans chaque étude (tab. 5) [3]. Alors que, dans EMPA-REG OUTCOME et CANVAS, les patients recrutés présentaient un eGFR d’au moins 30 ml/min/1,73 m², seuls les patients avec un eGFR >60 ml/min/1,73 m² ont été admis dans DECLARE-TIMI 58 [11,13,14].
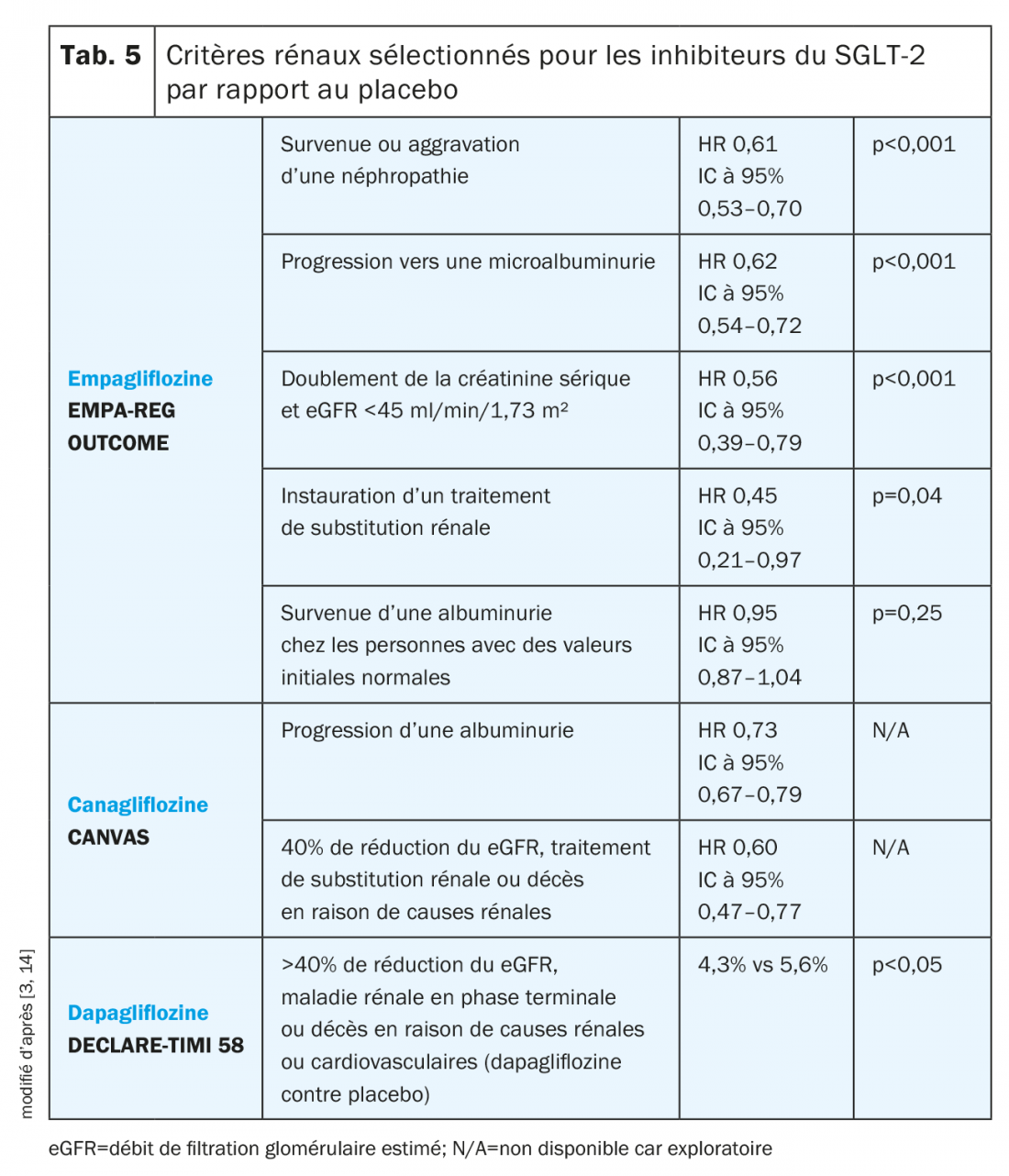
Dans le cadre de l’étude EMPA-REG OUTCOME, l’empagliflozine a été associée à une incidence plus faible d’aggravation de la néphropathie définie par la progression vers une microalbuminurie, un doublement de la créatinine sérique avec un eGFR <45 ml/min/1,73 m², l’instauration d’un traitement de substitution rénale ou le décès dû à une maladie rénale. Toutes les composantes individuelles, sauf la mortalité due à une maladie rénale, étaient statistiquement significatives. Dans le groupe sous empagliflozine, le eGFR a diminué modérément au cours des 4 premières semaines, puis s’est stabilisé pour retourner après la fin du traitement à la valeur initiale, alors qu’il a diminué continuellement pendant toute l’étude dans le groupe placebo [3].
Au cours de l’étude CANVAS, la progression de l’albuminurie, définie par une augmentation de cette dernière de plus de 30% et une progression de la normo- vers une microalbuminurie ou d’une micro- vers une macroalbuminurie, a été plus faible dans le groupe sous canagliflozine que sous placebo. En outre, sous canagliflozine, une réduction du critère combiné «réduction de 40% du eGFR, traitement de substitution rénale ou décès dû à une maladie rénale» a été enregistrée par rapport au placebo [3]. Actuellement, les critères rénaux de la canagliflozine sont également examinés dans le cadre de l’étude CREDENCE [27].
Comme le montrent les données récemment présentées de l’étude DECLARE-TIMI 58, la dapagliflozine exerce également un effet positif sur les critères rénaux et est associée à une réduction du critère combiné «réduction de 40% du eGFR, maladie rénale au stade terminal ou décès dû à une cause rénale ou cardiovasculaire» [14].
Agonistes du récepteur du GLP-1: Au cours de l’étude ELIXA, aucune influence significative du lixisénatide (AR du GLP-1) sur le rapport albumine/créatinine dans les urines (après prise en compte de l’HbA1c) n’a été notée (tab. 6) [3].
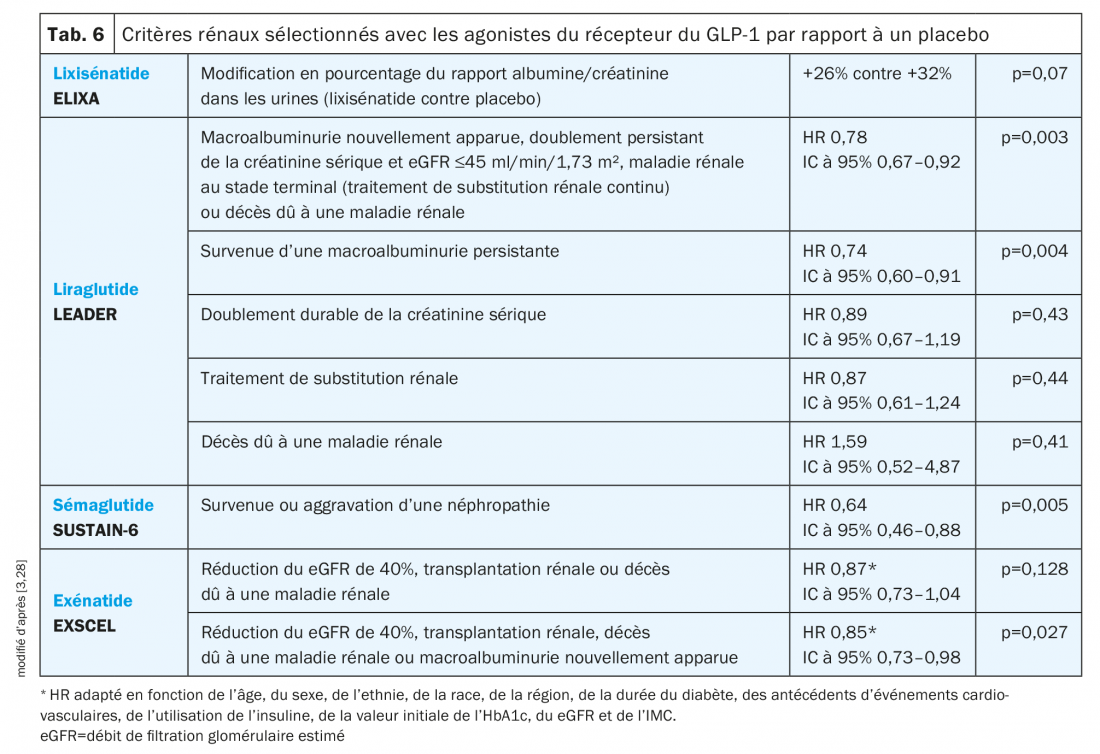
Par contre, un traitement par le liraglutide dans le cadre de l’étude LEADER a entraîné une réduction significative du risque pour le critère rénal combiné. En outre, en dépit d’une réduction globale, le eGFR a été modérément meilleur après 36 mois dans le groupe sous liraglutide que sous le placebo (rapport eGFR 1,02; IC à 95% 1,00–1,03) [3].
Au cours de l’étude SUSTAIN-6, les patients sous sémaglutide présentaient un risque de néphropathie (défini par une macroalbuminurie, un doublement persistant de la créatinine sérique et un eGFR <45 ml/min/1,73 m² ou un traitement de substitution rénale continu) plus faible [3].
Les données de l’étude EXSCEL récemment présentées montrent, à l’issue d’une analyse adaptée, une réduction significative sous exénatide du critère rénal combiné composé des éléments suivants: réduction du eGFR de 40%, besoin d’une transplantation rénale, décès dû à une maladie rénale et macroalbuminurie nouvellement apparue. Une macroalbuminurie est apparue chez 2,2% des patients dans le groupe sous exénatide et chez 2,5% dans le groupe sous placebo. Aucune différence au niveau du eGFR n’a été observée (différence entre les moyennes des moindres carrés +0,21; IC à 95% –0,27 à 0,70 ml/min/1,73 m²; p=0,39) [28].
Inhibiteurs de la DPP-4: Dans le cadre de l’étude TECOS, un traitement par sitagliptine (inhibiteur de DPP-4) a été associé à une diminution légère mais durable du rapport albumine/créatinine dans les urines pendant toute la durée du suivi de 3 ans (tab. 7) [29]. Sous saxagliptine, une diminution de l’albuminurie a également été enregistrée au cours de l’étude SAVOR-TIMI 53 [3]. Concernant le eGFR, une valeur légèrement mais durablement diminuée a été notée au cours de l’étude TECOS sous sitagliptine par rapport au placebo. Cela n’était pas le cas dans l’étude SAVOR-TIMI 53 ou EXAMINE [24]. Cette réduction durable se distingue de la diminution initiale suivie par une stabilisation du eGFR sous empagliflozine observée dans le cadre de l’étude EMPA-REG OUTCOME [3].
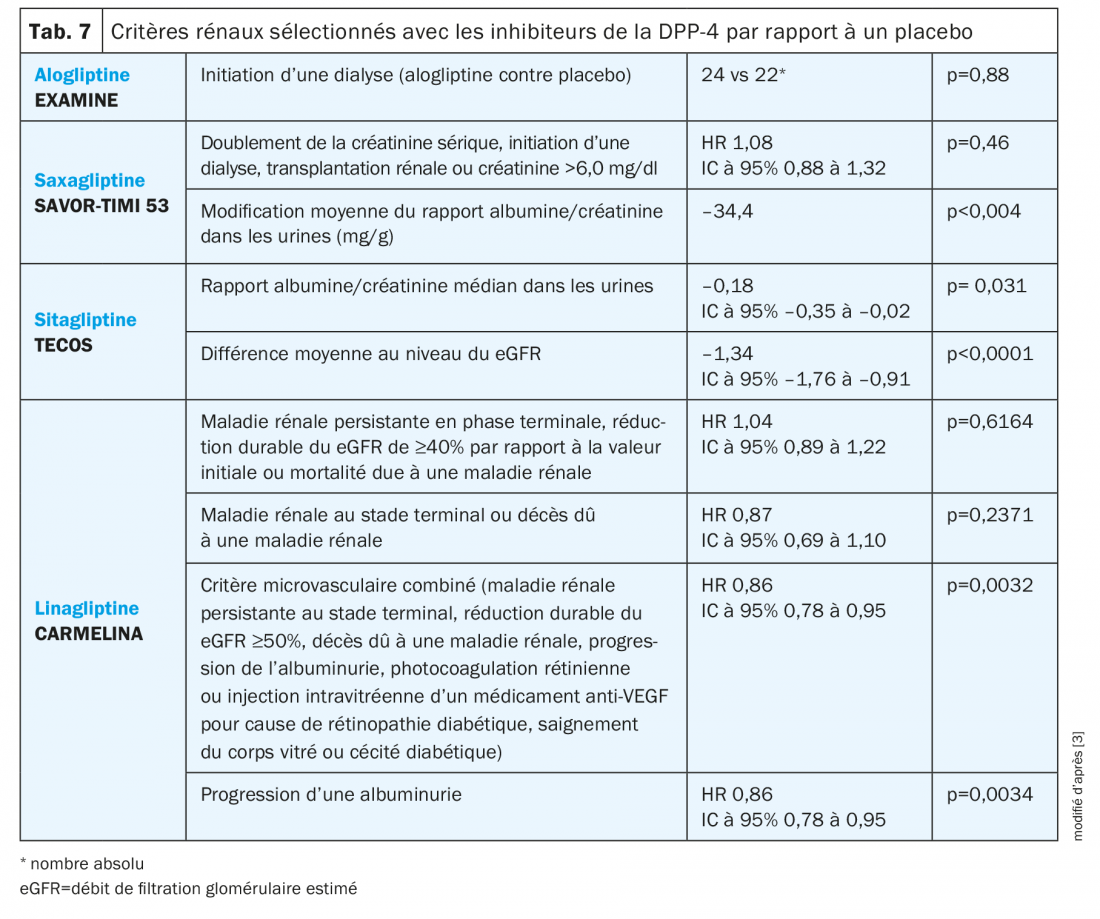
Dans l’étude CARMELINA, des patients avec une maladie cardiovasculaire et/ou une maladie rénale chronique ont été examinés et la sécurité cardiovasculaire et rénale a été confirmée. En outre, une différence significative par rapport au placebo a été mise en évidence au niveau du critère d’évaluation microvasculaire combiné et de la progression de l’albuminurie [21].
Choix du traitement antidiabétique
Sur la base des données connues sur la sécurité cardiovasculaire et des propriétés protectrices potentielles, selon les recommandations de la SSED, les inhibiteurs du SGLT-2 ou les agonistes du récepteur du GLP-1 liraglutide, sémaglutide ou dulaglutide doivent être utilisés en priorité en présence d’une maladie cardiovasculaire. Chez les patients avec une insuffisance rénale modérée (eGFR <45 ml/min/1,73 m2), il ne faut pas utiliser de sulfonylurée [4]. En cas d’insuffisance rénale sévère (eGFR <30 ml/min/1,73 m2), le choix des antidiabétiques est limité à l’insuline, les agonistes du récepteur du GLP-1 et aux inhibiteurs de la DPP-4, et l’utilisation des inhibiteurs de la DPP-4 nécessite un ajustement de la posologie de presque tous les principes actifs de cette classe sauf de la linagliptine (tab. 8) [4,7].

Si le eGFR est <30 ml/min/1,73 m2, les inhibiteurs du SGLT-2 ne doivent pas non plus être utilisés car l’effet antidiabétique diminue en raison de la réduction de la fonction rénale. Les effets positifs sur le maintien de la fonction rénale ainsi que la réduction des événements cardiovasculaires et de la mortalité persistent toutefois jusqu’à un eGFR de 30 ml/min/1,73 m2 [4].
Une vue d’ensemble des critères déterminant le choix du traitement en cas d’insuffisance rénale ou cardiaque d’après les recommandations de la SSED est présentée dans le tableau 9 [4].
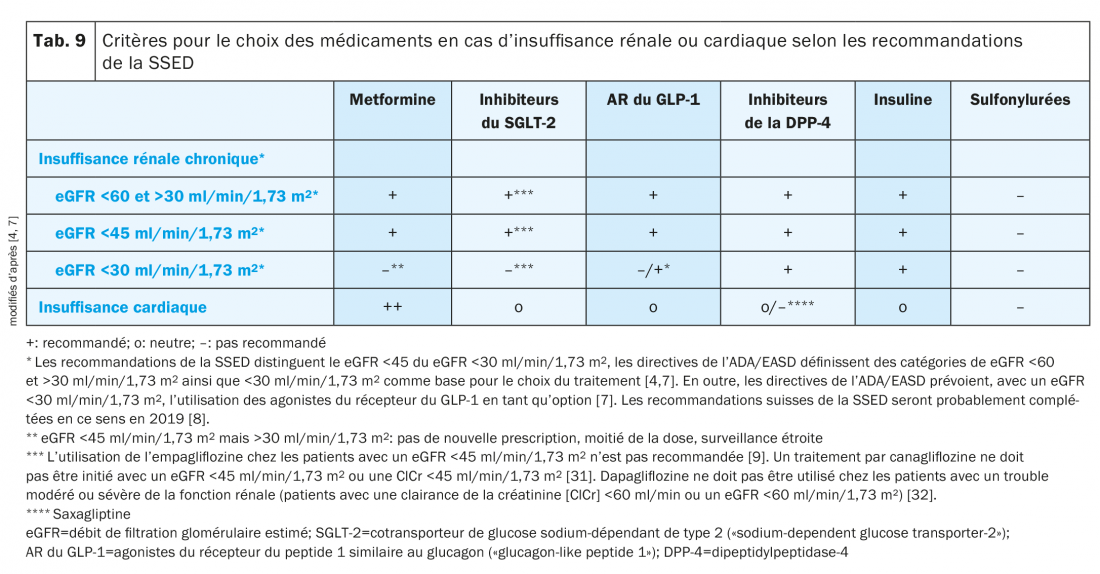
Patients avec insuffisance cardiaque et rénale
De nombreuses observations épidémiologiques ont établi un lien entre la morbidité et la mortalité cardiovasculaires et la diminution de la fonction rénale, indépendamment de la pathologie qui survient en premier. On parle de syndrome cardio-rénal ou réno-cardiaque en fonction de la cause initiale. Ces deux pathologies montrent un certain chevauchement et peuvent toutes les deux être favorisées par le diabète [33].
La classification de cette pathologie distingue cinq types différents, dont les quatre premiers concernent des syndromes cardio-rénaux ou réno-cardiaques aigus ou chroniques. Le type 5, par contre, fait référence aux syndromes cardio-rénaux secondaires ou à l’atteinte cardiaque et rénale dans le contexte de maladies systémiques. Par conséquent, on peut parler de syndrome cardio-rénal de type 5 dans le cadre du diabète [34].
La question se pose dans la pratique clinique de savoir quelles classes de médicaments utiliser chez les patients avec un DT2 et une insuffisance cardiaque et rénale. Si le degré de sévérité de l’insuffisance rénale le permet, les inhibiteurs du SGLT-2 représentent les médicaments de premier choix. Si la fonction rénale continue à diminuer, les AR du GLP-1 peuvent être envisagés. En cas d’insuffisance rénale sévère, seuls les inhibiteurs de la DPP-4, les agonistes du récepteur du GLP-1 ou l’insuline sont indiqués. On observe globalement que les diurétiques doivent être utilisés avec précautions chez ces patients afin de ne pas provoquer une diurèse excessive [4,7].
Take-Home-Messages
- Pour le traitement du diabète de type 2, des classes de médicaments avec différents mécanismes d’action sont disponibles: la metformine, les inhibiteurs du SGLT-2, les agonistes du récepteur du GLP-1, les inhibiteurs de la DPP-4, l’insuline et les sulfonylurées.
- Selon les recommandations de la Société Suisse d’Endocrinologie et de Diabétologie (SSED), la metformine, à laquelle les autres médicaments peuvent être combinés précocement, est le médicament de choix pour le traitement de première intention.
- La présence d’une insuffisance rénale, d’une maladie cardiovasculaire, d’une insuffisance cardiaque ou d’un déficit en insuline peut limiter le choix du traitement.
- Chez les patients avec une maladie cardiovasculaire, un inhibiteur du SGLT-2 (empagliflozine, dapagliflozine, canagliflozine) ou un agoniste du récepteur du GLP-1 (liraglutide, semaglutide, dulaglutide) doit être préféré, selon les recommandations de la SSED.
- En cas d’insuffisance rénale sévère (débit de filtration glomérulaire estimé <30 ml/min/1,73 m2), le choix des antidiabétiques est limité à l’insuline, aux agonistes du récepteur du GLP-11 et aux inhibiteurs de la DPP-4, bien que ces derniers, sauf la linagliptine, nécessitent un ajustement de la posologie.
HAUSARZT PRAXIS 2019; 14(4): 11–19
Bibliographie:
- Office fédéral de la statistique. Diabète. www.bfs.admin.ch/bfs/fr/home/statistiques/sante/etat-sante/maladies/diabete.html. Dernier accès: 29.10.2018.
- Diabètesuisse. A propos du diabète. www.diabetesschweiz.ch/fr/a-propos-du-diabete.html. Dernier accès: 29.10.2018.
- McHugh KR, et al.: The emerging role of novel antihyperglycemic agents in the treatment of heart failure and diabetes: A focus on cardiorenal outcomes. Clin Cardiol 2018; 41(9): 1259–1267.
- Lehmann R, et al.: Empfehlungen der SGED/SSED: Massnahmen zur Blutzuckerkontrolle bei Patienten mit Diabetes mellitus Typ 2. Schweizerische Gesellschaft für Endokrinologie und Diabetologie 2016.
- Chaudhury A, et al.: Clinical review of antidiabetic drugs: Implications for type 2 diabetes mellitus management. Frontiers in endocrinology 2017; 8: 6.
- Stein SA, Lamos EM, Davis SN: A review of the efficacy and safety of oral antidiabetic drugs. Expert opinion on drug safety 2013; 12(2): 153–175.
- Davies MJ, et al.: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018; 61(12): 2461–2498.
- Communication personnelle de Prof. R. Lehmann, président du groupe de travail.
- Information professionnelle sur Jardiance®. www.swissmedicinfo.ch. Mise à jour de l’information: avril 2018.
- Scheen AJ: Cardiovascular Effects of New Oral Glucose-Lowering Agents: DPP-4 and SGLT-2 Inhibitors. Circulation Research 2018; 122(10): 1439–1459.
- Zinman B, et al.: Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Eng J Med 2015; 373(22): 2117–2128.
- Fitchett D, et al.: Heart failure outcomes with empagliflozin in patients with type 2 diabetes at high cardiovascular risk: results of the EMPA-REG OUTCOME® trial. European Heart Journal 2016; 37(19): 1526–1534.
- Neal B, et al.: Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Eng J Med 2017; 377(7): 644–657.
- Wiviott SD, et al.: Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Eng J Med 2019; 380: 347–357.
- Cefalu WT, et al.: Cardiovascular Outcomes Trials in Type 2 Diabetes: Where Do We Go From Here? Reflections From a Diabetes Care Editors’ Expert Forum. Diabetes Care 2018; 41(1): 14–31.
- Information professionnelle sur Victoza®. www.swissmedicinfo.ch. Mise à jour: avril 2018.
- Marso SP, et al.: Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Eng J Med 2016; 375(19): 1834–1844.
- Holman RR, et al.: Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Eng J Med 2017; 377(13): 1228–1239.
- Marso SP, et al.: Liraglutide and cardiovascular outcomes in type 2 diabetes. N Eng J Med 2016; 375(4): 311-322.
- Pfeffer MA, et al.: Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Eng J Med 2015; 373(23): 2247–2257.
- Rosenstock J, et al.: Cardiovascular and Renal Microvascular Outcome Study with Linagliptin in Patients with Type 2 Diabetes Mellitus (CARMELINA®). Oral presentation at the 54th Annual Meeting of the European Association for the Study of Diabetes (EASD), Berlin, Thursday, 4 October 2018. www.easd.org/ virtualmeeting/home.html#!contentsessions/2873.
- Scirica BM, et al.: Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Eng J Med 2013; 369(14): 1317–1326.
- White WB, et al.: Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Eng J Med 2013; 369(14): 1327–1335.
- Zannad F, et al.: Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. The Lancet 2015; 385(9982): 2067–2076.
- Scirica BM, et al.: Heart failure, saxagliptin and diabetes mellitus: observations from the SAVOR-TIMI 53 randomized trial. Circulation 2014; 130(18): 1579–1588.
- Green JB, et al.: Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Eng J Med 2015; 373(3): 232–242.
- Jardine MJ, et al.: The canagliflozin and renal endpoints in diabetes with established nephropathy clinical evaluation (CREDENCE) study rationale, design, and baseline characteristics. American journal of nephrology 2017; 46(6): 462–472.
- Bethel MA, et al.: Renal Outcomes in the EXenatide Study of Cardiovascular Event Lowering (EXSCEL). Diabetes, 2018. 67 (Suppl 1): https://doi.org/10.2337/db18-522-P.
- Cornel JH, et al.: Effect of Sitagliptin on Kidney Function and Respective Cardiovascular Outcomes in Type 2 Diabetes: Outcomes From TECOS. Diabetes Care 2016; 39(12): 2304–2310.
- www.swissmedicinfo.ch.
- Information professionnelle sur Invokana®. www.swissmedicinfo.ch. Mise à jour: avril 2018.
- Information professionnelle sur Forxiga®. www.swissmedicinfo.ch. Mise à jour: janvier 2018.
- Schrier RW: Cardiorenal versus renocardiac syndrome: is there a difference? Nat Clin Pract Nephrol 2007; 3(12): 637.
- Di Lullo L, et al.: Type-5 cardiorenal syndrome (CRS-5): an up to date. Nephrology @ Point of Care 2017; 3(1): p. e23–e32.
HAUSARZT PRAXIS 2019; 14(4): 11–19
CARDIOVASC 2019; 18(3): 18–25











