Dans les maladies neurodégénératives chroniques telles que la sclérose en plaques, les cellules du SNC procèdent à diverses adaptations au cours de la neuroinflammation. Les principales cellules impliquées dans ce processus inflammatoire sont les cellules gliales, parmi lesquelles se distinguent les astrocytes. Il est rapporté que les astrocytes réactifs perdent leur fonction de soutien au fur et à mesure de la progression des maladies et prennent une fonction toxique.
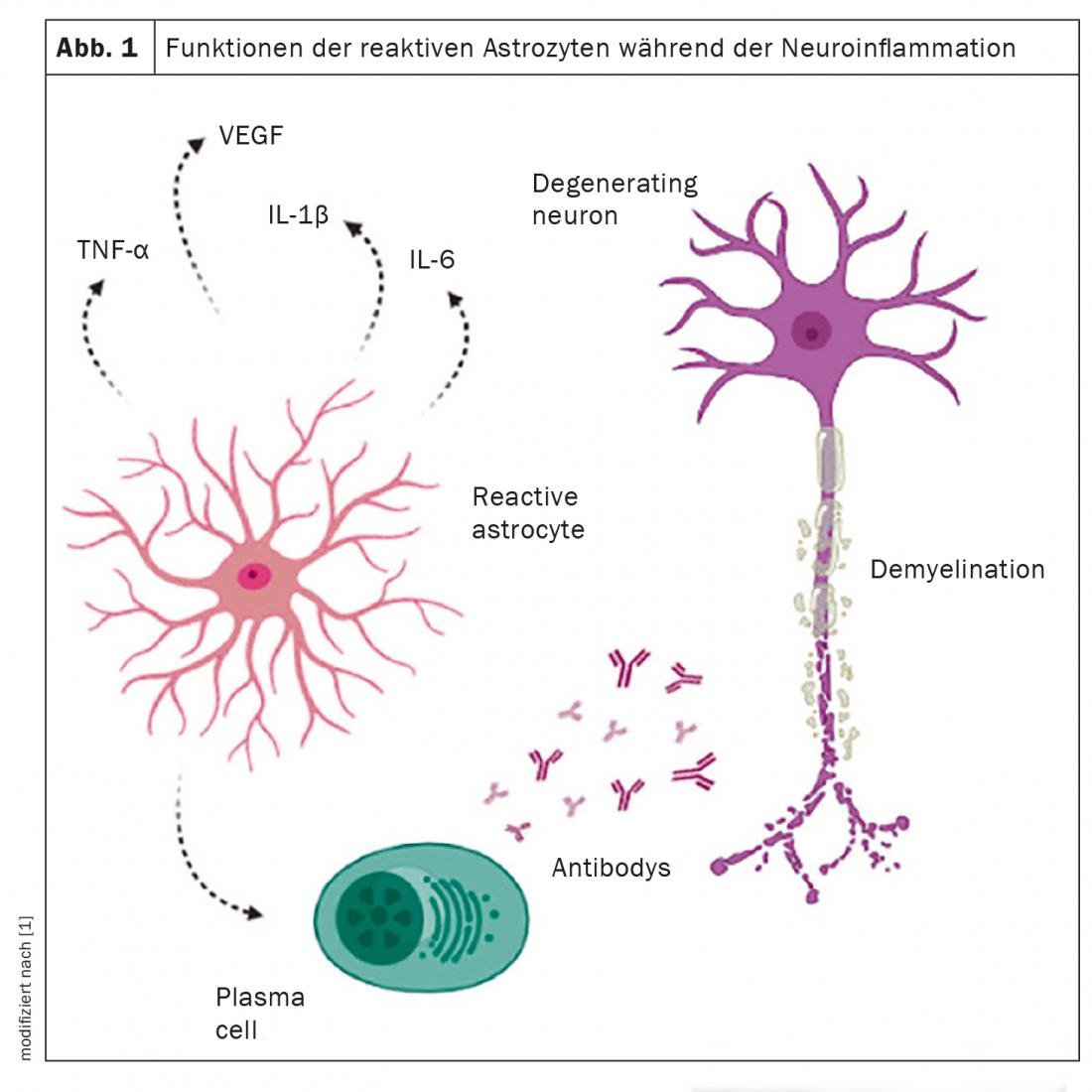
Les astrocytes constituent le groupe de cellules le plus répandu dans toutes les régions du système nerveux central. Selon le type de lésion, ils peuvent sécréter des cytokines pro-inflammatoires (Th1, IL-1, IL-2, IL-6, IL-7 et TNF) et anti-inflammatoires (Th2, IL-4, IL-10, IL-13 et TGFβ). En outre, ils sont associés à plusieurs fonctions physiologiques, notamment la sécrétion de nutriments, le maintien du microenvironnement neuronal, la perméabilité de la barrière hémato-encéphalique et le développement de processus pathologiques dans le cerveau. Les astrocytes jouent un rôle complexe dans la pathogenèse des maladies neurodégénératives telles que la sclérose en plaques (SEP). Plusieurs études rapportent qu’au fur et à mesure de la progression de ces maladies, les astrocytes réactifs perdent leur rôle de soutien et acquièrent une fonction toxique. Un travail de synthèse a donc mis en évidence les principales caractéristiques des astrocytes dans le développement de la SEP afin de permettre une meilleure compréhension de la maladie.
Les stars cachées du cerveau
Les astrocytes font partie des cellules gliales, c’est-à-dire des cellules du système nerveux qui ne sont pas excitables électriquement. Ils sont constitués de nombreuses fibrilles entrelacées, dont la structure est appelée filament glial. Ils peuvent être classés en deux sous-types principaux, appelés fibreux ou protoplasmiques, en raison de différences dans leur morphologie cellulaire et leur contenu en filaments gliaux. Les astrocytes fibreux se trouvent principalement dans la substance blanche et ont de longues fibres avec de nombreux filaments gliaux dans le cytoplasme. Les astrocytes protoplasmiques, quant à eux, sont largement répandus dans la matière grise et présentent des ramifications épaisses. La formation d’unités neurovasculaires se fait par des processus astrocytaires, ces cellules jouant le rôle de pont entre les neurones et les vaisseaux sanguins. En outre, les cellules astrocytaires peuvent fournir des structures et un soutien métabolique aux neurones et jouent un rôle important dans la régulation de la survie neuronale, la formation des synapses et la distribution des canaux ioniques.
Les podocytes astrocytaires entourent étroitement les cellules endothéliales et sont essentiels à la structure de la barrière hémato-encéphalique en raison de leur capacité à établir des connexions étroites et de leur teneur élevée en mitochondries. Grâce à leurs interactions avec les composants de la barrière hémato-encéphalique (BHS), les astrocytes régulent non seulement son fonctionnement, mais reconnaissent également les molécules produites par les cellules immunitaires périphériques, dont les cytokines. De plus, ils expriment de nombreux récepteurs qui leur permettent de réagir à des composés neuroactifs tels que les neurotransmetteurs, les neuropeptides, les facteurs de croissance, les cytokines et les toxines.
Leur rôle dans l’évolution de la SEP
La principale caractéristique pathologique de la SEP est la présence de lésions inflammatoires focales et de démyélinisation causées par la réaction immunitaire. Le rôle joué par les astrocytes dans la formation de ces lésions est actif et varié, avec plusieurs modifications fonctionnelles, comme l’altération de la perméabilité de la barrière hémato-encéphalique, qui favorise une réponse immunitaire dérégulée au niveau du système nerveux central.
Les astrocytes réagissent aux lésions du SNC par un processus d’activation complexe qui comprend à la fois des changements morphologiques, transcriptionnels et biochimiques et des changements fonctionnels liés à une réduction des fonctions métaboliques homéostatiques. Cela s’accompagne d’une augmentation de l’expression de la protéine acide du filament fibrillaire intermédiaire glial (GFAP), qui sert donc de marqueur pour les astrocytes réactifs. Comme ils réagissent aux changements dans leur environnement, il est difficile de faire la différence entre une cellule normale et un astrocyte réactif. On appelle astrocyte réactif la cellule qui a réagi à une maladie ou à une altération tissulaire. Les astrocytes sont présents sur les bords actifs des lésions démyélinisantes et jouent un rôle clé dans l’élimination de la myéline endommagée. Ces cellules sont hypertrophiées, ont de grands noyaux et leur cytoplasme peut contenir des filaments intermédiaires gliaux et des débris cellulaires. Dans les lésions chroniques, la bordure périphérique astrocytaire présente une démyélinisation active et peut provoquer des lésions inflammatoires supplémentaires qui contribuent à la progression de la maladie.
Les astrocytes jouent toutefois un double rôle : non seulement ils contribuent à la dégénérescence axonale et à la démyélinisation, mais ils créent également un environnement favorable qui favorise la remyélinisation. Cependant, l’influence des astrocytes sur la pathogenèse et la réparation du processus inflammatoire dépend de plusieurs facteurs, tels que le moment après la blessure, le type de blessure, le microenvironnement environnant, l’interaction avec d’autres types de cellules et les facteurs qui influencent leur activation. Les différents facteurs neurotrophiques, cytokines et facteurs de croissance fournis par les astrocytes facilitent le processus de réparation essentiel dans la SEP. En outre, les astrocytes apportent un soutien supplémentaire à la remyélinisation en recrutant des macrophages/microglie responsables de l’élimination des résidus de myéline sur les sites des lésions démyélinisées, permettant ainsi la formation de nouvelle myéline.
Les astrocytes comme cible thérapeutique
Compte tenu de l’importance des astrocytes dans la pathogenèse de la SEP, ils constituent une cible thérapeutique intéressante. Aucun des traitements actuellement autorisés ne s’adresse spécifiquement aux astrocytes. Cependant, plusieurs thérapies ont montré un effet sur ces derniers. Le fumarate de diméthyle (DMF) inhibe l’activation pro-inflammatoire des astrocytes, y compris la signalisation NF-κB, et active le facteur de transcription Nrf2, qui régule la réponse antioxydante dans les astrocytes. Le fingolimod agit sur les astrocytes en inhibant la signalisation NF-κB, en réduisant l’expression des cytokines pro-inflammatoires et en augmentant les facteurs neurotrophiques. Le laquinimod réduit la signalisation NF-κB et les réactions pro-inflammatoires des astrocytes. L’acétate de glatiramère (AG) induit l’expression de l’IL-10 et du facteur de croissance transformant (TGF-β) par les astrocytes, rétablit les connexions périvasculaires des astrocytes avec les vaisseaux sanguins et les synapses neuronales et inhibe le TNF-α.
Source :
- Salles D, Spindola Samartini R, de Seixas Alves MT, et al : Functions of astrocytes in multiple sclerosis : A review. Multiple Sclerosis and Related Disorders 2022 ; 60 : 103749.
Littérature complémentaire :
- Aharoni R, Eilam R, Arnon R, et al : Astrocytes in multiple sclerosis-essential constituents with diverse multifaceted functions. Int J Mol Sci 2021 ; 22 : 11.
- Ambrosini E, Remoli ME, Giacomini E, et al : Les astrocytes produisent des chimiokines attirant les cellules dendritiques in vitro et dans les lésions de sclérose en plaques. J Neuropathol Exp. Neurol 2005 ; 64(8) : 706-715.
- Batiuk MY, Martirosyan A, Wahis J, et al : Identification des sous-types d’astrocytes spécifiques à une région à la résolution d’une seule cellule. Nat Commun 2020 ; 11 : 1220.
InFo NEUROLOGIE & PSYCHIATRIE 2022 ; 20(3) : 35-35