Le syndrome des jambes sans repos est l’une des maladies neurologiques les plus courantes, avec une prévalence d’environ 7% – une mise à jour.
Le syndrome des jambes sans repos (SJSR) est l’une des maladies neurologiques les plus courantes, avec une prévalence d’environ 7%. La première description convaincante des troubles est attribuée à l’anatomiste anglais Thomas Willis (1672). Une typologie plus détaillée du complexe de symptômes du RLS a été réalisée au 19e siècle, entre autres par Theodor Wittmaack, qui a introduit le terme “Anxietas tibiarum” en raison du besoin de bouger. Dans la première moitié du XXe siècle, l’agrégation familiale et l’exacerbation par la grossesse ont été reconnues, mais ce n’est qu’en 1944-1945 que Karl-Axel Ekbom a regroupé toutes les caractéristiques cliniques et a forgé le terme RLS, aujourd’hui couramment utilisé [1]. Le RLS est souvent appelé “maladie de Willis-Ekbom” (WED) (Fig. 1). Comme le RLS peut affecter non seulement les jambes mais aussi les bras, le nom de WED ou RLS/WED a de nouveau été proposé récemment.

Symptômes et diagnostic
Les patients concernés ont souvent du mal à décrire leurs troubles du RLS. Les symptômes sensoriels comprennent des dysesthésies, des brûlures, des tiraillements, des picotements, des électrisations ou des démangeaisons. La moitié des patients ressentent des douleurs. La caractéristique décisive est toutefois le besoin de bouger, qui ne doit pas nécessairement être accompagné de paresthésies. Le RLS est un diagnostic clinique ; outre le besoin de bouger, les caractéristiques essentielles du RLS sont l’apparition au repos, l’aggravation le soir et la nuit et l’amélioration par le mouvement (voir l’encadré “Critères diagnostiques du RLS”).

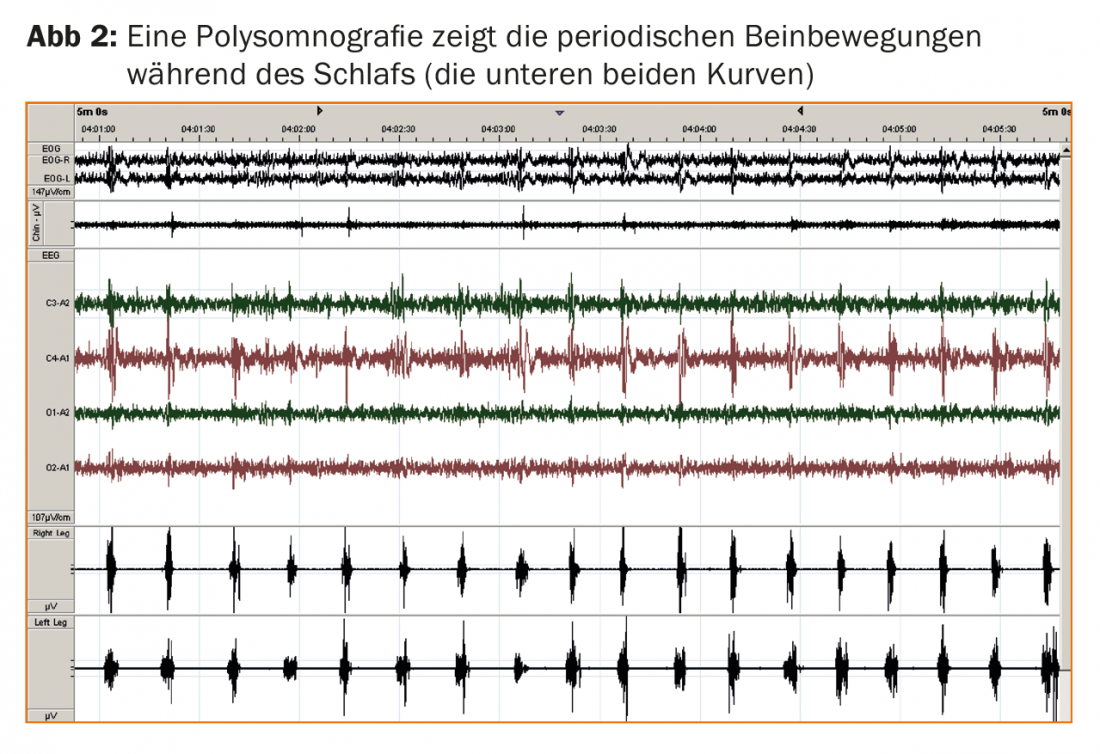
La polysomnographie est un complément diagnostique facultatif mais utile. La polysomnographie permet de détecter des mouvements périodiques des jambes pendant le sommeil (PLMS ; fig. 2) chez presque tous les patients atteints de RLS et d’enregistrer les effets sur la qualité du sommeil nocturne, typiquement sous la forme d’une latence d’endormissement prolongée et d’une fragmentation du sommeil due à des réactions d’éveil corticales induites par le PLMS. La réponse immédiate à la lévodopa à faible dose et les antécédents familiaux positifs chez plus de 50% des patients atteints de RLS renforcent le diagnostic. Désormais, l’absence de somnolence diurne sévère est également mentionnée comme caractéristique diagnostique non essentielle, ce qui peut surprendre à première vue, mais qui correspond à l’expérience selon laquelle les patients atteints de RLS se plaignent plutôt d’autres symptômes diurnes tels que la fatigue ou les troubles de la concentration, malgré un sommeil nocturne perturbé.
L’échelle internationale de gravité du RLS (Fig. 3) permet une évaluation semi-quantitative des symptômes du RLS. Le test d’immobilisation tente d’objectiver l’incapacité à maintenir les jambes immobiles en position fixe, mais ce test n’a pas réussi à s’imposer comme un examen diagnostique de routine.

Diagnostic différentiel
Il existe différents tableaux cliniques qui semblent répondre à certains, voire à tous les critères essentiels de diagnostic du RLS et dont la délimitation peut parfois poser quelques problèmes. Il s’agit notamment des paresthésies liées à des blessures circonscrites aux jambes, des crampes aux jambes, de la polyneuropathie périphérique, de la radiculopathie, de l’anxiété, de l’akathisie, des douleurs musculaires, des positions inconfortables, du balancement habituel des pieds, de l’œdème de la jambe ou de l’inflammation des articulations.
Génétique et physiopathologie
La prédisposition génétique joue un rôle important dans le RLS. Les vrais jumeaux présentent une concordance RLS plus élevée que les faux jumeaux. La maladie est généralement transmise selon un mode autosomique dominant, avec une forte pénétrance. Le phénomène d’anticipation est également typique du RLS, c’est-à-dire que l’on observe un début plus précoce et une évolution plus grave de la maladie à chaque génération suivante. Des études d’association à l’échelle du génome ont permis d’identifier différentes mutations génétiques (PTPRD, BTBD9, MEIS1) qui sont associées à un risque accru de RLS [2].
La cause du RLS est encore largement inexpliquée, aucun indice de neurodégénérescence n’a été mis en évidence. Les troubles du métabolisme du fer et de la dopamine jouent un rôle central. La carence en fer est une cause fréquente et traitable du RLS, par exemple en cas de grossesse, d’anémie pernicieuse ou d’insuffisance rénale et de dialyse. Des troubles passagers du RLS peuvent survenir en postopératoire suite à une perte de sang. Les examens IRM et post-mortem ont montré une concentration réduite de fer dans la substantia nigra, le thalamus et les ganglions de la base [3,4]. Outre la réponse thérapeutique à la lévodopa, les examens d’imagerie ont montré une diminution de la densité des récepteurs D2 de la dopamine dans le striatum et une réduction du transporteur de la dopamine.
RLS secondaire
Les maladies associées à une carence en fer sont la cause la plus fréquente d’un RLS secondaire. En outre, la prévalence du RLS est plus élevée dans diverses maladies neurologiques, telles que la sclérose en plaques, la chorée de Huntington, la sclérose latérale amyotrophique ou la maladie de Parkinson. L’hypo- et l’hyperthyroïdie ainsi que les maladies pulmonaires chroniques semblent également être associées à un risque accru de RLS. En outre, de nombreux médicaments peuvent déclencher ou aggraver le RLS, notamment les tricycliques et autres antidépresseurs, le lithium, les antihistaminiques, les neuroleptiques et l’alcool. Par définition, la forme secondaire du RLS disparaît une fois que le déclencheur a été éliminé.
Traitement du RLS
Dans le traitement du RLS, les causes potentiellement réversibles doivent être abordées avant de commencer un traitement médicamenteux. Il s’agit notamment de la substitution en fer, en vitamine B12 ou en acide folique, ainsi que de l’identification et de l’arrêt (si possible) des médicaments susceptibles de déclencher un RLS. Comme la somnolence diurne peut aggraver l’intensité du RLS, le respect d’une bonne hygiène de sommeil est également important. Une consommation accrue de caféine et d’alcool est déconseillée. On distingue plusieurs classes de substances dans la pharmacothérapie :
- La lévodopa et les agonistes de la dopamine
- Ligands A2δ
- Opioïdes
- Benzodiazépines
En ce qui concerne le traitement dopaminergique, les agonistes dopaminergiques sont aujourd’hui préférés à la lévodopa en raison du risque d’augmentation plus faible (voir encadré “Augmentation”). Les deux agonistes dopaminergiques suivants sont le plus souvent utilisés : pramipexole (Sifrol®), en commençant par 0,125 mg le soir et en augmentant progressivement jusqu’à 0,5 mg ou 0,75 mg ; rotigotine (Neupro®) patch, 1-3 mg/24h. Les effets secondaires fréquents sont les nausées, les vertiges, l’hypotension orthostatique, la somnolence et les troubles du contrôle des impulsions. L’efficacité et le profil d’effets secondaires favorable de la prégabaline, un ligand A2δ, ont été démontrés dans une étude soigneusement randomisée en double aveugle [5]. La dose initiale est de 50-75 mg et est typiquement augmentée jusqu’à 300 mg/jour. Les effets secondaires sont des vertiges et une somnolence ; le risque d’augmentation est réduit par rapport aux agonistes dopaminergiques. En cas de RLS sévère et de réponse insuffisante aux ligands A2δ et/ou aux agonistes dopaminergiques, l’administration d’opioïdes en complément peut être utile, notamment l’oxycodone (Oxycontin®) 5-10 mg ou la dihydrocodéine (Codicontin®) 30-90mg. Les opioïdes présentent un risque d’augmentation des apnées centrales. Enfin, les benzodiazépines, notamment le clonazépam (Rivotril®) 0,5-1mg, peuvent également soulager la souffrance. Contrairement aux autres substances, les benzodiazépines agissent en augmentant le seuil d’éveil, mais sans réduire le nombre de PLMS.

Messages Take-Home
- Le syndrome des jambes sans repos est l’une des maladies neurologiques les plus courantes, avec une prévalence d’environ 7%.
- Les caractéristiques essentielles du RLS sont le besoin de bouger et sa survenue au repos, l’aggravation le soir et la nuit et l’amélioration par l’exercice.
- Parmi les diagnostics différentiels importants, citons les paresthésies liées à des blessures circonscrites aux jambes, les crampes aux jambes, la polyneuropathie périphérique, la radiculopathie, l’anxiété, l’akathisie, les douleurs musculaires, les positions inconfortables, le balancement habituel des pieds, l’œdème de la jambe ou l’inflammation des articulations.
- La maladie est généralement transmise selon un mode autosomique dominant, avec une forte pénétrance. Les troubles du métabolisme du fer et de la dopamine jouent un rôle central.
- On distingue plusieurs classes de substances dans la pharmacothérapie : (1) la lévodopa et les agonistes de la dopamine, (2) les ligands A2δ, (3) les opioïdes et (4) les benzodiazépines. En ce qui concerne le traitement dopaminergique, les agonistes dopaminergiques sont aujourd’hui préférés à la lévodopa en raison du risque d’augmentation plus faible.
Littérature :
- Ekbom KA : Astenia crurum paraesthetica (jambes irritables). Acta Med Scand 1944 ; 118 : 197.
- Jiménez-Jiménez FJ, et al. : Génétique du syndrome des jambes sans repos : une mise à jour. Sleep Med Rev 2018 ; 39 : 108-121.
- Connor JR, et al. : L’examen neuropathologique suggère une acquisition cérébrale déficiente du fer dans le syndrome des jambes sans repos. Neurologie 2003 ; 61 : 304309.
- Godau J, et al : Multiregional brain iron deficiency in restless legs syndrome. Mov Disord 2008 ; 23 : 11841187.
- Allen RP, et al : Comparaison de la prégabaline avec le pramipexole pour le syndrome des jambes sans repos. N Engl J Med 2014 ; 370 : 621-631.
- Garcia-Borreguero D, et al : Guidelines for the first-line treatment of restless legs syndrome/Willis-Ekbom disease, prevention and treatment of dopaminergic augmentation : a combined task force of the IRLSSG, EURLSSG, and the RLS-foundation. Sleep Med 2016 ; 21 : 1-11.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(4) : 12-15