L’état de mal épileptique est défini comme une crise d’épilepsie d’une durée de >5 min ou une série de crises entre lesquelles l’état neurologique initial n’est pas retrouvé. Pour le traitement primaire de l’état de mal épileptique, l’administration rapide et suffisante de benzodiazépines, disponibles sous différentes formes, constitue l’une des principales options.
L’état de mal épileptique est défini comme une crise d’épilepsie d’une durée >5 min ou une série de crises entre lesquelles l’état neurologique initial n’est pas retrouvé. Avec une incidence de 10 à 40 pour 100 000 personnes-années et une mortalité comprise entre 7 et 33%, l’état de mal épileptique (EME) est à la fois l’une des urgences neurologiques les plus fréquentes et un état mettant en jeu le pronostic vital [1,2]. Le taux de mortalité des patients non conscients (8,2%) est nettement inférieur à celui des patients conscients (33%) [2]. Les conséquences à long terme peuvent être des troubles neurologiques, cognitifs et comportementaux et une réduction significative de la qualité de vie. En outre, l’état de mal épileptique peut être associé à une détérioration significative du résultat clinique. Les complications telles que les fractures, l’immobilité, une pneumonie par aspiration acquise dans le cadre du statut, mais aussi une limitation des compétences de la vie quotidienne suite à un processus de récupération prolongé, après le blocage ou des pertes fonctionnelles dues à un séjour prolongé en soins intensifs, jouent notamment un rôle. L’issue d’un état de mal épileptique est principalement déterminée par l’étiologie de l’état de mal épileptique, le type ou le stade de l’état de mal épileptique, sa durée et l’âge du patient [3]. Les facteurs prédictifs de SE récurrents étaient l’âge <4 ans, le sexe féminin, l’absence de réponse médicamenteuse lors de la 1ère administration et les étiologies symptomatiques et progressives.
Traitement de l’état de mal épileptique conforme aux recommandations
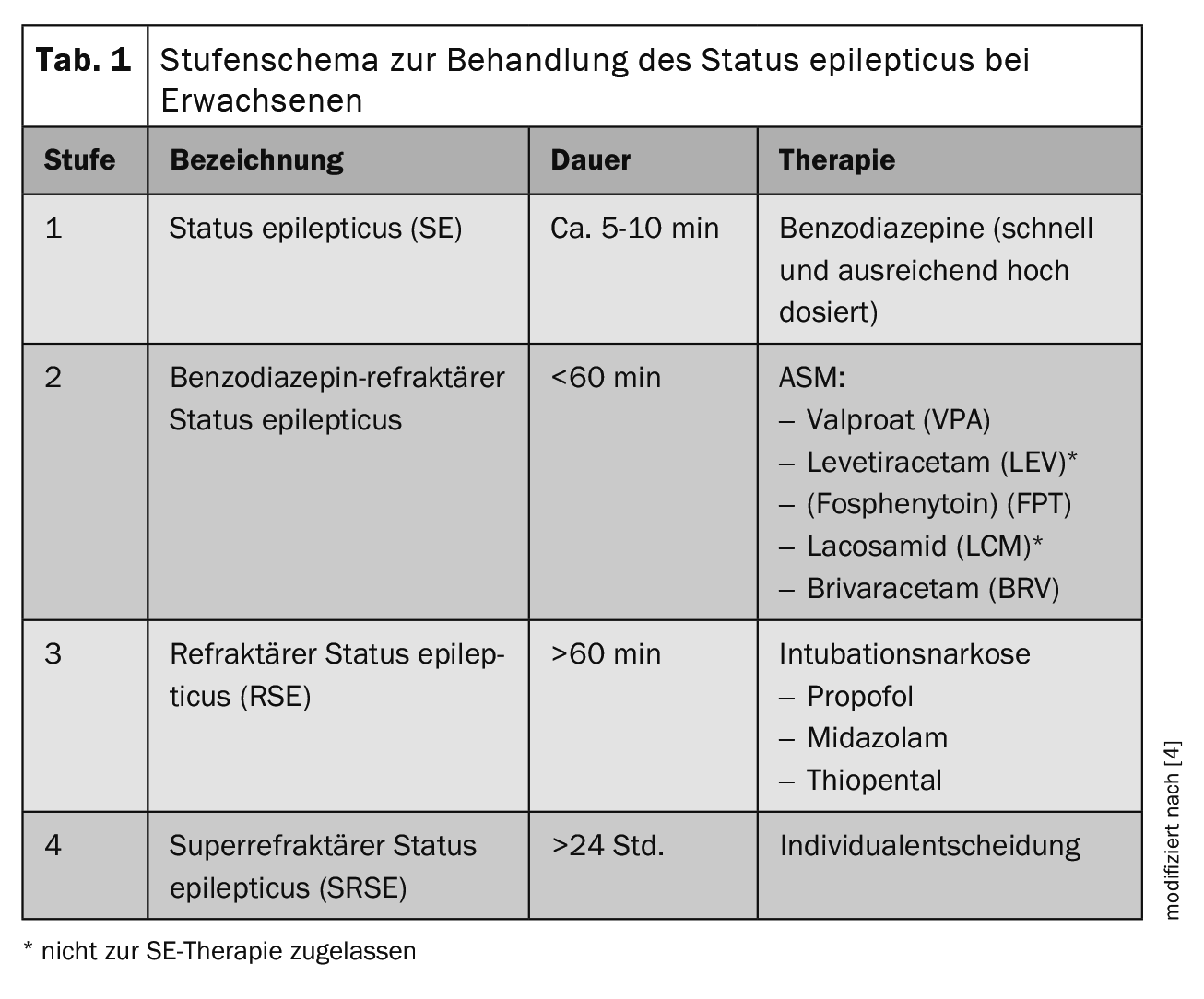
Le succès du traitement de la SE est critique en termes de temps et dépend d’un traitement neurologique et d’un diagnostic immédiats. La phase pré-hospitalière revêt donc une grande importance dans les soins. Dans le cadre des lignes directrices actuelles, le traitement du SE chez l’adulte est structuré en un schéma par étapes (tableau 1) [4]. Après avoir pris des mesures générales telles que l’assurance des paramètres vitaux (schéma ABCDE), la protection de la tête contre les blessures, l’administration d’O2 à une saturation en O2 <95% et une réduction symptomatique de la température à >37,5°C, le traitement initial (niveau 1) consiste en l’administration de benzodiazépines. Les doses initiales chez les adultes >40 kg de poids corporel (PC) sont de : lorazépam 0,1 mg/kg PC (max. 4 mg/bolus, à répéter 1 fois si nécessaire) ou clonazépam 0,015 mg/kg PC (max. 1 mg/bolus, à répéter 1 fois si nécessaire) ou midazolam 0,2 mg/kg PC (max. 10 mg/bolus par voie intramusculaire (i.m.), intraveineuse (i.v.) ou intranasale (i.n.), à répéter 1× si nécessaire) ou diazépam 0,15-0,2 mg/kg PC (max. 10 mg/bolus, à répéter 1× si nécessaire). Pour les patients sans accès i.v., le midazolam doit être administré par voie intramusculaire à l’aide d’un applicateur ou par voie intranasale (10 mg pour >40 kg, 5 mg pour <40-13 kg PC) en une seule prise). Si le SE persiste après l’administration initiale d’une benzodiazépine, il faut vérifier si la dose était adéquate, car le sous-dosage du traitement initial est fréquent par crainte des effets secondaires immanents des benzodiazépines et peut entraîner une réduction du contrôle des crises. Le cas échéant, la benzodiazépine doit être administrée à nouveau à une dose suffisamment élevée dans le cadre du traitement initial.
Si l’administration initiale de benzodiazépine a été suffisamment forte, il faut administrer une dose plus faible dans les 30 minutes. dans la 2ème niveau de traitement, des médicaments suppresseurs de crises (ASM) disponibles par voie intraveineuse peuvent être administrés. En tant que médicaments de la Le lévétiracétam (LEV, 60 mg/kg PC, max. 4500 mg en >10 min i.v.) (non autorisé pour le traitement de la SE), le valproate (VPA, 40 mg/kg PC, max. 3000 mg en >10 min i.v.) ou la fosphénytoïne (FPHT, 20 mg/kg PC, max. 1500 mg en >10 min i.v.) doivent être administrés en 1er choix [4]. La fosphénytoïne est certes autorisée en Allemagne et en Autriche, mais elle n’y est pas commercialisée et n’est pas autorisée en Suisse, de sorte que cela ne joue aucun rôle dans la mise en œuvre pratique du traitement dans les pays germanophones. Une autre alternative possible est l’administration de lacosamide à une dose de 5 mg/kg i.v., qui peut être administrée pendant 15 minutes [5]. Il convient toutefois de noter qu’une contre-indication en cas de bloc AV 2. ou 3ème degré. Là encore, il n’existe pas d’autorisation de mise sur le marché pour la thérapie SE. Les premières séries de cas et les rapports de cas décrivent une utilisation réussie du brivaracetam par voie intraveineuse dans le SE réfractaire [6].
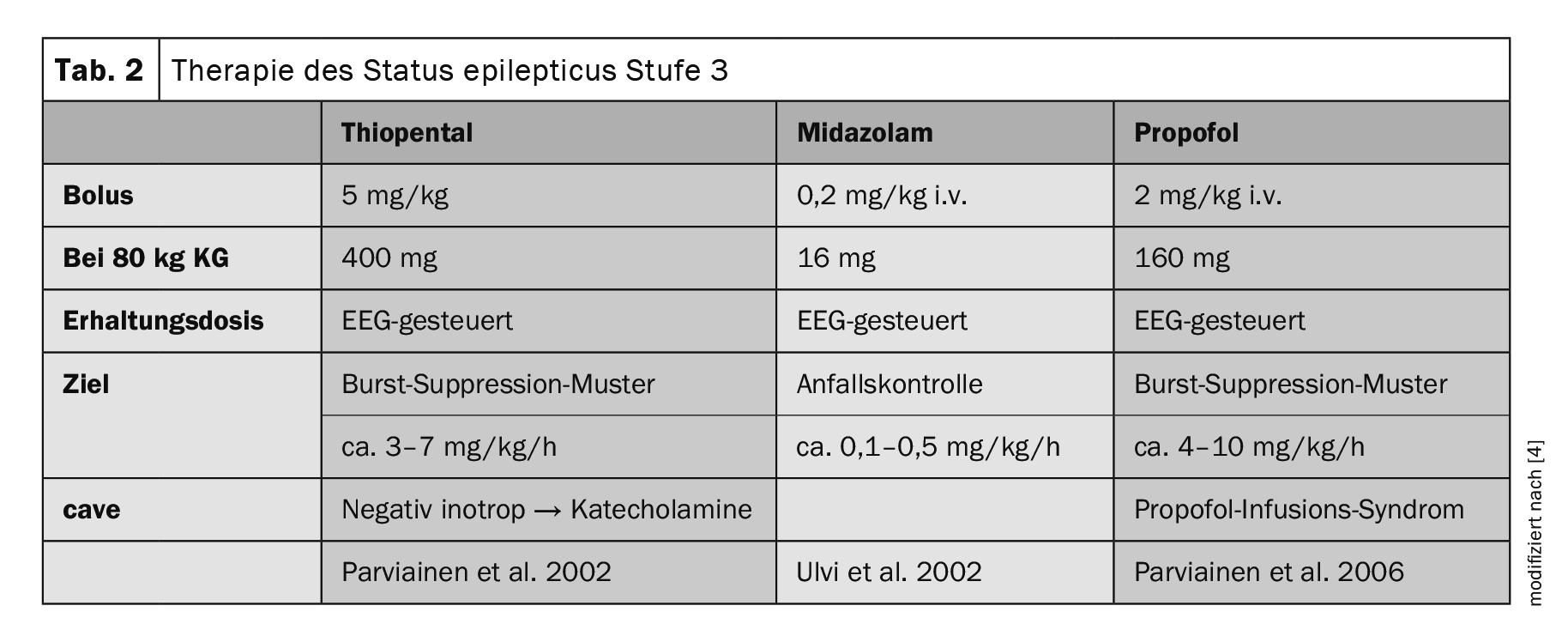
Après le traitement de niveau 2, en cas d’échec de l’ASM i.v., une anesthésie par intubation est pratiquée avec soit du thiopental, soit du midazolam, soit du propofol (tableau 2) [5]. En cas d’échec de ce niveau de traitement, d’autres options thérapeutiques sont proposées dans la ligne directrice actuelle, mais elles sont en grande partie basées sur des rapports de cas individuels. À ce stade, le SE est dit superréfractaire (SRSE). Outre l’administration de barbituriques, de kétamine, d’antagonistes NMDA, d’anesthésiques par inhalation tels que l’isoflurane ou le desflurane, on peut envisager l’administration entérale d’autres ASM “classiques” disponibles uniquement par voie orale ou des essais thérapeutiques individuels avec la lidocaïne, le régime cétogène et la chirurgie de l’épilepsie.
Problèmes actuels dans le traitement de l’état de mal épileptique
Le traitement rapide et à dose suffisamment élevée du SE est d’une grande importance en termes de pronostic. Le traitement initial, en particulier, s’écarte encore souvent des recommandations de la ligne directrice. Guterman et al. 2021 ont pu montrer que le traitement du SE préclinique était rarement conforme aux lignes directrices prédéfinies. Sur les 9176 admissions préhospitalières pour état de mal épileptique dans 743 établissements, 7665 patients (83,6%) ont été traités par midazolam, 1264 (13,8%) par lorazépam et 245 (2,7%) par diazépam. Il y a eu 357 cas (3,9% ; IC 95% : 3,5%-4,3%) où le traitement initial était conforme aux recommandations des experts en ce qui concerne la dose et le type recommandés. La majorité des patients ont donc reçu des doses de benzodiazépines inférieures à celles recommandées [7].
Dans l’étude SENSE, une étude de cohorte trinationale, Kellinghaus et al. ont rapporté que dans 15% des cas, aucune benzodiazépine n’a été administrée lors de la première étape du traitement. Les données ont pu démontrer que l’utilisation des benzodiazépines selon les lignes directrices était liée au succès du traitement et à un nombre significativement plus élevé de SE percées [8].
En résumé, toutes les études ont montré que l’administration pré-hospitalière de benzodiazépines réduisait le temps nécessaire au contrôle des crises et la durée d’hospitalisation des patients atteints de SE.
Pour optimiser le traitement initial, la simplification de l’administration des benzodiazépines grâce à l’approbation des injecteurs et des applications nasales/buccales représentent une simplification de l’administration initiale par les secouristes et les soignants à domicile, ce qui permettra d’optimiser davantage le traitement initial à l’avenir [9].
Gawedzki et al. ont pu montrer en 2022, dans une étude observationnelle monocentrique rétrospective menée aux urgences, que la présence d’un pharmacien accompagnant l’équipe chargée de l’état de mal épileptique réduisait le délai médian d’administration du 1. et 2. ASM considérablement réduit. De plus, le groupe de patients avec un pharmacien a reçu une dose médiane plus élevée d’équivalents de lorazépam (2,5 mg [IQR 2–4] vs 2 mg [IQR 2–2]; p=0,04) et était plus susceptible de recevoir une dose initiale suffisamment élevée d’au moins 4 mg d’équivalents de lorazépam (38% vs 0% ; p=0,11). Cependant, aucune différence n’a été observée dans le LOS hospitalier ou la mortalité à 30 jours [10]. On en a conclu que la présence d’un pharmacien ou d’un observateur du traitement augmentait la prise de conscience d’un traitement conforme aux lignes directrices.
Un autre facteur cliniquement pertinent est la détection précoce de l’état de mal épileptique non convulsif (NCSE), car dans le cas de l’ES, un retard de diagnostic et de traitement entraîne une augmentation de la mortalité. Le SE non convulsif est l’une des urgences neurologiques les plus souvent négligées, notamment parce qu’il est souvent associé à des maladies internes graves qui rendent le diagnostic difficile [11]. L’étude d’incidence de Leitinger et al. a montré que le SE non convulsif était associé à un taux de mortalité élevé (CFR 27,65%). Avec une incidence de 12,1/100 000, il s’agit d’une urgence fréquente en épileptologie [2].
NCSE/NCS (crise non convulsive) ont été détectés chez 21% des 170 sujets dans une unité de soins intensifs. Les crises cliniques ont précédé le diagnostic EEG de NCSE/NCS dans seulement 25% des cas. Les principaux facteurs de risque de NCSE/ NCS étaient les maladies préexistantes du SNC, par exemple les tumeurs du SNC, l’épilepsie préexistante, la méningite/l’encéphalite ou la détection de l’encéphalomalacie à l’IRM [12,13].
Si l’état de mal épileptique persiste après 1 heure ou 24 heures de traitement, on parle de SE réfractaire ou supra-réfractaire. Les SE réfractaires et supra-réfractaires ont un résultat nettement moins bon que les états de mal épileptique faciles à rompre. Strzelczyk et al. ont étudié rétrospectivement les résultats et la durée d’hospitalisation des patients présentant un état de mal épileptique réfractaire et super réfractaire. La base de données “Gesundheitsforen Leipzig” a été utilisée à cet effet. Elle contient les diagnostics hospitaliers et ambulatoires, les coûts et les données démographiques des patients atteints de SE. La majorité des patients atteints de SE non réfractaire ont pu rentrer chez eux (78,1%), contre 70,1% pour l’ESR et seulement 31,7% pour le SRSE. Plus d’un tiers des patients atteints de SRSE (39,9%) sont décédés, contre 15% des patients atteints d’ESR et 9,6% des patients atteints d’ESNR [14].
Nouvelles approches thérapeutiques pour le traitement du SE supra-réfractaire
Actuellement, de nouvelles approches thérapeutiques, mais aussi des approches déjà connues, sont discutées en tant qu’options thérapeutiques possibles pour l’état de mal épileptique réfractaire. En premier lieu, il convient de mentionner d’autres tentatives de traitement médicamenteux :
Une étude de cohorte bicentrique suisse a inclus 205 patients, dont 27% ont reçu un anesthésique après l’échec du médicament de première ligne. Les résultats ont montré que l’anesthésie en tant que traitement de seconde ligne est associée à une durée médiane de SE plus courte (0,5 versus 12,5 jours, p<0,001), à un temps d’hospitalisation en soins intensifs plus court (2 versus 5,5 jours, p<0,001) et à une durée d’hospitalisation plus courte (8 versus 17 jours, p<0,001) avec des taux de complications identiques par rapport à l’anesthésie en tant que traitement de troisième ligne. [15].
Récemment, l’utilisation du phénobarbital pour le traitement du SRSE a été discutée. Le phénobarbital est l’un des plus anciens ASM, utilisé en clinique depuis 1912. Plusieurs rapports font état d’un effet suppresseur de crises important avec une faible sédation. Parallèlement, des effets secondaires potentiels tels que l’hypotension, l’arythmie, l’augmentation du taux d’infection et l’hypopnée ont été rapportés lors du traitement par le phénobarbital. Le phénobarbital entraîne une augmentation de l’inhibition GABA-ergique et une diminution de l’excitation glutamatergique, ainsi qu’une inhibition des récepteurs AMPA. Le phénobarbital semble être, dans certains cas, une option thérapeutique pour le traitement de l’ESR qui ne doit pas être oubliée. Comme pour les autres ASM, un RCT serait souhaitable et nécessaire pour évaluer la place dans le traitement du SE [16].
Parmi les options thérapeutiques non médicamenteuses, les options suivantes sont discutées dans la ligne directrice actuelle : La stimulation transcrânienne à courant continu (tDCS), le stimulateur du nerf vague (VNS), le régime cétogène et le refroidissement focal :
Le TDCS est une technique de neuromodulation non invasive qui applique une faible stimulation par courant continu sur le cuir chevelu afin d’induire des effets polarisés linéaires et non linéaires. La stimulation cathodique, en particulier, induit une hyperpolarisation dans les cellules neuronales et provoque des effets aigus et à long terme potentiellement pertinents dans la physiopathologie du SRSE. Ng et al. ont testé la faisabilité de l’utilisation de la stimulation transcrânienne à courant continu à haute résolution (hd-tDCS) dans le traitement de l’ESR. Chez 10 patients atteints d’ESR, aucun événement indésirable n’est survenu au cours des 32 séances de hd-tDCS. Le TDCS pourrait éventuellement être associé à une réduction aiguë de l’entrée présynaptique excitatrice ou à une dépression de la force synaptique médiée par les récepteurs N-méthyl-D-aspartate (NMDA), qui peuvent produire des effets à long terme, y compris une action transmembranaire, une migration des protéines et/ou des effets anti-inflammatoires [17].
Le traitement du SE supra-réfractaire par régime cétogène (KD) constitue une approche très prometteuse. Dans une étude de cohorte rétrospective non randomisée, Koh et al. 140 patients atteints d’ESR. Parmi eux, 32 patients ont été traités par KD. Parmi ceux-ci, le SE a été franchi à 28 (81%). L’utilisation du KD a influencé la réduction de l’échelle de classement modifiée (mRS) à la sortie de l’hôpital, chez les personnes âgées, en cas de scores de gravité élevés, sous traitement anesthésique intraveineux continu (CIVAD) et chez les patients atteints de SRSE. De plus, les scores d’âge et de sévérité des crises, mais pas le CIVAD ou le SRSE, étaient associés à un changement du score mRS médié par KD à 3 mois. Sur la base de ces données, les auteurs discutent d’un éventuel effet neuroprotecteur du KD chez les patients SRSE [18].
En tant que méthode hautement expérimentale, Niesvizky-Kogan et al. récemment le principe du refroidissement focal comme option de traitement des épilepsies réfractaires et de la SE. Pendant le refroidissement, il y aurait une diminution de la libération des neurotransmetteurs de la présynapse et une perte des épines dendritiques dans la postsynapse. En outre, il est censé influencer les propriétés électriques, les acides nucléiques, les neurotransmetteurs, et la fonction des canaux de la membrane cellulaire. Cette méthode est analogue à celle du refroidissement global en cas d’arrêt post-cardiovasculaire et de lésion ischémique néonatale, discutée dans le cadre de la neuroprotection, mais elle est considérée comme plus sûre [19].
L’état de mal épileptique réfractaire d’apparition récente ( new onset refractory status epilepticus, NORSE) constitue un défi thérapeutique. La majorité des patients présentant un état de mal épileptique réfractaire récent développent un SRSE avec une évolution clinique défavorable et un taux de létalité de 12 à 27% [3]. Comme Sculier et al. Dans la plupart des cas, le traitement est difficile, 75% des patients NORSE ont besoin d’un traitement anesthésique. Les auteurs ont pu montrer qu’une encéphalite auto-immune est à l’origine d’une bonne moitié des cas, ce qui fait qu’un traitement immunosuppresseur précoce est recommandé, comme la prednisolone ou, au cours de l’évolution, éventuellement des immunoglobulines intraveineuses et une séparation du plasma ou, en deuxième ligne, des médicaments immunomodulateurs comme par exemple le rituximab [3]. Les patients atteints de NORSE doivent également recevoir un traitement initial du SE conforme aux directives. En cas d’évolution réfractaire de la SE, Sculier et al. une immunothérapie dans les 72 premières heures.
Une autre approche thérapeutique intéressante consiste à moduler les facteurs qui influencent l’état de mal épileptique, tels que le métabolisme du glucose et les niveaux de phosphate de pyridoxal. Dans une étude de cohorte rétrospective monocentrique menée par Müller et al. a cherché à déterminer si les complications du traitement intraveineux par valproate, utilisé pour traiter la SE, étaient différentes chez les patients diabétiques et non diabétiques. Au cours de la période d’étude, 408 patients et 482 épisodes de SE ont été traités par APV par voie intraveineuse. Les comparaisons entre groupes n’ont pas montré de différence significative dans les taux d’abandon du traitement. Des différences ont été observées dans le taux de thrombocytopénies (p=0,015), qui étaient plus fréquentes chez les patients diabétiques. Au total, 36 épisodes d’hypoglycémie ont été identifiés, dont deux sont survenus spontanément sous APV. Les auteurs ont conclu que le diabète, en tant que comorbidité importante, présente un risque potentiellement accru de mauvais résultats après une SE [20].
Une étude de cohorte rétrospective réalisée par Rubinos et al. Une étude menée sur 293 patients a examiné la relation entre les niveaux de phosphate de pyridoxal (PLP) et la SE établie (eSE). Le taux médian de PLP du groupe eSE (12 nmol/l) était inférieur à celui du groupe ICU-noSE (22 nmol/l, p=0,003), hors USI (16 nmol/l, p=0,05) et des groupes ambulatoires (36 nmol/l, p <0,001). Les patients atteints d’eSE présentaient donc une prévalence significativement plus élevée de taux marginaux et faibles de PLP (90 et 80% respectivement) par rapport aux autres patients des USI et hors USI (USI-noSE : 70, 50% ; non USI : 63, 54% ; ambulatoire : 38, 21%) [21]. Cependant, il n’existe pas encore d’études thérapeutiques sur l’administration de PLP.
Conclusion
L’état de mal épileptique est l’une des urgences les plus fréquentes en neurologie. Les formes évolutives de l’état de mal épileptique réfractaire et super-réfractaire, en particulier, continuent de représenter un défi pour la pratique clinique. Un traitement initial à dose suffisamment élevée, administré le plus rapidement possible après le diagnostic, peut réduire le taux d’évolutions réfractaires. L’état de mal épileptique, en particulier lorsque la conscience n’est pas conservée, est un tableau clinique potentiellement létal qui nécessite initialement un traitement et une surveillance en soins intensifs. Un traitement conforme aux lignes directrices doit être mis en place dès le début. De nouvelles approches thérapeutiques de l’ESR, comme le régime cétogène ou la tDCS, qui ont montré des résultats prometteurs, devraient être envisagées. Des études supplémentaires sont ici nécessaires pour évaluer l’efficacité en dehors des cas individuels.
Messages Take-Home
- L’état de mal épileptique est défini comme une crise d’épilepsie d’une durée >5 min ou une série de crises entre lesquelles l’état neurologique initial n’est pas retrouvé.
- Pour le traitement primaire de l’état de mal épileptique, l’administration rapide et suffisante de benzodiazépines, disponibles sous différentes formes (intraveineuse, intramusculaire, intranasale, buccale/sublinguale, rectale), constitue l’une des principales options.
- Le traitement d’un état de mal épileptique doit être effectué dans une unité de soins intensifs.
Littérature :
- Knake S, Rosenow F, Vescovi M, et al. : Status Epilepticus Study Group Hessen (SESGH). Incidence de l’état de mal épileptique chez les adultes en Allemagne : une étude prospective basée sur la population. Épilepsie. 2001 juin ; 42(6) : 714-718. doi : 10.1046/j.1528-1157.2001.01101.x. PMID : 11422324.
- Leitinger M ; Trinka E ; Giovannini G, et al : Epidemiology of status epilepticus in adults : A population-based study on incidence, causes, and outcomes (2019). In : Epilepsia 60(1), 53-62. doi : 10.1111/epi.14607.
- Sculier C, Gaínza-Lein M, Sánchez Fernández I, Loddenkemper T : Long-term outcomes of status epilepticus : A critical assessment (2018). Dans : Epilepsia 59 Suppl 2, 155-169. doi 10.1111/epi.14515.
- Rosenow F, Weber J, et al : État de mal épileptique chez l’adulte. Ligne directrice S2k. (2020) : Ed. par la Société allemande de neurologie (DGN). Disponible en ligne sur www.dgn.org/leitlinien, dernière mise à jour le 30.06.2020, dernière révision le 27.10.2023.
- Misra Usha K, Dubey D, Kalita J : A randomized controlled trial of lacosamide versus sodium valproate in status epilepticus (2017). Dans : Epilepsia. doi : 10.1111/epi.13706.
- Strzelczyk A, Steinig I, Willems LM, et al. : Treatment of refractory and super-refractory epilepticus status with brivaracetam : A cohort study from two German university hospitals. (2017b). In : Epilepsy & behavior : E&B 70 (Pt A), 177-181. doi : 10.1016/j.yebeh.2017.03.028.
- Guterman EL, Burke JF, Sporer KA : Prehospital Treatment of Status Epilepticus in the United States (2021). In : JAMA 326 (19), 1970-1971. doi : 10.1001/jama.2021.15964.
- Kellinghaus C, Rossetti AO, Trinka E, et al : SENSE registry for status epilepticus. Épilepsie. 2018 Oct ; 59 Suppl 2 : 150-154.
doi : 10.1111/epi.14495. Epub 2018 Aug 29. PMID : 30159884 - Halliday AJ, Santamaria J, D’Souza WJ : Pre-hospital benzodiazepines associated with improved outcomes in out-of-hospital status epilepticus : A 10-year retrospective cohort study (2021). Dans : Epilepsy research 179, 106846. doi : 10.1016/j.eplepsyres.2021.106846.
- Gawedzki P, Celmins L, Fischer D : Implication des pharmaciens dans le traitement antiépileptique de l’état de mal épileptique dans les services d’urgence (2022). In : The American journal of emergency medicine 59, 129-132. doi : 10.1016/j.ajem.2022.07.002.
- Drislane FW : Présentation, évaluation et traitement de l’état de mal épileptique non convulsif (2000). Dans : Epilepsy & behavior : E&B 1 (5), 301-314. doi : 10.1006/ebeh.2000.0100.
- Laccheo I, Sonmezturk H, Bhatt AB, et al. : Non-convulsive status epilepticus and non-convulsive seizures in neurological ICU patients (2015). In : Neurocritical care 22 (2), 202-211. doi : 10.1007/s12028-014-0070-0.
- Spindler M, Jacks LM, Chen X, et al : Spectrum of nonconvulsive status epilepticus in patients with cancer (2013). In : Journal of clinical neurophysiology : official publication of the American Electroencephalographic Society 30 (4), 339-343. doi : 10.1097/WNP.0b013e31829ddcdb.
- Strzelczyk A, Ansorge S, Hapfelmeier J, et al. : Coûts, durée de séjour et mortalité de l’état de mal épileptique super-réfractaire : une étude de population en Allemagne (2017a). In : Epilepsia 58 (9), 1533-1541. DOI : 10.1111/epi.13837.
- Sutter R, Jünger AL, Baumann SM, et al. : Equilibrer les risques et les bénéfices de l’anesthésie dans l’état de mal épileptique (2023). In : Epilepsy & behavior : E&B 138, 109027. doi : 10.1016/j.yebeh.2022.109027.
- Trinka E : Phénobarbital dans l’état de mal épileptique – Redécouverte d’un médicament efficace. Epilepsy Behav 2023 Avr ; 141 : 109104. doi : 10.1016/j.yebeh.2023.109104.
- Ng MC, El-Alawi H, Toutant D, et al. : Une étude pilote de la stimulation transcrânienne directe en haute définition du courant dans l’état épileptique réfractaire : l’essai SURESTEP (2023). In : Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics 20(1), 181-194. doi : 10.1007/s13311-022-01317-5.
- Koh S, Kim T-J, Shin H-B, et al. : Expanding Indications for a Ketogenic Diet as an Adjuvant Therapy in Adult Refractory Status Epilepticus : an Exploratory Study Using Moderation Analysis (2022). In : Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics 19 (5), 1526-1534. doi : 10.1007/s13311-022-01282-z.
- Niesvizky-Kogan I, Bass M, Goldenholz SR, Goldenholz M : Focal Cooling for Drug-Resistant Epilepsy : A Review (2022). Dans : JAMA neurology 79 (9), 937-944. doi : 10.1001/jamaneurol.2022.1936.
- Müller A, Hofen-Hohloch Jv, Awissus C, et al : Le diabète sucré affecte-t-il le profil de sécurité de l’acide valproïque pour le traitement de l’état de mal épileptique ? Une étude de cohorte rétrospective (2022). In : Neurological research and practice 4(1), 52. doi : 10.1186/s42466-022-00212-w.
- Rubinos C, Bruzzone MJ, Blodgett C, et al : Association of Serum Pyridoxal Phosphate Levels with Established Status Epilepticus (2023). In : Neurocritical care 38(1), 41-51. DOI : 10.1007/s12028-022-01579-z.
InFo NEUROLOGIE & PSYCHIATRIE 2024; 22(1): 6–10