Les thérapies systémiques du psoriasis ont beaucoup évolué ces dernières années. Auparavant, on utilisait généralement la photothérapie ou les traitements systémiques conventionnels comme le méthotrexate, l’acitrétine, la ciclosporine A et les esters d’acide fumarique. Aujourd’hui, ils sont de plus en plus remplacés au cours du traitement par un traitement avec les nouveaux produits biologiques et le groupe des petites molécules.
En fonction de leur importance dans le déclenchement des poussées de la maladie, les facteurs de précipitation du psoriasis doivent être systématiquement éliminés : Il s’agit en premier lieu des infections, du stress, des médicaments et du manque de soins de la peau.
Outre les infections streptococciques, souvent accusées d’être à l’origine de la maladie, le stress psychologique est considéré comme un facteur de provocation important, en particulier chez les enfants et les adolescents. Les jeunes souffrent plus souvent de la stigmatisation, ce qui peut conduire à des situations de conflits psychosociaux importants, en particulier à l’adolescence. Les adolescents subissent une perte de qualité de vie aussi importante à cause du psoriasis qu’à cause de l’acné.
Des médicaments tels que les β2-bloquants, les inhibiteurs de l’ECA, les antimalariques, le lithium et les AINS peuvent également provoquer un psoriasis, d’où l’importance d’une anamnèse médicamenteuse approfondie.
Enfin, il convient de prendre soin de la peau même en l’absence de symptômes ou lorsque la maladie est minime. L’utilisation régulière de préparations de soin de la peau aide non seulement à rétablir la fonction de barrière perturbée de la peau, mais a également pour but de prévenir l’apparition de nouvelles manifestations cutanées dues à des irritations telles que la déshydratation (bains ou douches fréquents, séjour dans des pièces chauffées et peu humides). C’est pourquoi la peau doit être soignée quotidiennement avec des produits adaptés.
Des gammes complètes de soins spécialement conçues pour les patients atteints de psoriasis (par exemple Aqeo®), mais aussi des formules dermatologiques éprouvées ou d’autres produits de soin de la peau conviennent pour les soins quotidiens de la peau, à condition qu’ils soient bien tolérés par le patient.
Thérapie topique
Pour les plaques squameuses infiltrées, un traitement desquamant avec des kératolytiques est d’abord utile, notamment pour améliorer la pénétration des principes actifs. Dans ce cas, il est recommandé d’utiliser de l’acide salicylique à des concentrations comprises entre 5 et 10%, selon la localisation, dans une base de vaseline, de carbowax ou d’huile. Les autres kératolytiques sont l’urée (Urea), l’acide lactique et le soufre colloïdal.
Alors que l’acide salicylique est essentiellement utilisé pour détacher les pellicules, l’urée (à des concentrations comprises entre 8 et 12%), l’acide lactique (2,5-10%) et le soufre conviennent pour le soin et le traitement sous forme d’additifs dans les crèmes, les lotions ou les bains d’huile soufrée.
Chez les enfants de moins de 12 ans, l’application locale à grande échelle d’un excipient contenant de l’acide salicylique peut entraîner une toxicité par résorption (salicylisme) avec atteinte du système nerveux central et des reins. C’est pourquoi il est plutôt recommandé d’utiliser des crèmes émulsifiantes comme Unguentum emulsificans aquosum, éventuellement avec de l’urée (5%), pour la desquamation chez les enfants.
Une fois que les plaques sont desquamées, des corticostéroïdes topiques sont utilisés. Ils font partie des traitements locaux les plus utilisés pour le psoriasis. Ils se caractérisent par une très bonne efficacité et une bonne tolérance ainsi que, lorsqu’ils sont utilisés correctement, par des effets indésirables limités, avec un rapport qualité-prix relativement favorable.
L’évaluation négative de la cortisone par la population n’a aucun fondement médical et dermatologique. Seule une durée de traitement trop longue (traitement ininterrompu de plus de six semaines) entraîne une atrophie cutanée, qui peut toutefois être irréversible dans de nombreux cas. Typiquement, les stéroïdes de classe III-IV, à la fois anti-inflammatoires et antiprolifératifs, comme le dipropionate de clobétasol (Dermovate®), la bétaméthasone (Betnovate®) ou, surtout chez les enfants, le furoate de mométasone (Elocom®), sont bien efficaces, de préférence en association avec des analogues topiques de la vitamine D comme le calcipotriol (Daivobet®), le tacalcitol (Curatoderm®) et le calcitriol (Silkis®). Ils existent également en combinaison fixe de bétaméthasone et de calcipotriol, tant pour l’application cutanée (Daivobet®) que pour l’application au bistouri (Xamiol®) [1]. Pour les foyers localisés, les corticostéroïdes peuvent également être appliqués de manière occlusive pour renforcer leur efficacité, par exemple sous forme de patch (Betesil®).
En principe, une corticothérapie ininterrompue au-delà d’un mois n’est pas recommandée, d’une part en raison de l’atrophie et d’autres effets secondaires cutanés, d’autre part en raison de l’absorption et du risque d’atrophie corticosurrénale. Comme alternative aux corticostéroïdes, les inhibiteurs topiques de la calcineurine, le tacrolimus ou le pimécrolimus (Protopic®, Elidel®), sont appropriés dans les zones intertrigineuses (psoriasis inversé).
Photothérapie
La photothérapie occupe une place importante dans le traitement du psoriasis modéré et sévère. Elle est simple à utiliser, cosmétiquement acceptable, peu contraignante et peu coûteuse. Enfin, elle peut être avantageusement combinée avec des traitements topiques. Aujourd’hui, on utilise surtout des lampes UVB qui émettent 311 nm [2]. Les rayons UVA de grande longueur d’onde peuvent également être très efficaces lorsqu’ils sont associés à des psoralènes photosensibilisants et à des rétinoïdes [3].
Thérapie systémique
Les traitements systémiques sont indiqués dans les cas de psoriasis modérés à sévères qui ne peuvent pas être suffisamment contrôlés par les mesures locales et la photothérapie, ainsi que dans l’arthrite psoriasique. On distingue les traitements systémiques standard à base de méthotrexate, d’acitrétine, de ciclosporine A et d’esters d’acide fumarique des traitements à base de produits biologiques plus récents.
Le méthotrexate (MTX) est une option rentable, mais dont les perspectives à long terme sont limitées. Faible dosage (7,5 à max. 30 mg/semaine), le MTX se montre particulièrement efficace dans toutes les formes pustuleuses de psoriasis, dans l’érythrodermie psoriasique ainsi que dans l’arthrite psoriasique, mais aussi dans le psoriasis en plaques étendu. Le MTX exerce une action antiproliférative et anti-inflammatoire en inhibant l’enzyme dihydrofolate réductase, empêchant ainsi la formation d’un métabolite important, l’acide tétrahydrofolique, à partir de l’acide folique. Il entraîne une amélioration de 75% de l’atteinte superficielle du psoriasis dans environ 60% des cas (60% PASI75) [4,5]. Une réponse est observée dans les deux à six semaines [6]. L’administration initiale est de 7,5 mg/semaine, la forme parentérale est préférable en raison de la cinétique d’absorption variable lors de l’administration orale. Au cours des deux premières semaines, la dose doit être augmentée jusqu’à la dose d’entretien normale de 10-15 mg par semaine, la dose devant être ajustée toutes les trois à quatre semaines. L’administration de 5 mg d’acide folique p.o. 24-48 heures plus tard améliore la tolérance. Le principal inconvénient du MTX est sa dose cumulée limitée à environ 1,5 g, qui est typiquement atteinte après deux à quatre ans. A cette limite, il est aujourd’hui recommandé de procéder à des dosages de procollagène III ou à des biopsies du foie afin d’exclure une fibrose hépatique.
Les rétinoïdes sont des analogues de la vitamine A liposoluble vitale. Ils ont une action antiproliférative et immunomodulatrice. Le rétinoïde systémique le plus utilisé, l’acitrétine (Neotigason®), administré à une dose de 20-75 mg, présente un PASI75 chez 25-41% des patients dans un délai de huit à douze semaines [7,8]. Les doses plus faibles n’ont aucun effet. L’acitrétine est utilisée de préférence dans les formes pustuleuses du psoriasis et dans l’érythrodermie psoriasique. La dose initiale est généralement de 0,5-1 mg/kg/j. Après réponse, la dose peut être réduite à 0,3-0,5 mg/kg/j en traitement d’entretien. En raison des effets secondaires fréquents, bien que généralement réversibles, et de l’infériorité du médicament en monothérapie par rapport aux autres préparations, il n’est pratiquement utilisé qu’en association pour la photochimiothérapie. Dans ce cas, des taux de rémission de plus de 94% sont atteints [3]. Dans tous les cas, les patientes doivent être informées de l’effet tératogène et une anticonception efficace est obligatoire pendant deux ans.
La ciclosporine A (Sandimmun Neoral®), un peptide gastro-résistant dérivé de la moisissure du sol Tolypocladium inflatum, inhibe les facteurs de transcription nucléaires dans les lymphocytes T. Elle est utilisée dans le traitement de la maladie d’Alzheimer. On obtient ainsi une immunosuppression cellulaire rapide. Avec une administration orale de 2,5-3 mg/kgKG/d en deux doses uniques (dose la plus faible décrite pour un traitement à long terme [9,10]), un PASI75 est atteint dans 50-70% des cas après 8-16 semaines de traitement [11,12]. La ciclosporine A présente l’inconvénient de nombreux effets secondaires, dont le développement d’une hypertension artérielle, d’une insuffisance rénale, de tremblements, d’infections et d’une hypertrichose. La plupart du temps, il ne peut pas être utilisé plus de quelques mois, c’est pourquoi il ne convient généralement pas comme traitement à long terme pour les personnes atteintes de psoriasis. Aujourd’hui, il est principalement utilisé comme traitement de secours dans les situations où l’état de la peau doit être amélioré rapidement (dans les quatre semaines), comme dans le cas du psoriasis érythrodermique.
Depuis leur mise au point par le chimiste Schweckendiek, lui-même atteint de psoriasis, les esters d’acide fumarique (Fumaderm®) ont fait la preuve de leur efficacité dans des études en double aveugle [13–15]. Cette classe de substances est un sous-produit du cycle du citrate et présente l’avantage d’un profil d’action très sûr, bien qu’elle se manifeste souvent par des effets secondaires gênants lors de l’initiation du traitement, tels que flush, céphalées, nausées, diarrhée et lymphopénie passagère. Mais s’il est toléré, il peut être pris pendant des décennies et supprimer complètement le psoriasis. Le PASI75 est atteint par 50 à 70% des patients après 16 semaines [13–15]. Il n’est pas autorisé en Suisse, mais peut être obtenu facilement auprès de pharmacies internationales après obtention d’une garantie de prise en charge par la caisse d’assurance maladie.
Biologics
Le psoriasis étant considéré comme une maladie immunitaire à médiation par les cellules T, dans laquelle les cytokines jouent également un rôle essentiel, il en résulte des cibles spécifiques pour le traitement. Les produits biologiques, à savoir les anticorps recombinants ou les récepteurs solubles, peuvent inhiber efficacement les cytokines activant les lymphocytes T. Ils peuvent également être utilisés dans le traitement du cancer du sein. Les antagonistes du facteur de nécrose tumorale (TNF) α, l’infliximab (Remicade®), l’étanercept (Enbrel®) et l’adalimumab (Humira®), l’ustékinumab (Stelara®), un bloqueur de l’IL-12/23, et le sécukinumab (Cosentyx®), un antagoniste de l’IL-17A, sont actuellement autorisés en Suisse pour le traitement du psoriasis en plaques modéré à sévère chez l’adulte, sous certaines conditions.
Antagonistes du TNF-α : les produits biologiques actuellement les plus utilisés pour le traitement du psoriasis et de l’arthrite psoriasique sont les antagonistes du TNF-α.
L’étanercept (Enbrel®) est un récepteur soluble du TNF-α qui est administré par voie s.c.. On utilise 50 mg par semaine, ou 50 mg deux fois par semaine dans les cas graves. Le médicament entraîne une amélioration de 75% du PASI chez 30% des patients en l’espace de douze semaines [16]. Il est le seul médicament biologique autorisé pour le psoriasis pédiatrique [17]. Pour l’avenir, la question se pose, en particulier pour l’arthrite psoriasique de l’enfant, de savoir dans quelle mesure un traitement précoce par l’étanercept peut prévenir une évolution destructrice et invalidante.
L’infliximab (Remicade®) est un anticorps chimérique murin-humain dirigé contre le TNF-α, qui est administré en perfusion toutes les huit semaines après une dose initiale supplémentaire. L’infliximab convient aux patients lourds, car il peut être administré en fonction du poids. Actuellement, il s’agit de l’un des médicaments biologiques les plus efficaces, mais il présente l’inconvénient d’une diminution de l’efficacité à long terme en raison de la formation d’anticorps.
L’adalimumab (Humira®) est un anticorps anti-TNF-α entièrement humanisé, injecté par voie s.c. toutes les deux semaines, qui combine une bonne efficacité et une grande autonomie du patient (Fig. 1). L’infliximab et l’adalimumab sont tous deux supérieurs à l’étanercept en termes de puissance d’action.
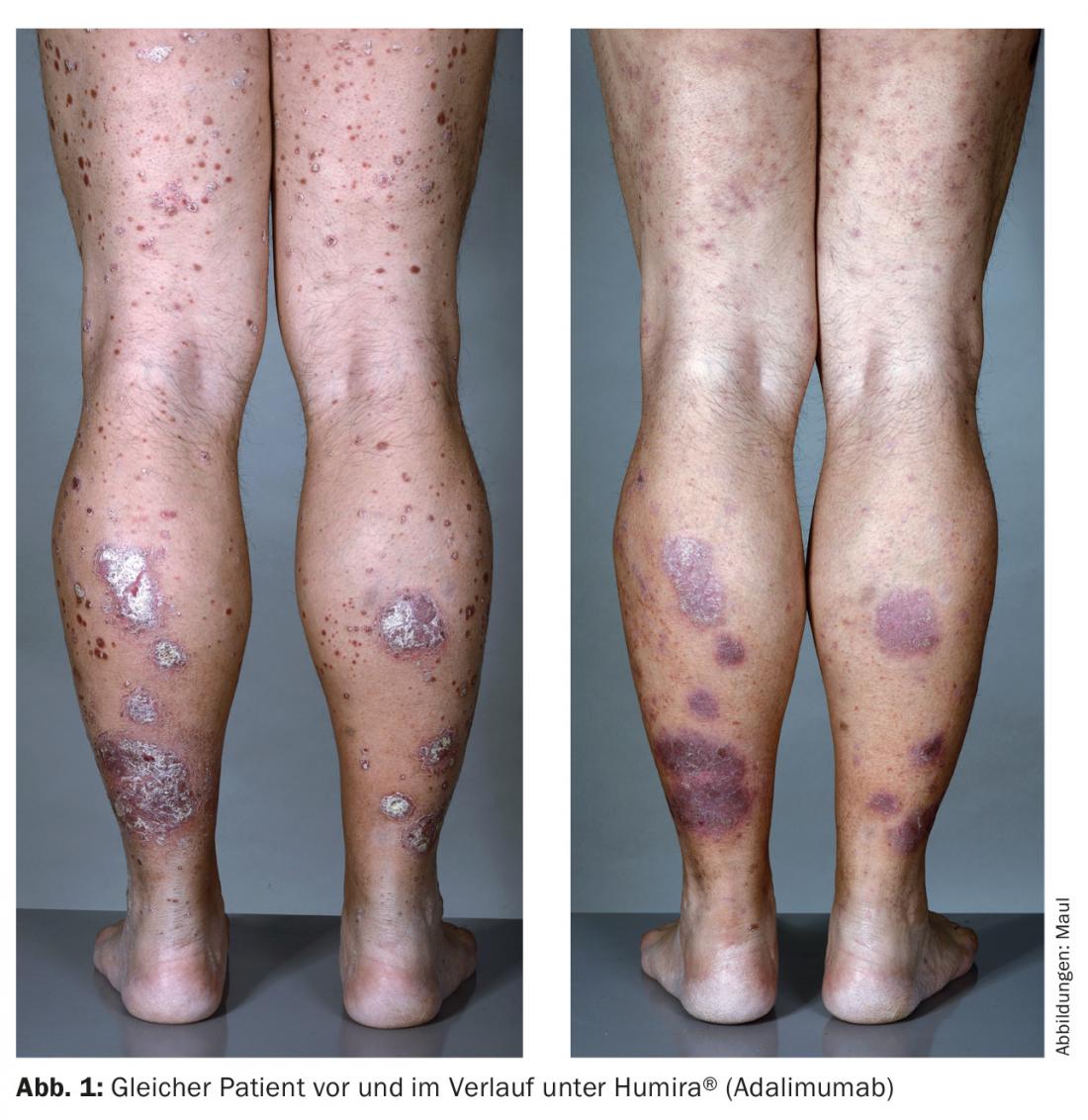
Bloqueur d’IL-12/23 : l’ustekinumab (Stelara®), un bloqueur d’IL-12/23, est un anticorps entièrement humanisé qui se lie à la sous-unité commune d’IL-12 et -23. Ces cytokines sont importantes dans les réactions immunitaires locales. Bien qu’ils soient indispensables au développement des lésions cutanées psoriasiques, ils ne semblent pas être essentiels à l’immunité normale, car aucun effet indésirable significatif n’a été observé dans les études par rapport au placebo. Les études à long terme n’ont pas non plus montré d’augmentation des taux d’infection, ce qui fait de ce médicament l’un des traitements du psoriasis les plus sûrs qui soient [18,19].
Antagoniste de l’IL-17A : un nouveau produit biologique a été mis sur le marché en 2015, le sécukinumab (Cosentyx®), un bloqueur de l’IL-17A. L’IL-17A est un messager chimique produit, entre autres, par le sous-groupe de lymphocytes T auxiliaires Th17 et est très spécifiquement responsable de l’inflammation locale en recrutant localement des granulocytes neutrophiles et des monocytes sur les sites de l’inflammation. L’avantage de cette inhibition sélective de la réponse immunitaire est que les effets secondaires dus à l’inhibition de ces cytokines sont limités. Le sécukinumab est administré à raison de 300 mg s.c. par semaine pendant le premier mois, puis une fois par mois à partir de la semaine 5. Deux études de phase III sur le sécukinumab dans le psoriasis modéré à sévère ont montré qu’une amélioration du PASI75 à la semaine 12 du traitement du psoriasis (par rapport à l’état avant traitement) est obtenue chez 77,1-81,6% de tous les patients [20]. Une étude comparative a été menée contre un traitement par étanercept. Dans cette étude, seuls 44,0% des patients ont atteint un PASI75 à la semaine 12 avec l’étanercept, alors que le placebo a atteint ce critère dans moins de 5% des cas. Jusqu’à la semaine 52, une réponse PASI90 a été observée chez 39% des patients sous Enbrel® vs 70,6% sous sécukinumab 300 mg. Les effets secondaires des antagonistes de l’IL-17 ont été étudiés dans des études de phase III [20]. Le médicament a présenté un profil d’innocuité et d’effets secondaires similaire à celui des anciens produits biologiques. Par rapport au placebo, une légère augmentation de l’incidence des effets indésirables a été observée pendant la période d’induction, en particulier ceux de nature infectieuse non dangereuse. L’IL-17 joue un rôle clé dans la défense contre les agents microbiens cutanéo-muqueux. Ces derniers sont notamment défendus par les granulocytes neutrophiles, pour lesquels l’IL-17-A joue un rôle important dans la migration et la granulopoïèse. Cela explique pourquoi l’incidence des infections à Candida non compliquées est plus élevée en fonction de la dose. Toutes les infections à Candida ont pu être traitées avec des agents thérapeutiques standard et n’ont pas entraîné d’interruption du traitement biologique. En outre, quelques neutropénies ont été observées, mais elles ont spontanément régressé.
Des études ont montré que le sécukinumab constitue également une bonne alternative thérapeutique dans l’arthrite psoriasique. Le critère d’évaluation utilisé est l’ACR20, un score standard qui mesure l’amélioration de 20 % des symptômes de l’arthrite psoriasique. Jusqu’à la semaine 24, celui-ci a atteint environ 50% des patients traités par sécukinumab contre 18% des patients sous placebo. Dans une deuxième étude, 39% des patients traités par 300 mg de sécukinumab ont obtenu un ACR20 contre 15% dans le groupe placebo [21].
Petites molécules
Un autre médicament autorisé en Suisse en 2015 est l’aprémilast (Otezla®), un inhibiteur de la phosphodiestérase 4 (PDE4) de petite molécule administré par voie orale pour le traitement du psoriasis (PsO) et de l’arthrite psoriasique (PsA), qui fait partie du groupe des “petites molécules ciblées”. L’inhibiteur de la PDE4, l’aprémilast, régule de manière intracellulaire la production de cytokines inflammatoires, qui jouent un rôle dans l’immunopathophysiologie de la PsO, en augmentant le taux d’AMPc intracellulaire. La production de cytokines pro-inflammatoires (telles que TNF-α, IL-23, IL-17) est réduite, tandis que la production de cytokines anti-inflammatoires est favorisée. Dans les études ESTEEM 1 et 2, environ six fois plus de patients sous aprémilast que sous placebo ont obtenu une réponse PASI75 à la semaine 16 (concrètement, un tiers des patients sous aprémilast ont vu leur psoriasis s’améliorer de 75% en 16 semaines). La réponse a été maintenue pendant 52 semaines. 22% des patients traités par aprémilast ont également obtenu une guérison presque complète de la PsO après seulement 16 semaines (sPGA : 21,7% vs. 3,9%). De plus, l’aprémilast a donné de bons résultats dès la semaine 16 dans des localisations difficiles à traiter comme le scalp (scPGA) et l’atteinte unguéale (NAPSI). Les démangeaisons ont diminué davantage pendant cette période que sous placebo, mais là encore, certains produits biologiques agissent plus rapidement et peut-être plus fortement. La qualité de vie s’est améliorée de manière cliniquement significative par rapport au groupe placebo (réduction DLQI ≥5 : 70% vs. 34%) [22]. Le traitement par aprémilast a été bien toléré (pas d’augmentation du risque d’infection) et a donc entraîné un taux plus faible d’abandon du traitement. Les effets indésirables rencontrés ont été les suivants : diarrhée, nausées, maux de tête et infections des voies respiratoires supérieures, généralement au cours des deux premières semaines de traitement. Les symptômes de diarrhée ont généralement disparu sans intervention médicale lorsque le traitement par Otezla® a été poursuivi, dans un délai de quatre semaines [22,23]. L’aprémilast est administré par voie intiale sous forme de titration pendant cinq jours (boîte de titration de 10/20/30 mg), puis en traitement d’entretien à 30 mg 2×/d. Le traitement d’entretien est administré par voie orale. L’aprémilast peut également être utilisé pour traiter l’arthrite psoriasique, comme l’a montré l’étude PALACE1 (n=504). Le traitement par aprémilast a entraîné une réponse ACR20 significativement plus élevée (38,1% vs 19,0%) par rapport au placebo à la semaine 16. Le taux de réponse ACR20 s’est progressivement amélioré entre les semaines 24 et 52 pour atteindre 63% (apremilast 20 mg BID) et 55% (apremilast 30 mg BID). L’aprémilast a également montré une amélioration significative des symptômes de la PsA (gonflement, douleur, enthésite, dactylite), de la capacité fonctionnelle physique et de la qualité de vie (SF36, HAQ-DI). Les améliorations des paramètres pertinents ont été maintenues jusqu’à la semaine 52 [23].
Perspectives
Les progrès de l’immunologie dans la compréhension de la pathogenèse du psoriasis, le développement de médicaments à sélectivité accrue et la reconnaissance du caractère systémique du psoriasis ont permis d’améliorer la thérapie. En même temps, elle est devenue plus compliquée. En particulier, l’intégration des produits biologiques et des petites molécules dans le traitement du psoriasis sévère a entraîné un changement de paradigme en dermatologie : La peau fait désormais à nouveau partie de l’ensemble du corps, qui est tout autant touché par le psoriasis au niveau psychique, cardiovasculaire ou musculo-squelettique que le tégument. Les études cliniques sur les médicaments biologiques ont notamment attiré l’attention sur les instruments de mesure de la qualité de vie, qui constituent une autre mesure de la réussite du traitement. Nous sommes impatients de voir dans quelle mesure l’utilisation des produits biologiques aura un impact positif à long terme sur les comorbidités et l’espérance de vie. Qu’il s’agisse d’une clinique ou d’un cabinet de dermatologie, l’indication médicale et l’absence d’alternatives thérapeutiques réelles moins coûteuses sont déterminantes dans chaque cas. Le psoriasis et l’arthrite psoriasique doivent être traités par une équipe composée de dermatologues, de rhumatologues et de médecins généralistes.
Il est essentiel d’identifier précocement et de traiter efficacement à la fois les manifestations cutanées du psoriasis et les comorbidités liées au psoriasis.
Littérature :
- Jemec GB, et al : A new scalp formulation of calcipotriene plus betamethasone compared to its active ingredients and the vehicle in the treatment of scalp psoriasis. Un essai randomisé, en double aveugle, contrôlé. J Am Acad Dermatol 2008 ; 59 : 455-463.
- Barbagallo J, et al : Narrowband UVB phototherapy for the treatment of psoriasis. Une revue et mise à jour. Cutis 2001 ; 68 : 345-347.
- Saurat JH, et al : Étude multicentrique randomisée en double aveugle comparant l’acitrétine-PUVA, l’étrétinate-PUVA et le placebo-PUVA dans le traitement du psoriasis sévère. Dermatologica 1988 ; 177 : 218-224.
- Heydendael VM, et al : Methotrexate versus cyclosporine dans le psoriasis en plaques chronique modéré à sévère. N Engl J Med 2003 ; 349 : 658-665.
- Nyfors A : Benefits and adverse drug experiences during long-term methotrexate treatment of 248 psoriatics. Dan Med Bull 1978 ; 25 : 208-211.
- Trüeb RM : Recommandations de consensus sur le méthotrexate. Gebro Pharma 2008.
- van de Kerkhof PC, et al : The effect of addition of calcipotriol ointment (50 micrograms/g) to acitretin therapy in psoriasis. Br J Dermatol 1998 ; 138 : 84-89.
- Gupta AK, et al : Side-effect profile of acitretin therapy in psoriasis. J Am Acad Dermatol 1989 ; 20 : 1088-1093.
- Griffiths CE, et al : Clearance of psoriasis with low dose cyclosporin. Br Med J (Clin Res Ed) 1986 ; 293 : 731-732.
- Lowe NJ, et al : Traitement à long terme à faible dose de cyclosporine pour le psoriasis sévère. Effets sur la fonction et la structure rénales. J Am Acad Dermatol 1996 ; 35 : 710-719.
- Koo J : Une étude randomisée en double aveugle comparant l’efficacité, la sécurité et la dose optimale de deux formulations de cyclosporine, Néoral et Sandimmun, chez des patients atteints de psoriasis sévère. Groupe d’étude OLP302. Br J Dermatol 1998 ; 139 : 88-95.
- Laburte C, et al : Efficacité et sécurité de la cyclosporine A orale (CyA ; Sandimmun) pour le traitement à long terme du psoriasis en plaques sévère chronique. Br J Dermatol 1994 ; 130 : 366-375.
- Altmeyer PJ, et al : Effet antipsoriasique des dérivés de l’acide fumarique. Résultats d’une étude multicentrique en double aveugle chez 100 patients. J Am Acad Dermatol 1994 ; 30 : 977-981.
- Gollnick H, et al : Le calcipotriol topique plus acide fumarique oral est plus efficace et agit plus rapidement que la monothérapie par acide fumarique oral dans le traitement du psoriasis vulgaire en plaques chronique sévère. Dermatology 2002 ; 205 : 46-53.
- Altmeyer P, Hartwig R, Matthes U : [Efficacité et profil de sécurité des esters d’acide fumarique dans le traitement oral à long terme du psoriasis vulgaire sévère réfractaire au traitement. A study of 83 patients]. Dermatologue 1996 ; 47 : 190-196.
- Gottlieb AB, et al : A randomized trial of etanercept as monotherapy for psoriasis. Arch Dermatol 2003 ; 139 : 1627-1632 ; discussion 32.
- Paller AS, et al : Traitement à l’étanercept pour les enfants et adolescents atteints de psoriasis en plaques. N Engl J Med 2008 ; 358 : 241-251.
- Leonardi CL, et al : Efficacité et sécurité de l’ustekinumab, un anticorps monoclonal humain contre l’interleukine-12/23, chez les patients atteints de psoriasis : 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet 2008 ; 371 : 1665-1674.
- Papp KA, et al : Efficacité et sécurité de l’ustekinumab, un anticorps monoclonal humain contre l’interleukine-12/23, chez les patients atteints de psoriasis : 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2). Lancet 2008 ; 371 : 1675-1684.
- Langley RG, et al : Secukinumab in plaque psoriasis-results of two phase 3 trials. N Engl J Med 2014 ; 371 : 326-338.
- McInnes IB, et al : Efficacité et sécurité du secukinumab, un anticorps monoclonal entièrement humain anti-interleukine-17A, chez les patients atteints d’arthrite psoriasique modérée à sévère : un essai de 24 semaines, randomisé, en double aveugle, contrôlé par placebo, phase II de preuve de concept. Ann Rheum Dis 2014 ; 73 : 349-356.
- Papp K, et al : Apremilast, un inhibiteur oral de la phosphodiestérase 4 (PDE4), chez les patients atteints de psoriasis en plaques modéré à sévère. Résultats d’un essai contrôlé randomisé de phase III (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol 2015 ; 73 : 37-49.
- Schafer PH, et al : L’impact pharmacodynamique de l’apremilast, un inhibiteur oral de la phosphodiestérase 4, sur les niveaux de circulation des biomarqueurs inflammatoires chez les patients atteints d’arthrite psoriasique. Résultats de sous-étude d’un essai de phase III, randomisé et contrôlé par placebo (PALACE 1). J Immunol Res 2015 ; 2015 : 906349.
PRATIQUE DERMATOLOGIQUE 2016 : 26(2) : 10-16