Les traitements possibles du sarcome des tissus mous comprennent la chirurgie, la radiothérapie et la chimiothérapie. Depuis peu, on essaie d’amplifier les effets en appliquant de la chaleur aux cellules cancéreuses – avec succès.
Chez les adultes, les sarcomes des tissus mous sont rares par rapport à d’autres types de cancers (au total, ils représentent moins de 1% de toutes les tumeurs malignes). Le traitement est planifié individuellement et dépend, entre autres, de la localisation, de la taille du sarcome et des métastases. Les formes localisées sont généralement soumises à une chirurgie, combinée à une radiothérapie pré- ou postopératoire, et la chimiothérapie périopératoire est également recommandée comme option pour les patients à haut risque.
Un “creuset” pour les cellules cancéreuses
Dans les études précliniques, mais aussi dans les premiers essais cliniques randomisés, des effets synergiques ont été observés lorsque la radiothérapie et la chimiothérapie étaient combinées à une exposition régionale à la chaleur de 40 à 43°C. Les effets de la radiothérapie et de la chimiothérapie sur les cellules cancéreuses ont été étudiés. La chaleur ne tue pas seulement les cellules cancéreuses par toxicité thermique directe, mais augmente également l’effet du médicament ou de la substance. Sensibilisation des tissus à la chimiothérapie ou à la radiothérapie et induction d’une réponse immunitaire (antitumorale) via des protéines de stress et divers autres mécanismes d’alerte [1].
Un groupe de chercheurs de Munich a démontré la faisabilité et l’efficacité de cette procédure dès 1990 pour les sarcomes à haut risque [2]. De nombreuses années se sont encore écoulées. Le premier auteur de l’époque et l’un des scientifiques les plus actifs dans ce domaine, le professeur Rolf D. Issels de l’hôpital universitaire de Munich, a continué à travailler sur le sujet. En collaboration avec des centres universitaires de Norvège, d’Autriche et des États-Unis ainsi que six hôpitaux allemands, sous la direction récente de Munich, les résultats d’une étude randomisée de phase III comparant l’hyperthermie locorégionale associée à la chimiothérapie néoadjuvante à la chimiothérapie seule ont pu être présentés pour la première fois en 2010 [3].
Le système d’hyperthermie BSD-2000 a été utilisé à cet effet. Dans un dispositif de couchage annulaire, l’énergie thermique à haute fréquence est concentrée de manière sélective sur la zone de traitement cible en profondeur à l’intérieur des membres, du bassin, de l’abdomen ou du thorax. La configuration dite à réseau phasé concentre l’énergie du rayonnement en disposant des émetteurs individuels. Les antennes réseau à commande de phase permettent d’obtenir une forte directivité. La température augmente à l’endroit ciblé (les tissus contenant de l’eau sont chauffés par le couplage d’ondes électromagnétiques), tandis que le système supprime le rayonnement ailleurs. Le tout est surveillé et contrôlé par ordinateur et via des capteurs ou un “thermostat”. La température cible dans l’étude était de 42°C (donc une très forte fièvre) pendant une heure aux jours 1 et 4 de chaque cycle de chimiothérapie.
Sur les 341 adultes randomisés atteints de sarcomes des tissus mous localisés à haut risque, presque tous ont subi une (ré)résection et un peu plus des deux tiers par groupe ont subi une radiothérapie. En moyenne, les patients ont reçu des doses de 53,2 vs. 52,7 Gy. Le traitement néoadjuvant comprenait les deux agents chimiothérapeutiques les plus actifs dans ce domaine, la doxorubicine et l’ifosfamide. Cette dernière est plus efficace à des températures comprises entre 40,5 et 43 °C. De plus, l’étoposide a été administré, mais selon les auteurs, il pourrait être supprimé à l’avenir car il n’a qu’une faible activité dans les sarcomes des tissus mous. Les mêmes agents ont été utilisés pour le traitement post-induction (à nouveau avec ou sans hyperthermie) après résection et/ou radiothérapie, auquel environ la moitié des patients de chaque groupe ont été complètement soumis (davantage dans le groupe hyperthermie).
Efficacité à long terme confirmée
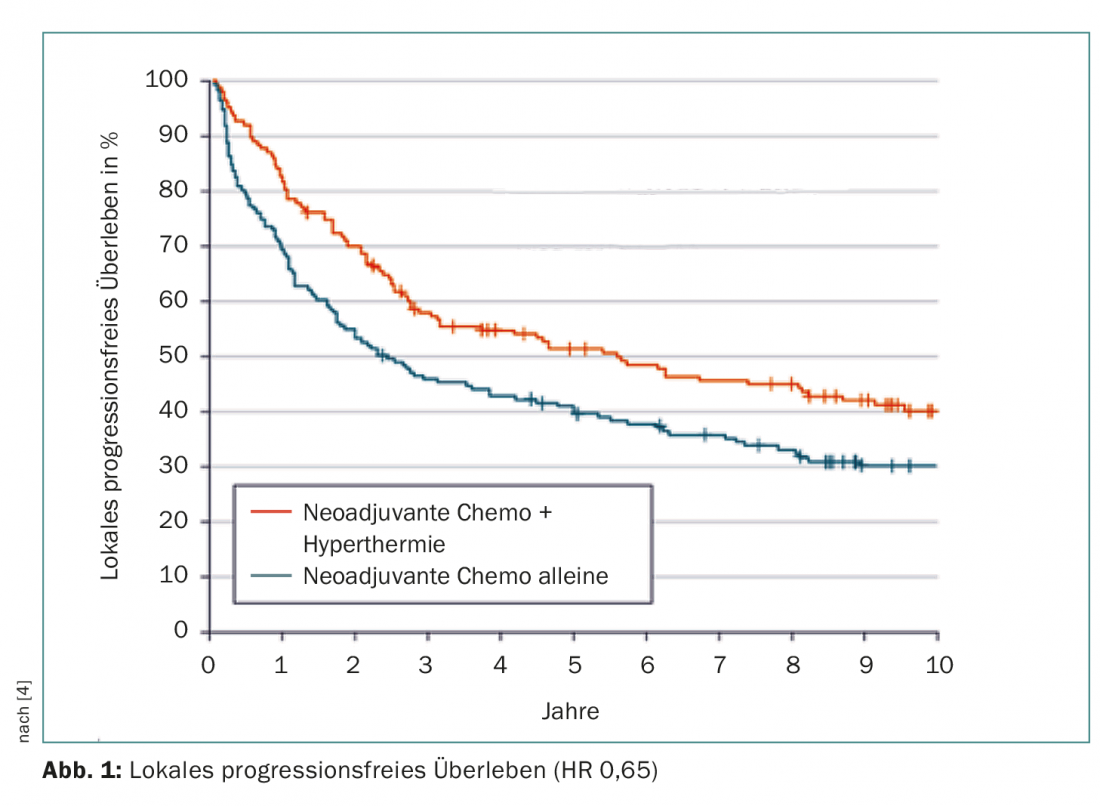
La collecte des données a été achevée en décembre 2014. A ce stade, après un suivi médian de plus de 11 ans, l’ajout de l’hyperthermie avait réduit de 35% la probabilité d’une progression locale ou d’un décès (HR 0,65 ; IC à 95% 0,49-0,86 ; p=0,002). Il s’agissait du critère d’évaluation principal. Les courbes se sont rapidement écartées dès le début de l’étude et la progression précoce a été efficacement évitée (Fig. 1). Le risque de mortalité a été amélioré de manière similaire, avec une réduction significative de 27% dans le groupe d’étude (où seuls les cas liés à la maladie ou au traitement ont été analysés) – à savoir d’un peu plus de six ans à environ 15 ans. Après cinq ans, 62,7% vs 51,3% des personnes traitées étaient en vie et après dix ans, 52,6% vs 42,7%. Neuf patients ont dû être traités par hyperthermie pour en sauver un de la mort en cinq ans (Number Needed to Treat).
Les résultats à long terme [4] confirment l’évaluation initiale qui a eu lieu en 2010. A l’époque, le critère d’évaluation primaire avait montré une réduction du risque de plus de 40% et un bénéfice en termes de survie pour ceux qui avaient terminé la chimiothérapie d’induction avec l’hyperthermie. 28,8% contre 12,7% ont répondu à chaque traitement. La méthode d’essai était la plus efficace pour les sarcomes rétropéritonéaux et abdominaux (non-extrémités).
Sécurité acceptable
En termes de sécurité, les résultats de la stratégie de traitement combiné ont été mitigés. Les auteurs ont parlé d’une “toxicité modérée”, le traitement pouvant généralement être administré en toute sécurité. Le traitement de référence représente déjà une charge pour les patients, que l’hyperthermie n’augmente que de manière limitée. Si un décès lié au traitement est survenu avec la chimiothérapie seule, il y en a eu deux avec l’hyperthermie concomitante. Les leucopénies sévères étaient significativement plus fréquentes, des thrombocytopénies ont également été observées dans 17% vs 13,8% des cas (peut-être en raison d’un co-traitement thermique de la moelle osseuse, en particulier dans les grandes tumeurs abdominales ou pelviennes). Les patients pourraient avoir été plus sensibles à de tels effets de la chimiothérapie en raison de la chaleur. Divers effets secondaires spécifiques ont également été observés, tels que la douleur et des brûlures cutanées d’intensité variable. La pression exercée par les “coussins” en silicone/eau qui entourent le patient dans l’appareil d’application (et qui sont censés diriger les ondes de manière ciblée vers la zone de couverture) a parfois été ressentie comme désagréable et pourrait avoir favorisé le vomissement et la neurotoxicité locale dans certains cas, en particulier chez les patients ayant subi une intervention chirurgicale ou une radiothérapie.
On peut se demander si le bilan bénéfice/risque de l’approche thérapeutique serait ainsi également positif chez les patients présentant un risque plus faible. Actuellement, l’hyperthermie est également testée dans le cadre d’une grande étude de phase III sur les cancers du pancréas réséqués.
Littérature :
- Issels RD : Hyperthermia ajoute à la chimiothérapie. Eur J Cancer 2008 Nov ; 44(17) : 2546-2554.
- Issels RD, et al : Ifosfamide plus etoposide combiné à l’hyperthermie régionale chez des patients atteints de sarcomes localement avancés : une étude de phase II. J Clin Oncol 1990 ; 8(11) : 1818-1829.
- Issels RD, et al : Chimiothérapie néo-adjuvante seule ou avec hyperthermie régionale pour les sarcomes des tissus mous localisés à haut risque : une étude multicentrique randomisée de phase 3. Lancet Oncol 2010 juin ; 11(6) : 561-570.
- Issels RD, et al : Effect of Neoadjuvant Chemotherapy Plus Regional Hyperthermia on Long-term Outcomes Among Patients With Localized High-Risk Soft Tissue Sarcoma. L’essai clinique randomisé EORTC 62961-ESHO 95. JAMA Oncol 2018. DOI:10.1001/jamaoncol.2017.4996 [Epub ahead of Print].
InFo ONKOLOGIE & HÄMATOLOGIE 2018 ; 6(3) : 5-6