Les changements de régime alimentaire et le sport s’avèrent souvent insuffisants pour lutter contre l’obésité pathologique. Jusqu’à présent, la chirurgie bariatrique était la seule mesure efficace pour de nombreux patients souffrant d’obésité. Cela a changé depuis. Les incrétino-mimétiques permettent d’obtenir une réduction substantielle du poids tout en améliorant la qualité de vie. Alors que les GLP-1-RA imitent l’hormone incrétine glucagon-like peptide (GLP)-1, les agonistes duaux GIP/GLP-1 activent également les récepteurs du glucose-dependent insulinotropic peptide (GIP).
L’obésité est une maladie complexe et multifactorielle qui augmente le risque de maladies secondaires telles que le diabète de type 2, les maladies cardiovasculaires, les lésions rénales et le cancer [1–3]. L’obésité et le diabète sont tous deux causés et influencés par une multitude de déterminants génétiques et de facteurs environnementaux [4]. L’obésité résulte d’un bilan énergétique positif – mais les causes du déséquilibre entre l’énergie consommée et l’énergie dépensée sont hétérogènes et multiples.
Les analogues des incrétines comme “game-changer” – perdre du poids sans s’affamer
Le glucagon-like peptide-1 (GLP-1) et le glucose-dependent insulinotropic peptide (GIP) sont des incrétines. Ces substances imitent les hormones endogènes du tractus gastro-intestinal qui rassasient, augmentent la combustion des graisses et stimulent la sécrétion d’insuline [5,6]. “Les médicaments contre l’obésité peuvent reproduire une, deux ou trois incrétines dans une même molécule, ce qui leur confère une efficacité variable”, a expliqué le professeur Susanne Reger-Tan, directrice du Centre d’excellence sur le diabète à la Clinique d’endocrinologie, de diabétologie et de métabolisme de l’Hôpital universitaire d’Essen (D) [1]. Le traitement par les analogues des incrétines, souvent appelés “injections amaigrissantes” dans les médias, entraîne une perte de poids substantielle chez les personnes souffrant d’obésité, et ce sans sensation de faim atroce. “Dans l’état actuel des connaissances, cette nouvelle approche médicamenteuse est vraiment un gamechanger dans le traitement de l’obésité”, a déclaré le professeur Reger-Tan. Il s’agit néanmoins d’une intervention sur l’organisme. “L’utilisation doit se faire après une analyse minutieuse des bénéfices et des risques dans le cadre des indications pour lesquelles ces substances sont autorisées et doit être accompagnée d’un traitement de fond multimodal afin d’obtenir des résultats durables”.
Deux GLP-1-RA et un agoniste dual GIP/GLP-1 sont autorisés dans le pays.
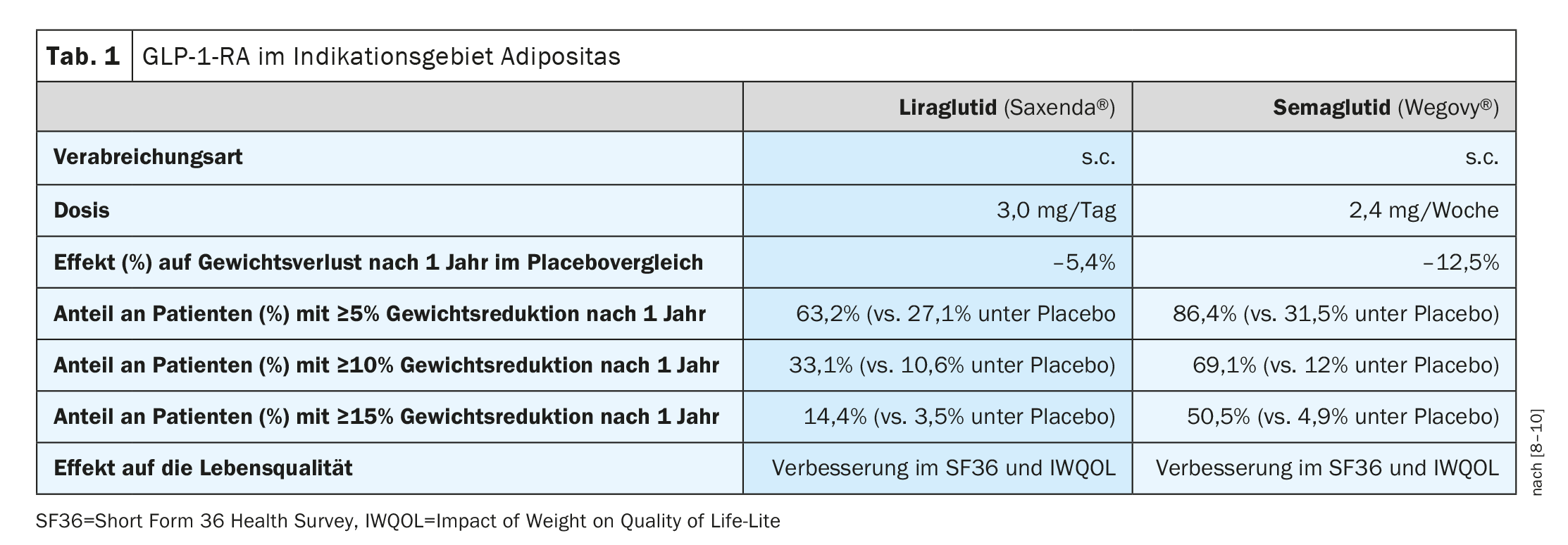
Outre Saxenda® (liraglutide 3 mg), qui est disponible depuis un certain temps en Suisse pour le traitement de l’obésité chez les patients obèses de plus de 12 ans, Wegovy® (sémaglutide 2,4 mg) a également reçu une autorisation de Swissmedic pour cette indication en 2022 (tableau 1) [7]. Ces deux substances appartiennent au groupe des agonistes du récepteur du GLP-1 (GLP-1-RA) – également connus sous le nom d'”incrétinimétiques/analogues de l’incrétine”. Saxenda® et Wegovy® sont tous deux des analogues à longue durée d’action de l’incrétine GLP-1 administrés par voie sous-cutanée. Les effets de ces substances reposent notamment sur la promotion de la synthèse et de la libération d’insuline et sur l’inhibition de la sécrétion de glucagon. La vidange de l’estomac est retardée, ce qui augmente la sensation de satiété. Alors que Saxenda® est un médicament remboursé par les caisses d’assurance maladie pour les adultes souffrant d’obésité, Wegovy® n’est pas pris en charge par les caisses d’assurance maladie en Suisse à ce jour. Une limitation temporaire s’applique jusqu’au 30.06.2026 pour Saxenda® [13]. Outre un IMC ≥35 kg/m2 ou ≥28 kg/m2 **, il est exigé de manger au moins 500 kcal par jour de moins que l’énergie brûlée par le corps (“régime déficitaire de 500 kcal/jour”). En outre, les patients doivent démontrer une augmentation de leur activité physique (par exemple, un podomètre). Un traitement préalable par GLP-1-RA et une chirurgie bariatrique antérieure ou prévue font partie des critères d’exclusion. La prescription ne peut être faite que par des spécialistes en endocrinologie/diabétologie et dans des centres spécialisés dans l’obésité. Selon la limitation actuelle [13], Saxenda® ne doit pas être associé à d’autres GLP-1-RA, ni à des gliptines, des inhibiteurs du SGLT-2 ou de l’insuline. Lors d’une première utilisation de Saxenda®, une perte de poids d’au moins 5% ou 7% du poids corporel initial doit être obtenue après 16 semaines de traitement.
** ou IMC ≥28 kg/m2 en cas de pathologies associées supplémentaires liées au poids telles que le prédiabète ou le diabète sucré de type 2, l’hypertension artérielle, ou la dyslipidémie.
| Agoniste double GIP/GLP-1 Le tirazépatide (Mounjaro®) est un agoniste des récepteurs GIP et GLP-1 à prendre une fois par semaine. Il s’agit d’une molécule unique qui active les récepteurs du glucagon-like peptide-1 (GLP-1) et du polypeptide insulinotropique dépendant du glucose (GIP), qui sont tous deux des hormones incrétines naturelles. Les récepteurs GIP et GLP-1 se trouvent tous deux dans des zones du cerveau humain qui sont pertinentes pour la régulation de l’appétit. Il a été démontré que le tirazépatide réduit la prise alimentaire et module le métabolisme des graisses. Cela s’est traduit par une réduction significative du poids dans des études sur des patients obèses. Des recherches sont également en cours sur des triagonistes qui, outre les récepteurs GIP et GLP-1, s’adressent également au récepteur du glucagon. |
| vers [12,13] |
En outre, un agoniste dual GIP/GLP-1, le tirazépatide (Mounjaro®) (encadré) , a été approuvé en 2022. Le tirazépatide active à la fois les récepteurs du polypeptide insulinotrope dépendant du glucose (GIP) et du peptide 1 de type glucagon (GLP-1). La dose initiale de tirazépatide est de 2,5 mg une fois par semaine. Après quatre semaines, la dose est augmentée à 5 mg une fois par semaine. Si nécessaire, la dose peut être augmentée par paliers de 2,5 mg, après au moins quatre semaines avec la dose actuelle. La dose maximale est de 15 mg une fois par semaine. Dans le programme d’études SURPASS, le tirazépatide a permis d’obtenir une réduction du poids corporel de 7 à 14,5 % en fonction de la dose (5, 10 ou 15 mg) sur une période de 40 à 52 semaines de traitement [11].
Littérature :
- “Obésité : nouvelle ère dans le traitement par injections amaigrissantes”, Société allemande d’endocrinologie (DGE), 05.09.2023.
- Collaborateurs GBDO, et al : Health Effects of Overweight and Obesity in 195 countries over 25 years. N Engl J Med 2017 ; 377 : 13-27.
- Pearson-Stuttard J, et al : La charge mondiale de cancer attribuable au diabète et à un indice de masse corporelle élevé : une évaluation comparative des risques. Lancet Diabetes Endocrinol 2018 ; 6:e6-e15.
- “Immunometabolism and Gut Microbiome-Projekt ” www.udem.insel.ch/de/lehre-und-forschung/
forschungsschwerpunkte/adipositas/immunometabolism-and-gut-microbiome-projekt (dernière consultation 09.10.2023) - Nogueiras R, Nauck MA, Tschop MH : Gut hormone co-agonists for the treatment of obesity : from bench to bedside. Nat Metab 2023 ; 5 : 933-944.
- Ussher JR, Drucker DJ : Agonistes du récepteur du glucagon-like peptide 1 : bienfaits cardiovasculaires et mécanismes d’action. Nat Rev Cardiol 2023 ; 20 : 463-474.
- Information sur les médicaments, www.swissmedicinfo.ch (dernière consultation 09.10.2023)
- Wilding JPH, et al : Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med 2021 ; 384(11) : 989-1002.
- Pi-Sunyer X, et al : A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med 2015 ; 373(1) : 11-22.
- Kolotkin RL, et al. : Improvements in health-related quality of life over 3 years with liraglutide 3.0 mg compared with placebo in participants with overweight or obesity. Clin 2018 ; 8(1) : 1-10.
- Müller TD, Blüher M : Traitement de l’obésité – les pharmacothérapies seront-elles l’alternative à la chirurgie métabolique ? [Traitement de l’obésité : les pharmacothérapies remplaceront-elles la chirurgie métabolique à l’avenir ?] Inn Med (Heidelb) 2023 ; 64(7) : 629-635.
- “Le mécanisme d’action du tirazépatide a été élucidé”, www.helmholtz-munich.de/newsroom/news/artikel/unraveling-the-mode-of-action-of-tirzepatide (dernière consultation 10/10/2023)
PRATIQUE DU MÉDECIN DE FAMILLE 2023 ; 18(10) : 36-37