Les plaies colonisées par des biofilms constituent l’un des plus grands défis dans le traitement des plaies chroniques. On estime que 2% de la population d’Europe centrale souffre de plaies chroniques, le risque augmentant avec l’âge. Le diagnostic et le traitement de la maladie sous-jacente, généralement une maladie artérielle occlusive périphérique (MAP), une insuffisance veineuse (IVC), un diabète sucré de type I ou II ou encore une maladie immunologique, constituent toujours la première étape vers la réussite du traitement. Les infections récurrentes (locales) et la persistance du biofilm sur la plaie prolongent le processus de cicatrisation.
Les plaies colonisées par des biofilms sont l’un des plus grands défis dans le traitement des plaies chroniques [1,2]. On estime que 2% de la population d’Europe centrale souffre de plaies chroniques, le risque augmentant avec l’âge [3]. Le diagnostic et le traitement de la maladie sous-jacente, généralement une maladie artérielle occlusive périphérique (MAP), une insuffisance veineuse (IVC), un diabète sucré de type I ou II ou encore une maladie immunologique, constituent toujours la première étape vers la réussite du traitement [4]. Les infections récurrentes (locales) et la persistance du biofilm sur la plaie prolongent le processus de cicatrisation. Cela prend généralement des mois et nécessite en outre un traitement multisectoriel (hôpital, ambulance, médecin généraliste ou spécialiste, soins) [5]. De plus, une fois que la plaie est refermée, il n’est pas garanti qu’elle le reste vraiment. En conséquence, le terme de “rémission de la plaie” est plus approprié que celui de “cicatrisation” pour les patients souffrant de troubles chroniques de la cicatrisation.
Biofilm des plaies – Définition et pathogenèse
Selon une méta-analyse, environ 78% des plaies chroniques sont colonisées par des micro-organismes pathogènes sous forme de biofilms [6]. Celles-ci sont responsables de la chronicité d’une plaie, si la maladie sous-jacente est traitée au mieux [2]. Le biofilm des plaies est défini comme suit :
“Le biofilm est une communauté structurée de microbes avec une diversité génétique et une expression génétique variable (phénotype) qui crée des comportements et des mécanismes de défense conduisant à la production d’infections uniques (chroniques) avec une tolérance significative aux antibiotiques et aux antimicrobiens, tout en étant protégés de l’immunité de l’hôte”. [Processus Consensus Delphi, IWII 05/2016].
Toute plaie, même aiguë, est colonisée en quelques heures par des micro-organismes du microbiote cutané, qui peut également contenir des espèces pathogènes. Le fond de la plaie est un terrain propice à leur développement. À ce stade, on parle de “contamination de la plaie”. Au fil du temps, les bactéries se multiplient dans et sur la plaie ; des colonies de bactéries se forment. Un nettoyage externe (antiseptique) de la plaie peut réduire la colonisation bactérienne et le système immunitaire travaille également contre la propagation des bactéries dans la plaie. Si ces processus n’ont pas lieu ou si les cellules immunitaires locales ne sont pas suffisamment efficaces, de plus en plus de bactéries colonisent la plaie. Elle est dite “colonisée”, voire “colonisée de manière critique” en cas d’augmentation de la charge bactérienne accompagnée d’une réaction locale.
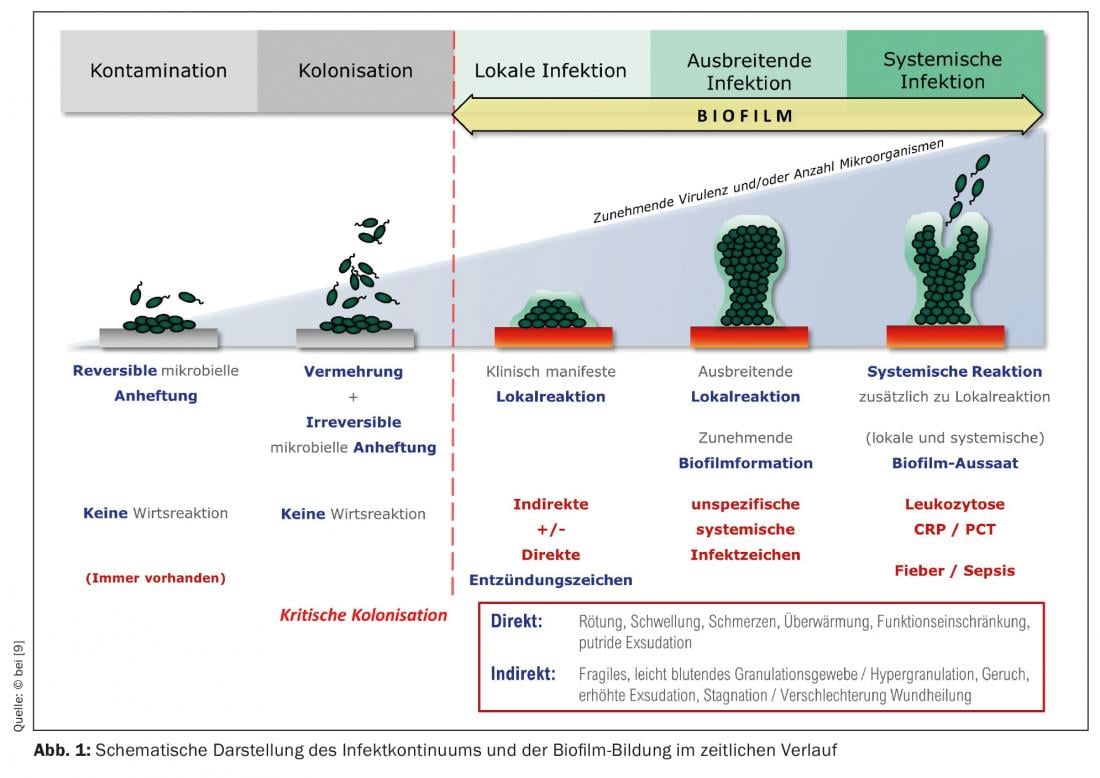
Ces colonies de bactéries peuvent former des biofilms immatures en seulement 24 heures (Fig. 1). La plupart du temps, ces biofilms ne sont pas constitués d’une seule espèce de bactéries (comme c’est le cas des biofilms d’implants en chirurgie orthopédique), mais contiennent de nombreuses espèces bactériennes différentes, c’est-à-dire un biofilm multi-espèces. Les principales espèces bactériennes présentes dans les biofilms des plaies, ici dans l’exemple de l’ulcère de jambe, sont le Staphylococcus aureus (47,6%), sa variante résistante à la méthicilline (SARM) (8,6%), le Pseudomonas aeruginosa (31,1%) et les entérobactéries (28,6%) [7]. Ces micro-organismes – plus rarement, des champignons sont également impliqués – commencent à s’entourer de ce que l’on appelle la substance extrapolymérique (EPS), presque à s’y “emmurer”. Le PSE est essentiellement composé de polysaccharides (par ex. alginate, cellulose, dextran) ainsi que d’un grand nombre de protéines, lipides, glycoprotéines, glycolipides [8], c’est-à-dire de sucres et de protéines, ce qui le fait adhérer fermement au fond de la plaie. Après 2 à 4 jours, on parle de “biofilm mature”. Il peut atteindre une épaisseur de 2 mm, c’est-à-dire devenir plastique et visible. (fig. 2A/B). À ce stade, le biofilm est capable de libérer des bactéries planctoniques (en suspension dans un liquide) avec l’exsudat de la plaie, qui est produit en abondance en raison de l’inflammation. (Fig. 1), qui peuvent s’installer autour de la plaie ou dans d’autres plaies [9]. C’est là que le cycle de formation du biofilm recommence.
Reconnaître le biofilm de la plaie
La première étape, et la plus importante, est le diagnostic clinique, c’est-à-dire d’envisager la possibilité d’une colonisation de la plaie (chronique) par un biofilm comme facteur perturbateur de la cicatrisation. Le biofilm mature peut être facilement identifié et vérifié cliniquement par une exploration de la plaie (de ses bords) à l’aide de pincettes ou de curettes (Fig. 2A/B). Le biofilm de la plaie lui-même provoque localement une réaction immunitaire ou une inflammation durable, plus ou moins prononcée. Il peut être la base d’une infection de la plaie, mais peut également persister pendant des semaines ou des mois sans l’induire.
Les plaies à biofilm vierge ne présentent généralement pas de dommages (tissulaires) prononcés, à l’exception de l’absence de cicatrisation, étant donné que les différentes espèces microbiennes présentes dans le biofilm ont un métabolisme réduit et une prolifération réduite, et qu’elles se nourrissent de l’exsudat (humain) de la plaie. D’autre part, il existe des biofilms de plaies très agressifs, par exemple ceux dominés par P. aeruginosa , qui provoquent une forte exsudation et une dermatite environnante, ce qui entraîne par conséquent une augmentation de la taille de la plaie. Une forte odeur de plaie concomitante est fréquente.
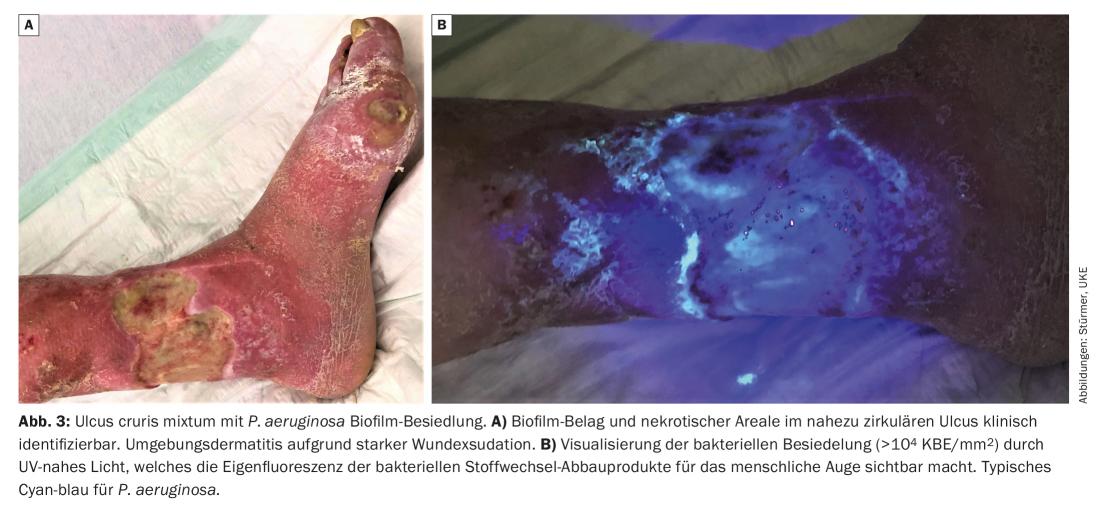
Un biofilm de la plaie ou une forte colonisation bactérienne de la plaie (>104 KFE/mm2) peut être visualisée par l’œil humain à l’aide d’une lumière proche des UV (par exemple MolecuLight®, MolecuLight Corp., Toronto, Canada) (Fig. 3) : La lumière de longueur d’onde 450 nm permet d’identifier les zones de forte activité métabolique bactérienne par la fluorescence rouge des métabolites bactériens déposés, tels que les porphyrines (de p. ex. Staphylococcus spp. et entérobactéries) ou par la fluorescence cyano-bleue de la pyoverdine sécrétée par Pseudomonas spp. [10]. Ainsi, de nombreuses plaies ont montré que P. aeruginosa colonisait et infiltrait principalement les bords de la plaie, tandis que S. aureus se trouvait plutôt au fond de la plaie.
Le traitement du biofilm de la plaie
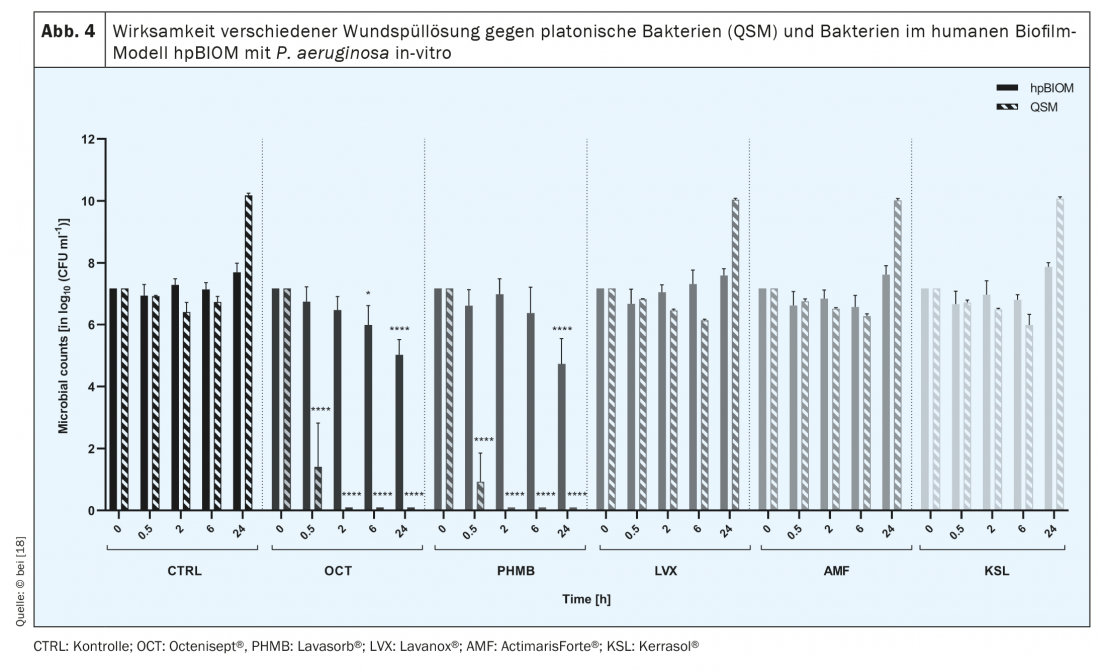
La société symbiotique multi-espèces de micro-organismes à partir de laquelle les biofilms sont formés produit une substance protectrice appelée extrapolymère (EPS) qui fonctionne comme une barrière biochimique contre le système immunitaire de l’hôte et en particulier contre les agents antimicrobiens [11,12]. C’est pourquoi ces derniers échouent souvent dans l’éradication des biofilms [13–15] (Fig. 4). Des molécules de signalisation permettent également aux micro-organismes de communiquer entre eux, par exemple pour modifier leur activité métabolique [13,15]. Une activité métabolique réduite de bactéries spécifiques, appelées cellules persistantes, en profondeur dans le biofilm, ainsi que l’interaction de différents microorganismes, par exemple par transfert latéral de résistance, sont d’autres aspects qui contribuent à la haute résilience des biofilms [17]. Sa “tolérance” aux substances, solutions et pansements antimicrobiens est grande, car ceux-ci entraînent certes l’induction de la mort cellulaire des bactéries et des champignons, mais pas la destruction des EPS. Ainsi, les agents antimicrobiens ne peuvent pas être efficaces contre les micro-organismes, car ils ne peuvent pas pénétrer dans le PSE en raison de son “bouclier protecteur” [15]. Il en va de même pour les antibiotiques appliqués par voie systémique qui, en raison de l’EPS, ne peuvent pas pénétrer suffisamment profondément dans le biofilm de la plaie pour éliminer complètement les germes pathogènes. Pour cette raison, mais aussi de manière générale, la prescription d’antibiotiques dans le traitement des plaies chroniques doit être évaluée de manière critique afin d’éviter le développement de résistances au cours du long processus de guérison des plaies chroniques.
Biofilm des plaies et solutions de rinçage des plaies (antimicrobiennes)
Il existe différentes approches pour éliminer la colonisation des plaies par le biofilm [17]. Par exemple, les solutions antimicrobiennes disponibles dans le commerce qui se sont révélées efficaces lors d’analyses in vitro sont recommandées. Cependant, l’observation clinique contredit parfois la performance antimicrobienne déclarée (Fig. 4).
Il existe différents types de solutions de rinçage des plaies : pour les uns, comme la solution saline physiologique ou le NaCl, l’effet nettoyant et diluant est au premier plan, pour les autres groupes, l’efficacité antimicrobienne plus ou moins prononcée. On sait que certaines solutions de rinçage des plaies perdent leur potentiel antimicrobien lorsqu’elles entrent en contact avec un environnement riche en protéines, comme celui de l’exsudat de la plaie [19]. Par conséquent, l’efficacité des différentes solutions de rinçage des plaies contre les biofilms bactériens varie également, le PSE faisant également office de “bouclier”. Les solutions antimicrobiennes de rinçage des plaies ciblent et détruisent les parois et les membranes bactériennes ainsi que les protéines de transport des bactéries ou inhibent leur fonction. S’ils ne parviennent pas à traverser l’EPS, qui est principalement composé de polysaccharides et de protéines, ils ne peuvent pas agir efficacement.
Il n’existe pas d’études cliniques comparatives sur les solutions de rinçage des plaies (antimicrobiennes) qui pourraient servir de base à des recommandations thérapeutiques différenciées. Cependant, des tests translationnels systématiques sur le modèle de biofilm humain hpBIOM montrent qu’Octenisept® est capable de briser les biofilms et de tuer les bactéries qui s’y trouvent en 72 heures ( !). [15,18] (Fig. 5). Le PHMB y parvient dans une mesure limitée dans le même laps de temps, mais une éradication complète n’est pas non plus atteinte après 72h. Les solutions de rinçage des plaies hypochloriques et la chlorhexidine ne parviennent pas à éliminer efficacement les bactéries du biofilm [18].
Biofilm pour les plaies et pansements antimicrobiens
On peut distinguer deux types de plaies colonisées par un biofilm : Les plaies avec un biofilm résident et peu agressif. Ceux-ci sont caractérisés par un environnement de plaie calme avec une exsudation légère à modérée (Fig. 2). L’autre type de biofilm de plaie présente une forte exsudation qui nécessite un changement de pansement quotidien. Il est obligatoire d’accompagner la plaie d’un gonflement, de rougeurs, d’une grande sensibilité de toute la région et souvent même d’une dermatite environnante (Fig. 3). Chez ces patients, il convient donc d’accorder une attention particulière à la peau environnante de la plaie et de la traiter également (p. ex. avec des pommades à base d’urée, de zinc ou de cortisone à faible dose).
Les études cliniques comparatives sur les pansements (antimicrobiens) sont rares [20]. Il est difficile d’en déduire des recommandations thérapeutiques différenciées, car non seulement les substances actives (ions d’argent, argent nanocristallin, PHMB, dérivés iodés, etc.) et leurs concentrations varient, mais aussi la base respective des pansements (PU-Foam, alginates, fibres, etc.). Plusieurs tests in vitro réalisés par nos soins sur un modèle de biofilm humain ont montré qu’un produit combiné à base d’iode et d’amidon (cardexomère-iodine) était capable d’éradiquer complètement les bactéries du biofilm en 6 ( !) jours (Fig. 5). D’autres pansements contenant des principes actifs, tels que le PHMB ou l’argent (classe MP 2B), n’ont réduit la charge bactérienne que sur [21]. Cependant, les pansements antimicrobiens ont été analysés pendant 6 jours sans changement ; une efficacité supérieure devrait être obtenue par tous les pansements testés avec un changement de pansement quotidien ou tous les 2 jours.
Biofilm de la plaie et débridement (pointu)
Le débridement chirurgical ou à vif systématique est actuellement le seul traitement efficace et durable du biofilm de la plaie recommandé par le consensus d’experts [6] ; cependant, il ne s’agit pas toujours d’une option réalisable dans le cadre des soins à domicile (par ex. hygiène limitée, patients sous anticoagulants médicamenteux). L’application de ce traitement local, relativement agressif, même sur des plaies “calmes” colonisées par un biofilm (Fig. 2), demande parfois un effort de la part du praticien : Après avoir retiré le pansement, la plaie doit être inspectée visuellement ou à l’aide de la lumière UV afin de détecter la présence éventuelle d’un biofilm et de l’éliminer à l’aide d’une curette et/ou d’un scalpel, le cas échéant. Ce n’est qu’après son élimination que les substances antimicrobiennes contenues dans les solutions et les pansements peuvent agir efficacement contre les micro-organismes pathogènes restants.
L’indication de débridement chirurgical est souvent posée lorsqu’il est nécessaire d’éliminer non seulement le biofilm de la plaie mais aussi les tissus nécrotiques [22]. Il est réalisé sous anesthésie de conduction ou par intubation. Comparé au débridement à vif, il est plus invasif et élimine également une partie des berges et du lit de la plaie au moyen d’un scalpel et d’un shaver. La taille de la plaie augmente donc dans un premier temps. Une autre option pour éliminer le biofilm de la plaie est le débridement chimique (par ex. Debrichem®), qui élimine efficacement les bactéries, mais infiltre également le lit et les berges de la plaie. Ici, les bactéries profondes sont tuées, mais les cellules humaines sont également impliquées, de sorte qu’ici aussi, l’élargissement de la plaie est primaire [23,24].
Conclusion
Le biofilm (bactérien) de la plaie nécessite un traitement complexe au niveau local, car il est constitué de plusieurs “composants”. Il est important de réaliser qu’il est présent sur plus de 75% des plaies chroniques et qu’il peut donc être éliminé. Le nettoyage de la plaie à l’aide d’une solution de rinçage et d’une compresse ne suffit pas. La persistance d’une colonisation par un biofilm fait stagner la cicatrisation de la plaie. Cependant, indépendamment de la thérapie locale, il convient toujours de traiter de manière causale la maladie sous-jacente qui a entraîné la chronicité de la plaie. En conséquence, une plaie fortement exsudative et colonisée par un biofilm n’est pas une contre-indication à un traitement par compression médicalement indiqué (par ex. en cas d’IVC, de lymphœdème ou de lipœdème).
Messages Take-Home
- Le diagnostic et le traitement de la maladie sous-jacente sont toujours essentiels pour les patients souffrant de plaies chroniques.
- Environ 78% des plaies chroniques sont colonisées par des micro-organismes pathogènes sous forme de biofilms.
- Les principales espèces bactériennes présentes dans les biofilms des plaies sont S. aureus et P. aeruginosa.
- Les solutions de rinçage des plaies et les pansements antimicrobiens adressent et tuent les bactéries. Cependant, ils ne pénètrent souvent pas l’EPS du biofilm, qui est principalement composé de polysaccharides et de protéines, et ne peuvent donc pas agir efficacement.
- Le débridement systématique à vif ou chirurgical est actuellement le seul traitement efficace et durable du biofilm de la plaie recommandé par le consensus des experts.
Littérature :
- Noskin GA, Rubin RJ, Schentag JJ, et al : National trends in Staphylococcus aureus infection rates : impact on economic burden and mortality over a 6-year period (1998-2003). Clin Infect Dis 2007 ; 45(9) : 1132-1140.
- James GA, Swogger E, Wolcott R, et al : Biofilms in chronic wounds. Wound Repair Regen 2008 ; 16(1) : 3-44.
- Heyer K, Herberger K, Protz K, et al : Epidemiology of chronic wounds in Germany : Analysis of statutory health insurance data. Wound Repair Regen 2016 ; 24(2) : 434-442.
- Hachenberg T, Senturk M, Jannasch O, Lippert H : [Postoperative wound infections. Pathophysiology, risk factors and preventive concepts]. Anaesthesist 2010 ; 59(9) : 851-866 ; quiz 867-858.
- Augustin M SrE, Dissemond J, Gerber V, et al. : Recommandations pour l’amélioration de la structure de soins pour les personnes atteintes de plaies chroniques en Allemagne. Gestion des plaies 2020 ; 14 : 357-365.
- Malone M, Bjarnsholt T, McBain AJ, et al : The prevalence of biofilms in chronic wounds : a systematic review and meta-analysis of published data. J Wound Care 2017 ; 26(1) : 20-25.
- Jockenhofer F, Gollnick H, Herberger K, et al : Bacteriological pathogen spectrum of chronic leg ulcers : Results of a multicenter trial in dermatologic wound care centers differentiated by regions. J Dtsch Dermatol Ges 2013 ; 11(11) : 1057-1063.
- Flemming HC, Wingender J. : La matrice du biofilm. Nat Rev Microbiol 2010 ; 8(9) : 623-633.
- Rembe JD, Stuermer EK : L’antisepsie moderne des plaies – Indications et limites, entre connaissance, désir et incertitude. Chirurgie vasculaire 2020 ; 25 : 272-276.
- Stuermer EK, Besser M, Debus ES, et al. : Bacterial infiltration in biofilm-colonized wounds : Analyses in the hpBIOM ex vivo wound model and possible impact on swabbing and debridement. Int Wound J 2022 (sous révision).
- Thurlow LR, Hanke ML, Fritz T, et al : Les biofilms de Staphylococcus aureus préviennent la phagocytose des macrophages et atténuent l’inflammation in vivo. J Immunol 2011 ; 186(11) : 6585-6596.
- Cowan T : Les biofilms et leur gestion : du concept à la réalité clinique. J Wound Care 2011 ; 20(5) : 220, 222-226.
- Larsen T, Fiehn NE : Résistance des biofilms de Streptococcus sanguis aux agents antimicrobiens. APMIS 1996 ; 104(4) : 280-284.
- Percival SL, Salisbury AM, Chen R : Silver, biofilms and wounds : resistance revisited. Crit Rev Microbiol 2019 ; 45(2) : 223-237.
- Besser M, Dietrich M, Weber L, et al : Efficacité des antiseptiques dans un nouveau modèle de biofilm de plasma humain en 3 dimensions (hpBIOM). Sci Rep 2020 ; 10(1) : 4792.
- Williams P, Winzer K, Chan WC, Camara M : Look who’s talking : communication and quorum sensing in the bacterial world. Philos Trans R Soc Lond B Biol Sci 2007 ; 362(1483) : 1119-1134.
- Johani K, Malone M, Jensen SO, et al. : Evaluation of short exposure times of antimicrobial wound solutions against microbial biofilms : from in vitro to in vivo. J Antimicrob Chemother 2018 ; 73(2) : 494-502.
- Rembe JD, Huelsboemer L, Plattfaut I, et al. : Antimicrobial Hypochlorous Wound Irrigation Solutions Demonstrate Lower Anti-biofilm Efficacy Against Bacterial Biofilm in a Complex in-vitro Human Plasma Biofilm Model (hpBIOM) Than Common Wound Antimicrobials. Front Microbiol 2020 ; 11 : 564513.
- Rembe JD, Fromm-Dornieden C, Stuermer EK : The influence of human acute wound fluid (AWF) on the antibacterial efficacy of different antiseptic polyurethane foam dressings : an in-vitro analysis. Wound Repair Regen 2018 ; 26 : 27-35.
- Schwarzer S, James GA, Goeres D, et al : The efficacy of topical agents used in wounds for managing chronic biofilm infections : A systematic review. J Infect 2020 ; 80(3) : 261-270.
- Stuermer EK, Plattfaut I, Dietrich M, et al : Activité in vitro des pansements antimicrobiens sur le biofilm de la plaie P. aeruginosa. Front Microbiol 2021 ; 12 : 664030.
- Dissemond J, Bültemann A, Gerber V, et al. : Prise de position de l’Initiative Plaies Chroniques (ICW) e.V. sur la nomenclature du débridement des plaies chroniques. Hautarzt 2022 ; 24 [Online ahead of print].
- Schwarzer S, Radzieta M, Jensen SO, Malone M : Efficacité d’un agent topique pour les plaies, l’acide méthane-sulfonique et le diméthylsulfoxyde sur les biofilms in vitro. Int J Mol Sci 2021 ; 22 : 9471.
- Cogo A, Quint BJ, Bignozzi CA : Restarting the Healing Process of Chronic Wounds Using a Novel Desiccant : A Prospective Case Series. Blessures 2021 ; 33 : 1-8.
DERMATOLOGIE PRATIQUE 2022 ; 32(2) : 6-11













