Le principal problème de l’angioplastie est la sténose récidivante, qui est due dans un grand pourcentage au développement d’une hyperplasie néo-intimale (NIH). Celle-ci peut être efficacement supprimée par l’application de médicaments antiprolifératifs sur les stents et les ballons. Les premières études sur le sujet montrent des résultats encourageants, mais d’autres études randomisées devraient fournir davantage d’informations sur les effets secondaires potentiels, sur la sélection des patients et également sur le rapport coût-efficacité.
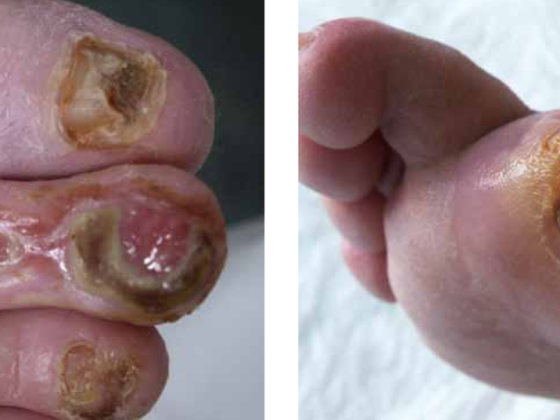
De nombreuses études épidémiologiques utilisant des techniques d’examen objectives montrent une prévalence de l’artériopathie oblitérante périphérique (AOP) de 3 à 10 % et de 15 à 20 % à partir de l’âge de 70 ans. Cliniquement, l’AOP se présente sous forme de stades allant du patient asymptomatique à l’ischémie critique des membres (“critical limb ischemia”, CLI). Une fois le diagnostic de CLI posé, 30% des patients subissent une amputation au cours de la première année, 20% présentent des douleurs et des ulcérations persistantes [1]. La mortalité à un an y est de 20%, le sort des patients étant dominé par les événements cardiaques et cérébraux. La revascularisation constitue donc un objectif thérapeutique primaire. Le succès technique de l’angioplastie transluminale percutanée (ATP) est généralement très élevé. Pour les événements aigus tels que les dissections limitant le flux et le “recoil élastique” de l’artère, le stent offre une solution mécanique au sens d’un soutien vasculaire. Le principal problème de la méthode est la survenue d’une sténose récidivante, qui survient dans 30 à 50% des cas/an, en fonction de la longueur et de la localisation de la lésion. La principale cause de la sténose récidivante est la formation d’une hyperplasie néo-intimale (NIH). Celle-ci peut être efficacement supprimée par l’application topique de médicaments antiprolifératifs. Dans le cas de l’angioplastie coronaire percutanée, ce concept est appliqué avec succès depuis bientôt dix ans et est largement soutenu par plusieurs études randomisées. En revanche, les preuves relatives à cette méthode sont nettement moins nombreuses dans la zone périphérique du courant. Un article de synthèse sur le sujet a déjà été publié dans VASA 02/2012 [2]. Les résultats actuels de l’étude ont été complétés ci-dessous.
Sténose récidivante après angioplastie
L’HNI est le résultat d’une cascade vasoproliférative qui commence lors d’un traumatisme vasculaire par la PTA avec une lésion endothéliale et une activation plaquettaire. Les mécanismes biochimiques complexes impliqués dans le développement des NIH ne sont pas encore totalement compris. Des événements secondaires tels que le stress oxydatif et l’inflammation provoquent, via une augmentation des radicaux libres, l’expression de différentes métalloprotéinases matricielles (MMP) qui contribuent à la dégradation du collagène et de l’élastine dans la paroi artérielle et permettent ainsi la migration des cellules dans l’intima vasculaire. Le paradigme selon lequel ces cellules sont uniquement des cellules musculaires lisses issues de la média vasculaire qui ont perdu l’expression de la desmine et la contractilité et qui expriment désormais la vimentine a été remis en question par les recherches de plusieurs groupes. Il a ainsi été démontré qu’après une angioplastie coronaire ou un pontage, des fibroblastes migrent de l’adventice vers l’intima en passant par la média et acquièrent l’expression de la SMA (“smooth muscle actin”), se transformant ainsi en myofibroblastes [3–5]. Après PTA de shunts de dialyse, des cellules musculaires lisses et des cellules endothéliales dérivées de cellules souches circulantes de la moelle osseuse ont également été détectées [6]. D’un point de vue thérapeutique, il s’agit d’une base prometteuse pour de nouvelles approches thérapeutiques.
Une fois dans l’intima vasculaire, les myofibroblastes prolifèrent et synthétisent des protéines matricielles extracellulaires. Ce processus se termine typiquement environ trois à quatre mois après le traumatisme vasculaire par une couche de cellules néo-intimales qui, selon son épaisseur, peut rétrécir la lumière du vaisseau au point de provoquer une sténose récidivante. L’application de médicaments antiprolifératifs inhibiteurs du cycle cellulaire sur les ballonnets et les stents (paclitaxel, sirolimus, évérolimus) supprime efficacement la formation de la couche néointimale. L’administration topique permet d’obtenir des concentrations locales élevées de principe actif, sans effets secondaires systémiques potentiels.
Le sirolimus (rapamycine) est un macrolide naturel ayant une action immunosuppressive. Il est capable d’augmenter la concentration de la protéine inhibitrice du cycle cellulaire p27, ce qui inhibe la transition de la phase G1 à la phase S de la cellule. L’évérolimus, qui est un dérivé du sirolimus, a le même mécanisme d’action. La substance active Paclitaxel (PTX) a été isolée à l’origine de l’écorce de l’if du Pacifique (Taxus brevifolia). Depuis peu, il peut être obtenu par synthèse partielle à partir de l’if européen. Le paclitaxel se lie de manière irréversible à la bêta-tubuline et empêche ainsi la dégradation des microtubules, ce qui empêche la cellule de se diviser de manière mitotique. Le paclitaxel est fortement lipophile et est donc rapidement absorbé par la paroi vasculaire.
Situation des études
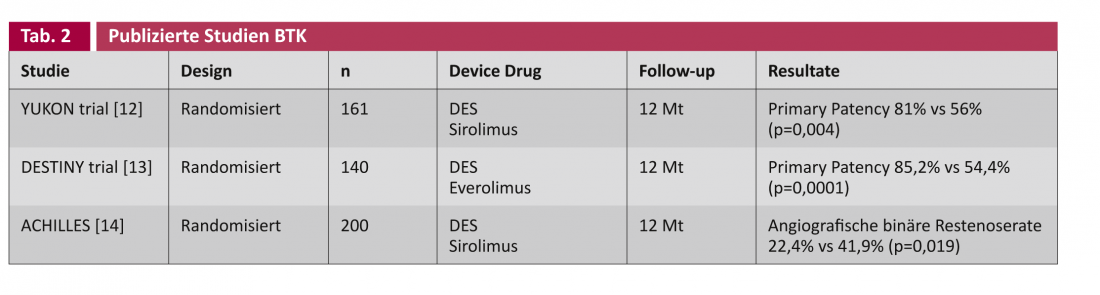
Dans les études sur les “drug-eluting stents” (DES) et les “drug-coated balloons” (DCB), on distingue généralement les applications aux artères fémoropoplitées de calibre élevé (tableau 1) et aux artères de la jambe (“below the knee”, BTK), plus étroites en conséquence (tableau 2).
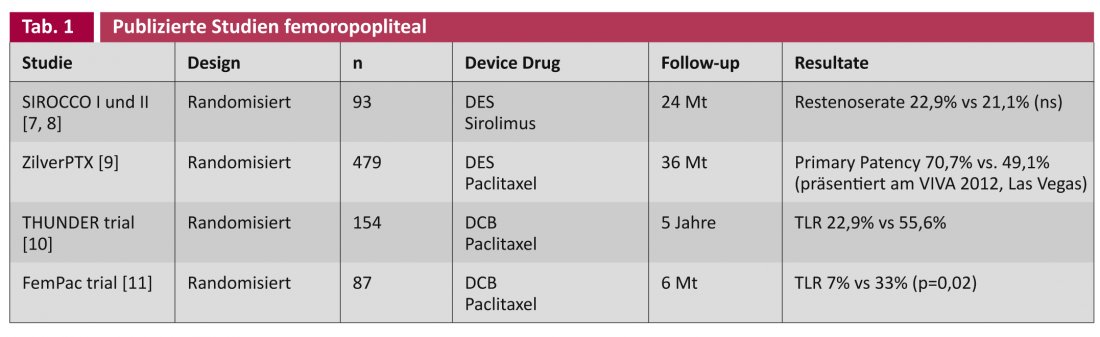
Les études SIROCCO ont été lancées respectivement en 2002 et en 2003. 2006, un stent recouvert de sirolimus a été comparé de manière randomisée au même stent non recouvert dans le traitement de l’artère fémorale superficielle [7, 8]. Après deux ans, aucune différence n’a été constatée dans l’apparition de la sténose récidivante, peut-être en raison de la concentration de sirolimus choisie trop faible (90 μg/cm2). La récente étude multicentrique prospective randomisée ZilverPTX®-Stent compare, chez 479 patients, un stent en nitinol recouvert de paclitaxel (3 μg/mm2) à l’angioplastie par ballonnet seul (“plain old balloon angioplasty”, POBA), respectivement au même “bare metal stent” (BMS) non recouvert. L’étude a été conçue pour durer cinq ans et les résultats intermédiaires sont régulièrement communiqués lors des congrès : Après trois ans, le stent revêtu montre une supériorité statistiquement significative de 70,7% par rapport à 49,1% pour la patience primaire (= “absence de sténose récurrente à l’angiographie ou à l’échographie duplex”) (présenté à VIVA 2012, Las Vegas).
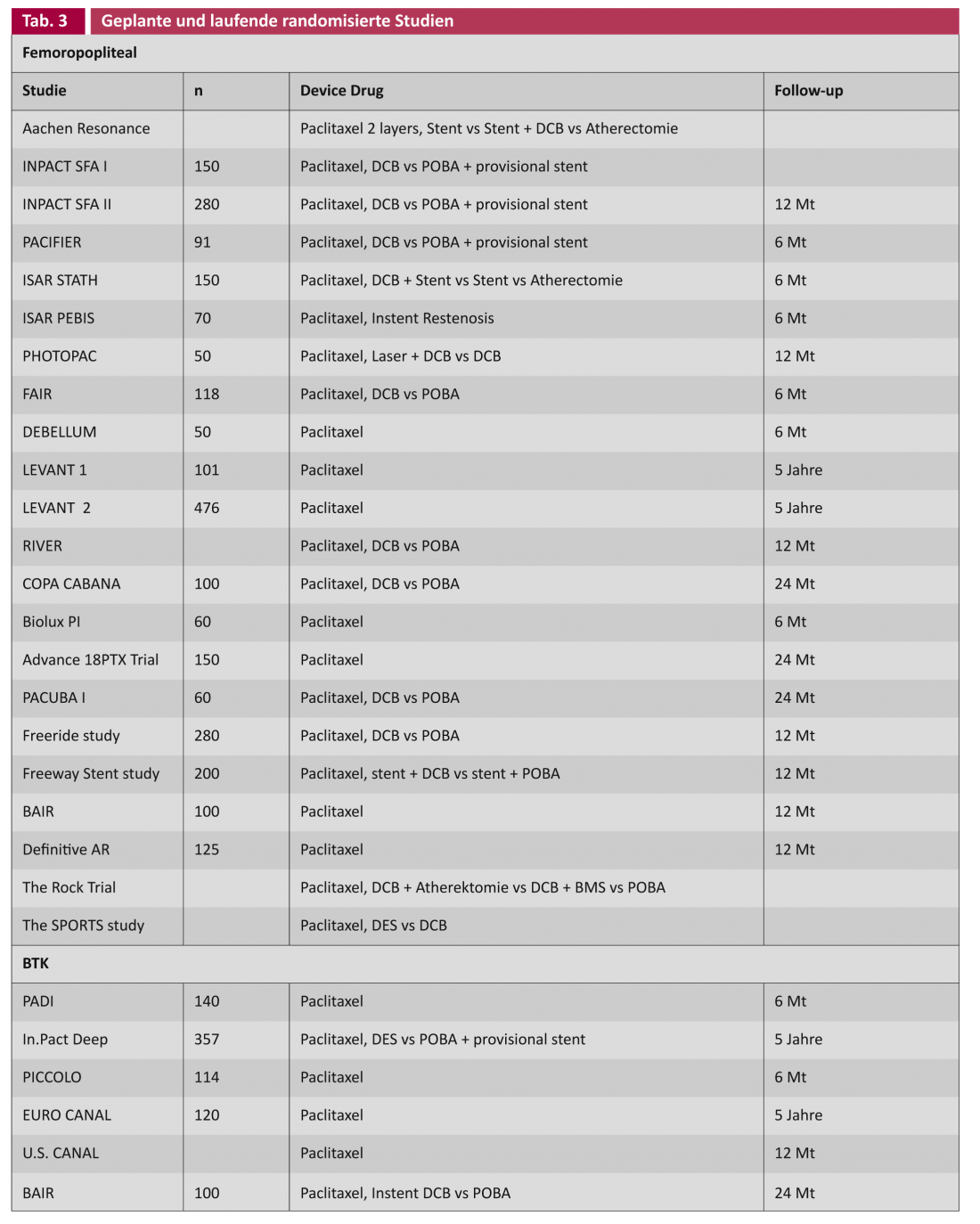
En principe, dans le traitement des lésions vasculaires, il est souhaitable de ne pas laisser de matériel étranger tel qu’une endoprothèse. Le concept du DCB tient compte de cette situation. Dans l’essai THUNDER, le taux de réintervention (“target lesion revascularization”, TLR) présente encore un avantage significatif pour le DCB après cinq ans, même si les lésions vasculaires sont courtes (Leipzig Interventional Course 2012). La question clé reste de savoir s’il existe une place pour le DCB dans les lésions longues et fortement calcifiées. Des études examinant le DCB en association avec d’autres technologies telles que l’athérectomie, ainsi que toute une série d’études sur le DCB en application primaire sont en cours (tableau 3).
L’application de la technologie de “drug-eluting” dans le segment artériel infrapoplité nécessite un examen séparé. Les patients souffrant d’ischémie critique des membres présentent généralement de multiples obstructions des artères des membres inférieurs, comme on le voit chez les diabétiques et les patients souffrant d’insuffisance rénale sévère. En garantissant au moins un vaisseau ouvert jusqu’au pied (“straight line flow”), la cicatrisation des plaies devrait être améliorée et le taux d’amputation réduit. Cependant, l’angioplastie seule des artères de la jambe donne souvent un résultat de dilatation insuffisant, notamment en raison de la longueur des occlusions vasculaires. Les dissections et les recoils y sont fréquents, ce qui peut potentiellement entraîner une occlusion précoce dans les artères à calibre fin.
Scheinert et al. ont été les premiers à mettre en place un stent coronaire à élution de médicament par voie infrapoplitée chez 30 patients en 2006. Après six mois, aucune sténose récidivante n’a été détectée [15]. L’étude YUKON-BTK a examiné cela de manière randomisée avec un stent recouvert de sirolimus et a également trouvé une supériorité statistiquement significative du DES dans la paternité primaire (81% vs 56%, p=0,004) [12]. D’autres études randomisées publiées sur le sujet sont DESTINY [8] et ACHILLES [14], qui trouvent également cette primary patentcy statistiquement meilleure pour le DES.
Cependant, la technologie n’apporte pas encore d’avantage démontrable en ce qui concerne les critères cliniques importants que sont l’amputation et le décès, comme le soulignent Rastan et al. dans une revue des données regroupées sur 1 039 patients des études ci-dessus [16].
Discussion
Outre les études randomisées mentionnées ci-dessus, il existe toute une série de données de registres [2]. L’interprétation des résultats permet de conclure que le revêtement médicamenteux, analogue à l’angioplastie coronaire, est une méthode prometteuse dans le traitement de l’AOP. Il apparaît avec de plus en plus d’évidence qu’il est possible de réduire le taux de sténoses récidivantes et donc potentiellement les réinterventions, tant au niveau fémoropoplité qu’infrapoplité. Il est toutefois prématuré d’en faire un “gold standard”, d’autant plus que les études randomisées et les critères d’inclusion ne reflètent pas toujours les conditions régulières de la vie quotidienne. Les résultats des grandes études en cours fourniront davantage d’informations sur les effets secondaires potentiels, sur la sélection correcte des patients et sur le rapport coût/bénéfice. (tableau 3). Ce dernier point mérite une attention particulière, car la réduction potentielle du taux de réintervention permet d’espérer une réduction des coûts, comme cela a été démontré dans des études de cardiologie avec l’utilisation du DES. [17].
Il n’existe pas de données prospectives randomisées concernant le traitement post-opératoire par double antiagrégation. Selon le consensus suisse, la double antiagrégation est généralement administrée pendant un mois après l’implantation d’un BMS périphérique [18]. En raison de la réendothélialisation retardée après l’implantation du DES/DCB, celle-ci est effectuée plus longtemps, comme en cardiologie. Dans les études citées, cette durée variait entre un et six mois en fonction de la région vasculaire traitée.
Littérature :
- Norgren L, et al ; TASC II working group : J Vasc Surg 2007 ; 45 Suppl : S5-67.
- Buechel R, Stirnimann A, Zimmer R, Keo H, Groechenig E : VASA 2012 ; 41(4) : 248-261.
- Scott NA, et al : Circulation 1996 ; 93(12) : 2178-2187.
- Shi Y, et al : Circulation 1996 ; 94(7) : 1655-1664.
- Shi Y, et al : Circulation 1997 ; 95(12) : 2684-2693.
- Sata M, et al : Nat Med 2002 ; 8(4) : 403-409.
- Duda SH, et al : Circulation 2002 ; 106(12) : 1505-1509.
- Duda SH, et al : J Endovasc Ther 2006 ; 13(6) : 701-710.
- Dake MD, et al ; au nom des investigateurs de Zilver PTX : Circ Cardiovasc Intervent 2011 ; 4(5) : 495-504.
- Tepe G, et al. : NEJM 2008 ; 358(7) : 689-699.
- Werk M, et al : Circulation 2008 ; 118(13) : 1358-1365.
- Rastan A, et al : Eur Heart J 2011 ; 32 : 2274-2281.
- Bosiers M, et al : J Vasc Surg 2012 ; 55(2) : 390-398.
- Scheinert D, et al ; Investigateurs ACHILLES : J Am Coll Cardiol 2012 ; 60(22) : 2290-2295.
- Scheinert D, et al. : EuroIntervention 2006 ; 2(2) : 169-174.
- Rastan A, Noory E, Zeller T : Vasa 2012 ; 2 : 90-95.
- Filion KB, et al : Am J Cardiol 2009 ; 103(3) : 338-344.
- Jäger K, et al : Forum Med Suisse 2009 ; 9(39) : 690.
CARDIOVASC 2013 ; 12(1), 15-19